围产期低蛋白饲料对子代大鼠肠道葡萄糖转运体表达及糖代谢的影响
2023-01-15李宇君杨妙妍薛阳利梁俊荣
李宇君,王 楠,杨妙妍,张 琳,薛阳利,郑 乐,梁俊荣
(1西安交通大学第二附属医院内分泌科,西安 710004;2陕西中医药大学基础医学院人体解剖学教研室;3空军军医大学唐都医院消化内科;#共同第一作者;*通讯作者,E-mail:liangjunrong2009@163.com)
母代的妊娠期是其宫内胎儿肠道发育的关键时期,为胎儿从子宫到外部环境的过渡做准备[1]。妊娠期间的某些环境变化如蛋白质缺乏,可能会扰乱子代肠道的发育并对子代的代谢产生长期的影响。由于葡萄糖主要经过肠道转运吸收进入机体,因此探讨母代的蛋白质缺乏对子代肠道糖转运相关受体的影响,对于研究糖代谢受损机制有比较确切的意义和价值。肠道葡萄糖转运主要由钠依赖葡萄糖转运蛋白1(SGLT1)介导,而SGLT1也参与葡萄糖诱导的肠促胰岛素的分泌[2]。另外,葡萄糖转运体2和5(GLUT2和GLUT5)在葡萄糖或果糖从肠细胞释放进入循环的过程中也发挥主要介导作用[3]。此外,消化道分泌的多种激素通过多种作用途径参与调节机体糖代谢及脂代谢。胰岛素由胰岛β细胞分泌,是降低血糖的重要激素,也可以促进蛋白质和脂肪合成[4]。胰高糖素样肽-1(GLP-1)由回肠和结肠中的L细胞分泌,以葡萄糖依赖的方式刺激胰岛素分泌,改善脂质代谢,并参与调节食欲和摄食行为[5,6]。酪氨酸-酪氨酸多肽(PYY)主要由远端肠道L细胞分泌,抑制食欲,延缓胃排空,并参与调节葡萄糖和脂肪诱导的胰岛素分泌[7]。国内外研究中,关于母代的蛋白质缺乏对子代葡萄糖代谢产生影响的文章较多,但是其机制尚不明确,尤其与肠道转运体相关的研究很少。本实验中,对大鼠在妊娠和哺乳期间给予低蛋白饲料的干预,在子鼠离乳后给予标准饲料,从子鼠出生后每周测量体质量,在子鼠3周龄和10周龄时进行葡萄糖耐量试验,检测糖脂代谢相关激素的浓度,并评估子鼠肠道葡萄糖转运体的表达。通过这些实验,初步探讨亲代低蛋白饮食对子代葡萄糖代谢、糖脂代谢相关激素及肠道糖转运体的影响,以及在子代离乳后,通过喂食标准饮食后能否逆转这一影响。
1 材料与方法
1.1 动物饲养
妊娠第2天的雌性SD清洁级大鼠12只,购自西安交通大学医学试验动物中心,生产许可证号:SCXK(陕)2018-001。单笼饲养,自由采食饮水。饲养室温度(23±1)℃,相对湿度55%~60%,12 h亮暗交替。动物试验获得西安交通大学动物保护委员会的批准。饲料购自北京科澳协利饲料有限公司。将12只妊娠大鼠随机分为标准饲料组(饲喂22.8%蛋白质的饲料)和低蛋白饲料组(饲喂12.8%蛋白质的饲料),2种饲料的组分、含量及提供的热量比例见表1,所有的大鼠妊娠期间均单独饲喂。将分娩日设为子鼠出生第0天,自子鼠出生后第1天起,每笼只保留4只子代雄鼠,所有母鼠的喂养情况与妊娠期间相同,并使每只子鼠保证相似的奶水供应条件,每周称子鼠体质量。子鼠3周龄离乳之后给所有的子鼠均喂食标准饲料直到10周龄。每周测量1次食物摄取量和子鼠体质量。计算体质量增加值=(n+1周体质量-n周体质量)/n周体质量。计算相对食物摄取量(=绝对摄食量/体质量)。另外,在子鼠第2,3,7,10周,计算体质量指数(=体质量/鼻尖到尾根的长度的平方)和生长效率(=体质量/食物摄取量)。
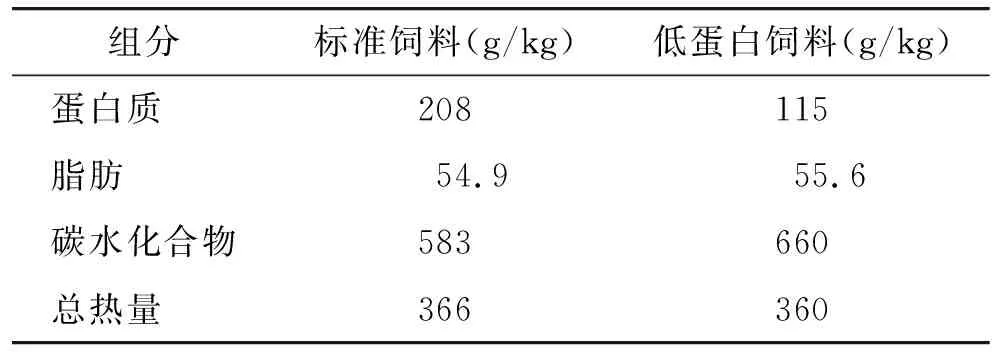
表1 大鼠标准饲料和低蛋白饲料的配方Table 1 Composition of standard diet and PR diet for rats
1.2 应用血糖仪和酶联免疫吸附试验检测葡萄糖耐量及胰岛素释放
在3周龄和10周龄,从每笼子鼠中随机选取1只,进行口服葡萄糖耐量试验(OGTT)。子鼠禁食12 h(可饮水),口服20%葡萄糖(2.0 g/kg)无菌水溶液,口服葡萄糖后0,30,60,120 min测血糖,由罗氏血糖仪通过尾部小划痕检测基线血糖。应用大鼠胰岛素酶联免疫吸附试验试剂盒(武汉华美生物工程有限公司,产品编号CSB-E05070r)检测静脉血清胰岛素。
1.3 组织和血液样本的收集和处理
为了避免糖耐量试验对子鼠发育的潜在影响,对另外2只未进行糖耐量试验的子鼠分别采集3周龄和10周龄的血液和十二指肠、空肠和回肠的组织样本。子鼠禁食4 h后采集血液,4 ℃低温离心机2 000g离心15 min,上清(即血清)在-80 ℃保存。处死后取其十二指肠、空肠和回肠纵向分开,用生理盐水冲洗,-80 ℃保存。
1.4 大鼠代谢性激素磁珠板检测血浆中激素水平
取出-80 ℃保存的血清,添加DPP4抑制剂后,应用大鼠代谢性激素磁珠板(美国Millipore公司,产品编号RMHMAG-84K),严格按照产品说明书的步骤检测血清中胰岛素、GLP-1和PYY的浓度。
1.5 应用半定量和实时定量PCR的方法检测目的基因的表达水平
从冷冻小肠组织中切取直径约为3 mm的组织块,应用TRIzol法提取RNA:加入TRIzol试剂1 ml和磁珠后,使用电动匀浆器研磨20 min;取出磁珠,静置5 min;加入氯仿0.2 ml,剧烈振荡15 s后静置3 min;4 ℃离心机12 000g离心15 min;将上层水相层移入1.5 ml无RNA酶EP管,加入异丙醇0.5 ml,混匀后室温下静置10 min;4 ℃离心机,转速12 000 r/min,离心10 min,弃上清;加入1 ml 75%乙醇清洗RNA,转速7 500 r/min,4 ℃离心5 min,弃上清,吸水纸沥干;再次于4 ℃离心机,转速7 500 r/min,离心5 min,吸弃管中残余乙醇并风干RNA沉淀;根据RNA沉淀的大小加20~80 μl DEPC水,混匀后瞬离,在60 ℃金属浴温育15 min;测定RNA浓度。应用反转录试剂盒(Transcriptor First Strand cDNA Synthesis Kit两步法)反转录为cDNA,严格按照反转录试剂盒说明书进行操作。半定量PCR试验反应条件为:95 ℃ 5 min,95 ℃ 45 s,60 ℃ 45 s,72 ℃ 45 s,共35个循环,72 ℃延伸5 min。4 ℃冷却保存。PCR产物用1.2%琼脂糖凝胶电泳验证。实时荧光定量PCR试验,应用SYBR®Green Master Mix试剂盒(TaKaRa公司),并严格按照说明书操作,PCR反应条件为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,38个循环,读板,60 ℃到95 ℃温度递增测定溶解曲线。所用引物见表2。

表2 半定量PCR和实时定量PCR试验的引物序列Table 2 Primer sequences used for RT-PCR and qRT-PCR
1.6 统计学分析
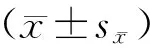
2 结果
2.1 亲代低蛋白饮食对子鼠体质量和食物摄入量的影响
与标准组子鼠相比,低蛋白组子鼠在离乳前(3周内)平均体质量降低(P<0.05),离乳后均给予标准饲料,观察至10周龄,低蛋白组子鼠平均体质量仍较标准组降低(P<0.05,见图1)。标准组子鼠从第3周开始快速增长,而低蛋白组子鼠的体质量增加在前3周均处于较低水平,从第4周开始增长加快,并且体质量增加量高于标准组(P<0.05),直到10周龄降低到与标准组相似的水平(见图1)。4~10周龄低蛋白组子鼠的绝对食物摄取量(绝对摄食量)低于标准组(P<0.05),但是相对摄食量高于标准组(见图1)。在第2,3,7,10周计算子鼠的体质量指数,低蛋白组子鼠体质量指数(BMI)也低于标准组(见图1)。低蛋白组子鼠在4~10周的生长效率持续偏低(见图1)。

与标准组比较,*P<0.05,**P<0.01,***P<0.001;样本每组6笼,3周龄前每笼4只子鼠,3周龄后每笼2只子鼠图1 标准组和低蛋白组子鼠的体质量及摄食量Figure 1 Body weight and food intake of the offspring in standard group and PR group
2.2 亲代低蛋白饮食对子鼠口服葡萄糖耐量试验的影响
在3周龄离乳时行口服糖耐量试验,两组子鼠空腹血糖均在5.2 mmol/L左右,在口服葡萄糖30 min时血糖浓度最高,60 min血糖逐渐下降,120 min恢复正常;其中在30,60 min时,低蛋白组子鼠的平均血糖水平低于标准组(P<0.05,见图2)。检测两组的胰岛素水平,低蛋白组在60 min时胰岛素分泌高于标准组(P<0.05),120 min时回落到与标准组相似的水平(见图2)。在10周龄时,两组均在30 min血糖浓度最高,而低蛋白组的平均血糖水平高于标准组(P<0.01,见图2)。低蛋白组胰岛素水平在0 min时较标准组子鼠低(P<0.01),其余节点两者无明显差异(见图2)。10周龄时,低蛋白组子鼠的平均血糖升高,说明其胰岛素分泌相对不足导致糖代谢稳态失衡。

与标准组比较,*P<0.05,**P<0.01图2 标准组和低蛋白组子鼠在3周龄和10周龄的口服葡萄糖耐量试验 (n=6)Figure 2 Oral glucose tolerance test results of the offspring in standard group and PR group at 3 weeks or 10 weeks of age (n=6)
2.3 亲代低蛋白饮食对子鼠血液中糖脂代谢相关激素浓度的影响
在3周龄和10周龄时检测低蛋白饲料对静脉血中糖脂代谢相关激素浓度的影响。结果提示,与标准组相比,3周龄时低蛋白组子鼠血浆GLP-1水平降低(P<0.05),但是胰岛素和PYY没有明显差异(见图3);与标准组比较,10周龄时低蛋白组子鼠血浆胰岛素水平降低(P<0.01),GLP-1和PYY水平也降低(P<0.05,见图3)。

与标准组比较,*P<0.05,**P<0.01图3 标准组和低蛋白组子鼠血液中糖脂代谢相关激素的浓度 (n=6)Figure 3 Concentrations of glucose metabolism-related hormones in blood of offspring in standard group and PR group (n=6)
2.4 子鼠的小肠组织中SGLT-1,GLUT2和GLUT5的mRNA表达
分别应用半定量PCR试验和实时荧光定量PCR试验比较低蛋白组与标准组子鼠的小肠组织中SGLT-1、GLUT2和GLUT5这3种基因的mRNA表达水平。结果表明,与标准组相比,低蛋白组的子鼠3周龄时十二指肠、空肠组织中3种基因的mRNA表达水平均增加,回肠组织中仅GLUT2和GLUT5的mRNA表达增加(P<0.05,见图4)。在10周龄时,与标准组相比,低蛋白组子代的十二指肠组织中SGLT-1的mRNA表达升高(P<0.05),而GLUT2和GLUT5的表达无统计学差异(见图4);10周龄低蛋白组子代的空肠组织中SGLT-1和GLUT2的表达水平均较标准组升高(P<0.05),而GLUT5的mRNA的表达无统计学差异;但是10周龄回肠组织中3种基因的mRNA表达水平,两组间均无统计学差异(见图4)。

M. 100~1 000 bp DNA分子量标记;与标准组比较,*P<0.05,**P<0.01图4 标准组和低蛋白组子鼠小肠组织中SGLT-1、GLUT2和GLUT5的mRNA表达 (n=6)Figure 4 The mRNA expression of SGLT-1, GLUT2 and GLUT5 in small intestine tissue of offspring in standard group and PR group (n=6)
3 讨论
产妇在围产期的营养状况,对后代的代谢造成长期的影响。本研究中建立了围产期低蛋白饲养大鼠模型,结果表明母代的低蛋白饮食对后代的早期生长和糖耐量有显著影响。首先,与标准组相比,母代在妊娠期和哺乳期给予低蛋白饲料,导致子代出生时低体质量。在3周龄离乳后给予标准饲料,从4周龄开始至10周龄,其体质量增加量及相对食物摄取量高于标准组,出现了追赶性生长。但是其体质量、绝对食物摄取量、体质量指数一直低于标准组,说明离乳后提供标准蛋白含量的饮食,也不可能完全纠正其发育的缺陷。由于4周龄以后的大鼠即为成年鼠,因此得出结论,母代的低蛋白饮食对子代体质量的影响可持续到成年。其次,母代的低蛋白饮食与子代成年后葡萄糖代谢异常有关。标准组的子代在3周龄和10周龄时,子鼠的糖耐量均在正常范围。低蛋白组子代3周龄时糖耐量尚在正常范围,但是在10周龄时,糖耐量试验中30 min的血糖浓度高于标准组,且胰岛素分泌低于标准组,说明胰岛素分泌相对不足。这一结果表明:母代的低蛋白饮食导致子代早期出现胰岛素分泌相对不足和糖耐量异常,成为糖尿病的高危人群。
体内多种激素参与调控葡萄糖的代谢,并且与胰岛β细胞功能相关。既往研究表明,在哺乳动物的妊娠期给予低蛋白饮食,会导致其子代胰岛β细胞功能障碍,使胰岛素和胰淀素等的分泌减少[8],并导致其成年后出现心血管疾病和代谢功能的异常[9]。胰岛素由胰岛β细胞分泌,是降低血糖的重要激素[4]。GLP-1是肠源性激素,以葡萄糖依赖的方式刺激胰岛素分泌,并参与调节食欲和摄食行为[5,6]。另外,PYY调节胰岛素分泌,增加机体对胰岛素的敏感性,还可以抑制胃肠蠕动,增加饱腹感[7]。这3种激素均与糖代谢密切相关,因此本研究检测了血浆中的胰岛素、GLP-1和PYY激素浓度。结果提示,与标准组相比,低蛋白组子鼠3周龄的GLP-1浓度降低,10周龄的胰岛素、GLP-1和PYY浓度均降低。说明在低蛋白组的子代,伴随着糖代谢稳态失衡,胰岛细胞功能逐渐下降,糖代谢相关的激素浓度也下降。由于上述激素也参与脂肪代谢,其分泌减少后,脂肪分解增加或生成障碍,脂肪含量减少,这是导致子鼠体质量减少的重要原因[10,11]。
母代低蛋白饮食导致子代低出生体质量及糖代谢失衡的遗传学机制尚不明确。有学者认为母体妊娠期的营养变化导致后代代谢性疾病风险增加的机制可能不是基于基因缺陷,而是由于在胎儿发育过程中为了适应环境变化,而通过表观遗传学等修饰改变了某些基因的表达[12]。比如有研究发现,大鼠母代的低蛋白饮食增加了子代肠道中能量代谢基因Pgc1a的mRNA表达,激活了PPARγ信号通路引起代谢异常[13]。据此推断母代的低蛋白摄入,使得胎儿营养缺乏,从而导致胎儿的肠道吸收和转运葡萄糖的相关受体发生了一定的适应性改变。
肠道葡萄糖的吸收主要由钠依赖性葡萄糖转运蛋白1(SGLT-1)介导,在病态肥胖的人群中,其SGLT-1基因表达增加,使得近端肠道葡萄糖吸收加快,肠促胰岛素分泌增多,导致高血糖和高胰岛素血症[3,14]。另外,肠道葡萄糖的过度吸收还与葡萄糖转运蛋白2和5(GLUT2和GLUT5)的表达和适应性增加有关[15-17]。因此进一步检测3周龄和10周龄子鼠的肠道中SGLT-1、GLUT2和GLUT5的mRNA表达。结果表明,母代低蛋白饮食增加了3周龄子代小肠组织中SGLT-1、GLUT2和GLUT5的mRNA水平,3周龄离乳后的子鼠给予标准饲料至10周龄时,十二指肠及空肠组织中的SGLT-1以及空肠组织中的GLUT2的表达仍高于标准组,而在3种小肠组织中检测GLUT5的表达与标准组无明显差异。综上,肠道葡萄糖转运体的增加使得子代的肠道对葡萄糖的感受、吸收增强,在相同的饮食条件下,加重了胰岛β细胞的负担,从而增加了糖耐量异常的风险。
综上,母代在围产期的低蛋白饮食导致子代肠道中葡萄糖转运相关基因SGLT-1、GLUT2和GLUT5的表达水平增加,使得肠道对葡萄糖的感受和吸收增强,加重了胰岛β细胞负担,影响了胰岛β细胞的功能,导致胰岛素分泌减少,从而影响了糖代谢稳态,并降低了子代血清中参与糖类代谢的激素(胰岛素、GLP-1和PYY)的浓度。由于这些激素也与脂类代谢相关,其分泌减少后,脂肪分解增加或生成障碍,这是导致子鼠出生时和发育早期的体质量减少的重要原因。如果在子代离乳后进食标准蛋白含量的饲料,可能会部分减弱这一影响,但不会完全逆转。本研究发现母代围产期的蛋白质缺乏导致小肠内葡萄糖转运体的表达上调,从而对胰岛β细胞和糖脂代谢相关激素产生一定影响,这可能是导致子代糖脂代谢紊乱的机制之一,对于肥胖和糖尿病的研究和药物开发提供了新思路。
