基于群体感应的弧菌生物膜形成、耐药性及其控制研究进展
2023-01-13刘雪晴吕欣然白凤翎励建荣
刘雪晴,吕欣然,2, ,白凤翎,励建荣
(1.渤海大学食品科学与工程学院,辽宁锦州 121013;2.大连工业大学,海洋食品精深加工关键技术省部共建协同创新中心,辽宁大连 116034)
弧菌是菌体短小,弯曲成弧形,尾部带一鞭毛的革兰氏阴性菌,被认为是一种常见的鱼类病原菌[1],主要包括霍乱弧菌(V. cholerae)、副溶血弧菌(V.parahaemolyticus)、创伤性弧菌(V. vulnificus)、哈维氏弧菌(V. harveyi)、溶藻性弧菌(V. alginate)等[2-3]。霍乱弧菌、副溶血弧菌与创伤性弧菌是常见的致病性弧菌,在摄入被污染的海产品后可造成霍乱及食物中毒[4-6]。溶藻性弧菌与哈维氏弧菌主要感染虾及鱼类,可导致鱼、虾、贝类等在育苗和养殖过程中暴发疾病甚至大量死亡,以及在生产运输过程中发生产品腐败变质,经济损失严重[7-8]。为防止弧菌污染海产品,常使用抗菌药物,但药物的大量使用使弧菌的耐药性明显增强,致使其污染海产品的概率大大增加,直接或间接导致了水产养殖业、水产品加工业以及其他相关产业的经济损失[9]。
群体感应(Quorum Sensing,QS)是指细菌通过监测种群群体密度进而相应地调节其基因表达的行为,是细菌群体之间进行通讯和交流的一种机制[10]。一种微生物可拥有多套群体感应系统、产生多种群体感应信号分子,协调或调控微生物的多种生物功能。其中最主要的是群体感应能够通过特定的调节因子或与其他信号分子共同作用来调节弧菌的生物膜形成和毒力因子的表达[11]。副溶血性弧菌可以产生两种类型的IV型菌毛:甘露糖敏感型血凝素IV型菌毛(MSHA)和几丁质调节菌毛(ChiRP)。它们都是生物膜形成所必需的。研究发现,副溶血性弧菌群体感应调节因子AphA和OpaR对副溶血性弧菌MSHA菌毛中编码菌毛蛋白的mshA1转录起相反的调节作用。在低细胞密度(LCD)下,AphA间接抑制mshA1转录。在高细胞密度(HCD)下,OpaR激活mshA1转录,促进了生物膜的形成[12]。与大部分弧菌不同的是,霍乱弧菌群体感应系统通过调控LuxR同源物HapR,使其能够与DNA直接结合,抑制其表面多糖合成基因vps的转录及表达,从而抑制生物膜的形成[13]。生物膜(Biofilm,BF)是由细菌及其自身代谢产生的胞外基质(Extracellular Polymeric Substances,EPS)(多糖、蛋白质、eDNA)粘附在某些生物或非生物材料表面,保护细菌正常生长的一种膜状结构群[14]。弧菌生物膜是海产品在捕捞与加工期间形成的环境与细菌之间的屏障,从而降低细菌对一些抗菌药物的敏感性[15]。有研究表明,大部分弧菌生物膜对β-内酰胺类、氨基糖苷类、大环内酯类、喹诺酮类等抗生素有不同程度的耐药[16]。
由于生物膜的广泛性和危害性,研究人员正积极地寻找新途径来预防和控制弧菌生物膜的形成[17]。本文针对弧菌生物膜与其群体感应系统的相关性,重点阐述了弧菌生物膜形成对耐药性的影响,并对化学合成类、植物源和微生物源等群体感应抑制剂控制弧菌生物膜的研究现状进行总结,为预防和控制弧菌生物膜形成奠定理论基础。
1 弧菌的群体感应系统和生物膜
1.1 弧菌的群体感应系统
弧菌的QS系统调控细菌生物发光、生物膜形成以及毒性基因表达等性状。弧菌群体感应系统主要包括:a.HAI-1型,该系统由N-酰基高丝氨酸内酯类(N-acylated homoserine lactones,AHLs)信号分子、AHLs合成酶(LuxM蛋白)和AHLs受体(LuxN蛋白)三部分组成,介导细菌种内通讯[18];b.AI-2型,是一种用于细菌种间交流的系统,信号分子是由LuxS蛋白合成的呋喃硼酸二酯(AI-2),当AI-2在菌体外积累到一定阈值时,其与LuxP受体蛋白结合后,再与激酶蛋白LuxQ反应启动相关毒力基因的表达[18];c.CAI-1型。信号分子为S-3-羟基十三烷-4-酮(CAI-1),CqsA是CAI-1合成酶蛋白,CqsS是CAI-1的组氨酸激酶受体[19]。费氏弧菌和哈维氏弧菌中发现HAI-1、AI-2和CAI-1三种类型QS系统,霍乱弧菌中包含CAI-1和AI-2两种QS系统,而创伤弧菌只有一条AI-2型QS系统[16]。由此可知,同属不同种的弧菌之间群体感应系统存在一定的差异性。
1.2 群体感应系统直接介导生物膜形成
弧菌生物膜易在海产品表面及其加工设备中因细菌沉降而形成。其形成过程一般包括4个阶段,如图1所示,即细菌的初始粘附、不可逆附着、成熟和老化阶段,该过程是动态变化的,且易受多种因素影响[20]。弧菌QS系统和环境信号应答系统共同调控生物膜的形成和成熟。当弧菌生长在不利的环境条件下时,可诱发其环境信号应答系统,使弧菌分泌QS信号分子,当信号分子累积达到一定阈值时,就会与受体蛋白结合,从而改变细胞内的调控元件转录或表达,促进EPS的合成,增强细菌的粘附能力,加速生物膜成熟与结构的稳定。弧菌QS系统中调控生物膜形成的终点控制因子LuxR及其同源物,可通过结合其靶基因启动子并激活生物膜相关基因的转录来调控生物膜的形成[21-22]。副溶血弧菌在不同的环境条件下通过切换菌落类型,表现出强的适应机制。其QS通路中luxR的同源基因opaR基因可以正向调节副溶血弧菌菌落不透明性和粘附因子的表达,并影响生物被膜的形成。当opaR过表达时,可以促进菌落混浊,进而促进生物膜的成熟[23]。在创伤弧菌和费氏弧菌中也观察到类似的现象[24]。以哈维氏弧菌为例,其QS系统调控生物膜形成如图2所示,在低自体诱导物浓度下,LuxN、LuxQ和CqsS等信号分子受体蛋白将磷酸基团传递到共用的磷酸转移酶的LuxU,进而传递到LuxO。磷酸化的LuxO可激活同源群体感应调控型小RNAs(sRNAs)基因(qrr)的转录,并与RNA结合蛋白Hfq一起抑制LuxR的mRNA翻译。在高自体诱导物浓度下,HAI-1、AI-2和CAI-1与相应的受体蛋白结合,使LuxO去磷酸化失去活性,导致sRNAs不能被转录,使得编码LuxR的mRNA得到稳定翻译,从而调控生物膜的形成。
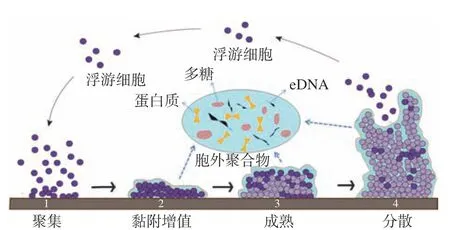
图1 细菌生物膜形成过程Fig.1 Biofilm formation process of bacterials
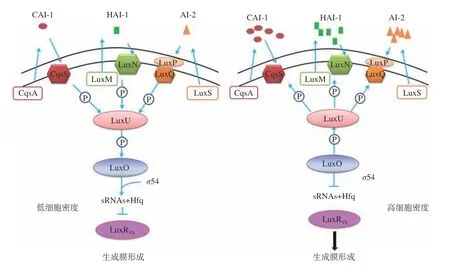
图2 哈维氏弧菌群体感应系统及调控生物膜形成机制Fig.2 Quorum sensing system and the mechanism of biofilm formation of Vibrio harveyi
1.3 群体感应系统协同其他信号分子介导生物膜形成
除了基于QS系统调控外,弧菌中还存在着同样可介导生物膜形成的其他信号分子,在生物膜形成阶段中有着重要作用。环鸟苷二磷酸(cyclicdiguanylica cid,c-di-GMP)作为内部信使几乎存在于所有细菌中,其介导革兰氏阴性菌在运动和附着间的转换,是生物膜形成的中心调节因子[25]。c-di-GMP通过增加胞外多糖的产生,调节细胞大小,增加细胞聚集,减少鞭毛泳动和eDNA生成来促使细菌生物膜形成[26]。c-di-GMP调控生物膜形成时受控于群体感应系统,Waters等[13]研究发现霍乱弧菌在高细胞密度下,QS调控HapR蛋白合成,它可抑制c -di-GMP合成基因和生物膜转录激活因子vpsT的表达,进而抑制生物膜的形成;而低细胞密度时,hapR的转录受到抑制,c-di-GMP不断进行生物合成,浓度增加,诱导生物膜转录激活因子vpsT的表达,进而促进生物膜的形成。这一发现证明了在QS信号分子未达到阈值时,c-di-GMP调控着细菌的运动聚集、增殖、营养吸收、合成EPS等生理功能,随着细胞密度增高并到达阈值,QS系统开始调控生物膜黏附、成熟与分散过程,进而印证了霍乱弧菌中c-di-GMP与双组分系系统、QS系统等组成了复杂的信号传递网络,共同介导细菌生物膜的形成。
2 生物膜形成对弧菌耐药性的影响
杀菌剂是指可灭活几乎所有公认的病原微生物的化学试剂的统称。抗生素是杀菌剂中的一类,是指微生物在繁殖过程中所产生的具有抗病原体或其它活性的一类次级代谢产物,具有靶向特异性。弧菌成熟生物膜对抗生素或其他类杀菌剂均具有抵抗力。生物膜可阻止杀菌剂进入细胞或在进入细胞前使杀菌剂失去效用,这种方式在对杀菌物质的抗性机制中起到重要作用[27]。因此,研究弧菌生物膜形成对弧菌耐药性的影响是解决当前细菌耐药问题的有效途径。如图3所示,其影响主要包括以下三个方面。
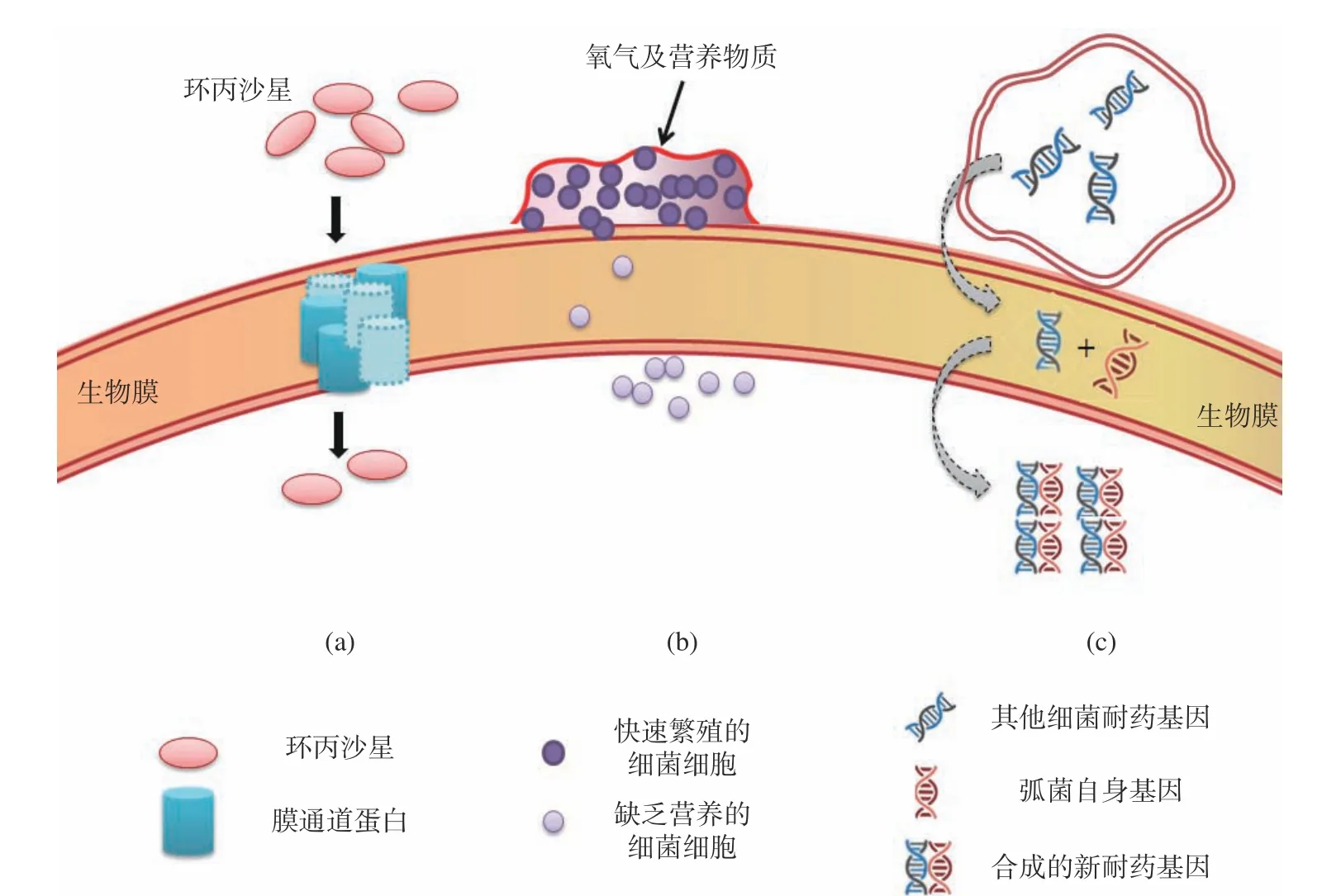
图3 生物膜对抗生素和杀菌剂的耐药机制Fig.3 Resistance mechanism of biofilm to antibiotics and fungicides
2.1 生物膜限制抗生素/杀菌剂的渗透
弧菌细胞的多层结构和胞外聚合物(多糖、蛋白、eDNA)构成的复杂而紧密的结构,均可影响抗生素和杀菌剂渗透入胞内。EPS可以通过与杀菌剂进行吸附、静电或疏水相互作用,限制甚至阻止杀菌剂向细胞的转运[28]。外膜脂多糖的存在、膜通道蛋白的减少、丢失和替代均可以降低弧菌细胞膜对化合物的渗透性。Das等[29]研究发现,由于霍乱弧菌生物膜功能改变或孔蛋白的缺失,使其对碳青霉烯类、四环素类、氟喹诺酮类、氨基糖苷类和氯霉素产生了耐药性。Thurnheer等[30]研究表明,在细菌生物膜厚度为150~200 μm时,浓度为25 mg/L的氯渗透深度不超过100 μm。此外,抗生素和生物膜成分之间的潜在相互作用也可能增加生物膜渗透的局限性。如环丙沙星与铜绿假单胞菌生物膜的特定成分结合,使生物膜充当环丙沙星的屏障,使其不能进入细胞,造成细菌耐药性[31]。Grobe等[32]研究表明,氯、戊二醛和2,2-二溴-3-腈基丙酰胺(DBNPA)与细菌生物膜的成分反应,使杀菌剂浓度减少,对生物膜形成的抑制作用并不明显,但是这些反应的化学性质仍未确定。
2.2 细菌对亚致死浓度抗生素/杀菌剂的表型适应性
细菌的表型适应是由于细菌对其微环境条件改变而做出的特定基因表达。从细菌的附着到生物膜三维结构的形成,该过程受细菌适应生长环境的能力影响。研究发现,细菌细胞黏附到生物材料表面后,编码鞭毛蛋白的基因被抑制,而编码EPS和粘附素蛋白的基因被诱导,促进生物膜的形成,使细菌产生耐药性[33]。同时,与浮游细胞相比,粘附于表面的细胞具有更大的杀菌剂抗性[34]。位于生物膜外围的细胞可以获得营养和氧气,而生物膜内部层中的细菌则处于营养贫乏的微环境中,这种化学特异性导致细菌生长和代谢速率发生改变,也增加了细菌对杀菌剂的抗性[35]。
2.3 耐药基因水平传递(horizontal gene transfer,HGT)和基因突变
在细菌内部,细菌可通过整合子将多种耐药基因重组成为多重耐药菌,而整合子还能以移动基因盒的形式将新基因重组到细菌染色体或质粒等遗传物质中[36-37]。研究表明,生物膜是遗传物质交换的最佳环境,膜内细胞间不断传递耐药基因盒,增加了细菌的耐药性[38]。同时,高细胞密度的存在、生物膜内大量DNA的释放或合适的营养条件都可能会促进基因接合和转化过程,使细胞获得新的遗传物质,增强细菌耐药性。当霍乱弧菌细胞与其他细菌细胞共享移动整合子时,就很容易发生抗生素抗性基因的传播[39]。此外,靶基因突变可导致细菌细胞壁上的药物受体减少,进而达到耐药效果。喹诺酮类药物是细菌脱氧核糖核酸回旋酶和脱氧核糖核酸拓扑异构酶IV的抑制剂,可抑制DNA复制。在霍乱弧菌中通过使其亚基基因gyrA和parC染色体发生突变,干扰DNA复制和转录功能,导致其对抗生素的亲和力降低,从而使霍乱弧菌免受喹诺酮类药物的影响[40]。
从弧菌耐药机制中可看出,生物膜在细菌产生耐药性及耐药基因传递中具有重要作用。因此,控制细菌生物膜的形成成为防控细菌产生耐药性的重要措施。
3 控制弧菌群体感应的群体感应抑制剂
传统的抗生物膜剂一般以单个细菌为目标,作用于细菌的细胞壁、细胞膜以及DNA等靶点,易导致其产生耐药性或演变为超级细菌。因此,为减少和控制弧菌产生生物膜及耐药性,细菌的QS系统成为新靶点,干扰细菌的QS系统成为解决细菌产生生物膜和耐药性的新途径[41]。群体感应抑制剂的作用方式主要包括以下三种:a.抑制QS信号分子合成;b.抑制QS分子-受体相互作用;c.降解QS信号分子[42]。目前,一些化学合成类和天然类群体感应抑制剂已被用于抑制弧菌生物膜的形成[43](表1)。

表1 群体感应抑制剂对弧菌QS和生物膜的抑制作用Table 1 Inhibition effect of quorum sensing inhibitors on QS and biofilm of Vibrio sp.
3.1 化学合成类群体感应抑制剂
化学合成类群体感应抑制剂可通过与信号分子竞争性结合受体蛋白或与信号分子合成酶蛋白靶向结合等方式,干扰细菌的群体感应代谢通路,从而抑制生物膜的合成。化学合成类群体感应抑制剂主要包括AHLs类、AI-2类信号分子的合成类似物及其他小分子物质。Kadirvel等[44]研究表明,合成的4-氟DPD是一种AI-2信号分子类似物,可通过干扰AI-2系统来抑制生物膜的形成,且浓度为10-4mol/L时,对哈维氏弧菌生物膜抑制率高达90%。Rajamanikandan等[45]研究发现硼酸衍生物可与AI-2合成酶LuxP靶向对接,当硼酸衍生物质量浓度为4 μg/mL时,对哈维氏弧菌的生物膜形成抑制率达到64.25%,表明硼酸衍生物通过抑制AI-2的合成来抑制哈维氏弧菌QS通路,进而影响生物膜的形成。Soni等[46]研究发现,合成大麻素HU-210可使哈维氏弧菌BB152的luxS、luxP、luxQ和luxR的表达减少,阻碍AI-2的产生以及受体蛋白对QS信号的接收,抑制AI-2介导的QS级联反应的活性,从而抑制生物膜形成。Kim等[47]研究表明,1-(5-溴噻吩-2-磺酰基)-1氢-吡唑在创伤弧菌中是一种有效的SmcR(LuxR同源物)抑制剂,与SmcR蛋白结合口袋紧密结合,使蛋白质柔韧性发生改变,从而影响SmcR的转录表达,阻碍QS调控创伤弧菌的运动性、毒力因子及生物膜形成。
3.2 植物源群体感应抑制剂
植物提取物中的多酚类、醛类、黄酮类、单宁类、萜类和糖苷类等物质都具有良好的抗生物膜活性[48]。研究表明,从香辛料中提取的大麻酚、肉桂醛、呋喃酮和姜黄素能够有效地抑制弧菌的QS系统,控制生物膜的生成。Aqawi等[49]研究表明,大麻中存在一种少量非精神活性的大麻酚具有QS抑制活性,可阻止哈维氏弧菌LuxU的去磷酸化,从而干扰群体感应自体诱导物信号的传递来抑制生物膜的形成;在浓度为20和50 μg/mL的浓度下,生物膜中细菌量分别减少到58.7%和43.8%。Brackman等[50]研究表明,肉桂醛通过降低LuxR与其靶启动子序列结合的能力而干扰AI-2的QS,从而抑制了鳗弧菌和创伤弧菌生物膜的形成。从柑橘中分离得到的3,5,7,8,3’,4’-六甲氧基黄酮在浓度为5×10-5mol/L时,通过干扰哈维氏弧菌AI-2系统中的LuxO表达,抑制了约61%生物膜的形成[51]。柠檬苦素是柑橘类分泌的一种具有呋喃环的三萜类化合物,通过影响LuxO的表达,显著抑制哈维氏弧菌生物膜形成的能力[52]。Srinivasan等[53]研究发现胡椒乙酸乙酯提取物(Piper betle ethyl acetate extract, PBE)对哈维氏弧菌生物膜形成的抑制作用,PBE在亚抑菌浓度为400 μg/mL时,对哈维氏弧菌群体感应介导的生物膜形成的抑制作用达到74%。Karnjana等[54]从红藻的乙醇提取物中分离纯化的N-苄基肉桂酰胺和α-间苯二甲酸的化合物可通过干扰哈维氏弧菌AI-2信号通路抑制生物膜的形成。由于植物源提取物的稳定性强、分子量低,且对人体健康无害,其被认为是理想的天然的QS抑制剂。
3.3 微生物源群体感应抑制剂
微生物源的群体感应抑制剂主要来源于酵母、乳杆菌属(Lactobacillussp.)和芽孢杆菌属(Bacillussp.)。笔者团队的研究表明,乳酸乳球菌LY3-1分泌的次级代谢产物肽LQLY3-1可通过竞争性结合信号分子受体LuxN而干扰哈维弧菌QS系统,肽LQLY3-1对哈维弧菌生物膜、溶血素、胞外多糖、蛋白酶等毒力因子的抑制率在21%~66%[55]。此外,团队研究发现,面包乳杆菌ZHG2-1代谢产物粗提物对铜绿假单胞菌AHLs信号分子的降解率接近100%,在亚最小抑菌浓度(1.0、2.0和3.0 mg/mL)下,对生物膜形成和预先形成生物膜的抑制率和清除率分别为13.40%~47.30%和11.60%~38.70%,同时,抑制细菌蛋白酶、几丁质酶、绿脓菌素、鼠李糖脂、海藻酸盐和胞外多糖等毒力因子的产生,使铜绿假单胞菌群体感应调控基因lasI/R和rhlI/R表达下调[56]。上述研究结果说明,乳酸菌来源的淬灭酶、细菌素等代谢产物可通过抑制AHLs合成、竞争性抑制AHLs与受体蛋白结合、AHLs失活等作用方式干扰细菌QS系统。此外,其他研究学者Gutiérrez-Almada等[57]研究发现,浓度为1000 μg/mL地衣芽孢杆菌的乙酸乙酯提取物对C6HSL的降解率为98%,对溶藻弧菌生物膜抑制率几乎达到100%。微生物源群体感应抑制剂具有易培养、适应性强、无耐药性等优点,作为一种环境友好的抗生素替代物,可通过干扰弧菌群体感应代谢通路,达到抑制/破坏生物膜的形成和结构的目的。
4 结语与展望
弧菌在水产养殖与海产品生产加工的环境中,可通过不同群体感应信号分子调控基因表达产生毒力因子及成熟的生物膜,进而使弧菌对抗生素/杀菌剂造成了多药耐药性。生物膜的形成限制抗菌药物的渗透,极大地影响杀菌效度,弧菌对亚致死浓度杀菌剂的表型适应性也增加了对抗菌药物的抗性;同时,耐药基因水平传递和基因突变也给消除弧菌带来困难。群体感应是控制细菌性食品腐败和食源性疾病领域的研究热点之一,通过干扰、抑制、淬灭等多种方式控制群体感应,控制食品腐败和致病作用是一条有效途径。因此,基于群体感应减少和控制弧菌产生生物膜及耐药性,提出一解决细菌产生生物膜和耐药性的新途径。本文对弧菌的群体感应作用机制,弧菌生物膜对多药耐药性的影响和耐药机制以及目前新型化学合成类和天然类群体感应抑制剂等进行总结与分析,为水产品养殖与贮藏加工中控制食品腐败和食源性疾病、挖掘新型绿色健康的群体感应抑制剂方面提供借鉴与参考。
目前,弧菌生物膜的控制技术已经广泛应用到水产加工与养殖领域中,但还存在许多问题。一方面,化学合成类和天然类群体感应抑制剂的合成与添加过程中,残留的有毒化学物质对人类健康有潜在危害,且商用群体感应抑制剂价格昂贵。另一方面,在食品加工环境中,有多种不同的微生物附着在食品或器械表面,其中群体感应种间交流AI-2系统可以促进弧菌与其形成耐药性更强更难除去的混合生物膜。因此,研究各环境条件下混合菌的生物膜控制技术,开发价格低廉、绿色、健康的群体感应抑制剂是未来将要攻克的难题。主要可以从以下几个方面开展:a.QS抑制剂可以与抗生素或其它活性物质,如抗菌肽、噬菌体等联合应用,旨在降低细菌耐药性、减少混合生物膜形成及其对人类健康的危害。b.研究者们对生物膜形成及控制大部分都停留在对其结构构象表层的研究,对其作用机理机制并未进行深层探索,因此可以通过转录组学或基因敲除等方式,研究QSI对生物膜相关基因的调控作用,进一步揭示其机理。
