血清糖类抗原125、人附睾蛋白4、癌胚抗原对上皮性卵巢癌患者术前临床分期的评估价值△
2023-01-12乔李陈新华奚旭霞陈小军
乔李,陈新华,奚旭霞,陈小军
1芜湖市第一人民医院妇科,安徽 芜湖 241000 2复旦大学附属肿瘤医院妇瘤科,上海 200000
上皮性卵巢癌是常见的妇科恶性肿瘤,多发生于卵巢表面生发上皮,对女性健康造成极大危害。调查指出,卵巢癌是病死率最高的妇科恶性肿瘤,上皮性卵巢癌是最常见的卵巢癌类型,患者的5年生存率不足50%[1]。上皮性卵巢癌根据形态学和分子遗传学特征可分为Ⅰ型和Ⅱ型,前者包括低级别子宫内膜样癌、低级别浆液性癌等,后者为高级别浆液性癌[2]。研究指出,Ⅱ型上皮性卵巢癌具有高度侵袭性,肿瘤生长迅速、侵袭性强,预后差,因此应当对此类患者及早诊断、尽早实施手术,而准确判断临床分期对手术方式的选择具有重要的指导作用[3]。血清糖类抗原125(carbohydrate antigen 125,CA125)、人附睾蛋白 4(human epididymis protein 4,HE4)、癌胚抗原(carcinoembryonic antigen,CEA)均是上皮性卵巢癌标志物,且与肿瘤浸润、淋巴结转移、远处转移有关[4-6]。研究显示,血清CA125、HE4、CEA水平可用于鉴别上皮性卵巢癌的病理分型,Ⅱ型上皮性卵巢癌患者中三者的水平均明显高于Ⅰ型患者,推测三者与上皮性卵巢癌的病理分型具有密切关系[7]。然而血清CA125、HE4、CEA水平是否可用于评估上皮性卵巢癌患者术前临床分期及其评估价值尚不清楚。鉴于此,本研究探讨血清CA125、HE4、CEA对上皮性卵巢癌患者术前临床分期的评估价值,现报道如下。
1 资料与方法
1.1 一般资料
收集2017年4月至2020年7月芜湖市第一人民医院和复旦大学附属肿瘤医院收治的上皮性卵巢癌患者的病历资料。纳入标准:①经病理检查确诊为上皮性卵巢癌;②接受手术治疗,包括部分卵巢切除术、卵巢全切术、卵巢+子宫+附件切除术、广泛性腹膜切除术、姑息性手术等,有淋巴结清扫指征者均配合实施淋巴结清扫术;③根据术中所见和术后病理学检查明确临床分期;④临床资料完整。排除标准:①复发性上皮性卵巢癌;②其他部位原发性肿瘤转移至卵巢;③妊娠期或哺乳期女性;④术前血清CA125、HE4、CEA检测资料不全;⑤血清CA125、HE4、CEA检测与手术间隔时间>3天;⑥伴有其他可能影响血清CA125、HE4、CEA水平的疾病,如肝硬化、慢性肾脏病、2型糖尿病等。依据纳入和排除标准,本研究共纳入284例患者,年龄29~75岁,平均(55.0±10.0)岁,中位年龄53岁;肿瘤直径0.4~13.0 cm,平均(5.15±1.20)cm;包膜完整101例,包膜不完整183例(呈菜花样);单侧发病78例,双侧发病206例;手术方式:部分卵巢切除术62例,卵巢全切术71例,卵巢+子宫+附件切除术82例,广泛性腹膜切除术56例,姑息性手术13例;术中配合淋巴结清扫205例;肿瘤扩散228例;淋巴结转移144例;远处转移78例。本研究经医院伦理委员会审批通过,所有患者均知情同意并签署知情同意书。
1.2 检测方法
术前抽取患者的空腹外周静脉血5 ml,3500 r/min离心后取上清液,采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测血清CA125、HE4、CEA水平。CA125正常参考值:0~35 U/ml,HE4正常参考值:0~72 pmol/L,CEA正常参考值:0~5.9 μg/L。
1.3 临床分期判断标准
参照《中国版NCCN卵巢癌临床实践指南解读》[8]判断临床分期。Ⅰ期:肿瘤局限于单侧或双侧卵巢,无淋巴结转移且无远处转移;Ⅱ期:肿瘤累及一侧或双侧卵巢,并伴有盆腔内扩散和/或转移,无淋巴结转移且无远处转移;Ⅲ期:肿瘤累及一侧或双侧卵巢、组织学证实腹膜表面有种植,伴有淋巴结转移;Ⅳ期:有远处转移。
1.4 观察指标
比较不同临床特征上皮性卵巢癌患者的血清CA125、HE4、CEA 水平。分析血清CA125、HE4、CEA单独及联合检测对上皮性卵巢癌患者术前临床分期的评估价值,其中任何一项指标评估为Ⅲ~Ⅳ期即认为联合检测评估为Ⅲ~Ⅳ期。
1.5 统计学分析
采用SPSS 26.0软件对数据进行统计分析。正态分布计量资料以均数±标准差(±s)表示,组间比较采用t检验;非正态分布计量资料以中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析血清CA125、HE4、CEA单独及联合检测对上皮性卵巢癌患者术前临床分期的评估价值。采用DeLong检验对ROC曲线下面积(area under the curve,AUC)进行显著性检验。以P<0.05为差异有统计学意义。
2 结果
2.1 不同临床特征上皮性卵巢癌患者血清CA125、HE4、CEA水平的比较
肿瘤扩散上皮性卵巢癌患者的血清CA125、HE4、CEA水平均明显高于无肿瘤扩散的患者,差异均有统计学意义(Z=11.410、5.534、7.141,P<0.01);淋巴结转移上皮性卵巢癌患者的血清CA125、HE4、CEA水平均明显高于无淋巴结转移的患者,差异均有统计学意义(Z=14.403、8.738、10.632,P<0.01);远处转移上皮性卵巢癌患者的血清CA125、HE4、CEA水平均明显高于无远处转移的患者,差异均有统计学意义(Z=12.410、9.013、10.100,P<0.01);Ⅲ~Ⅳ期上皮性卵巢癌患者的血清CA125、HE4、CEA水平均明显高于Ⅰ~Ⅱ期患者,差异均有统计学意义(Z=5.407、4.316、3.684,P<0.01)。(表1)
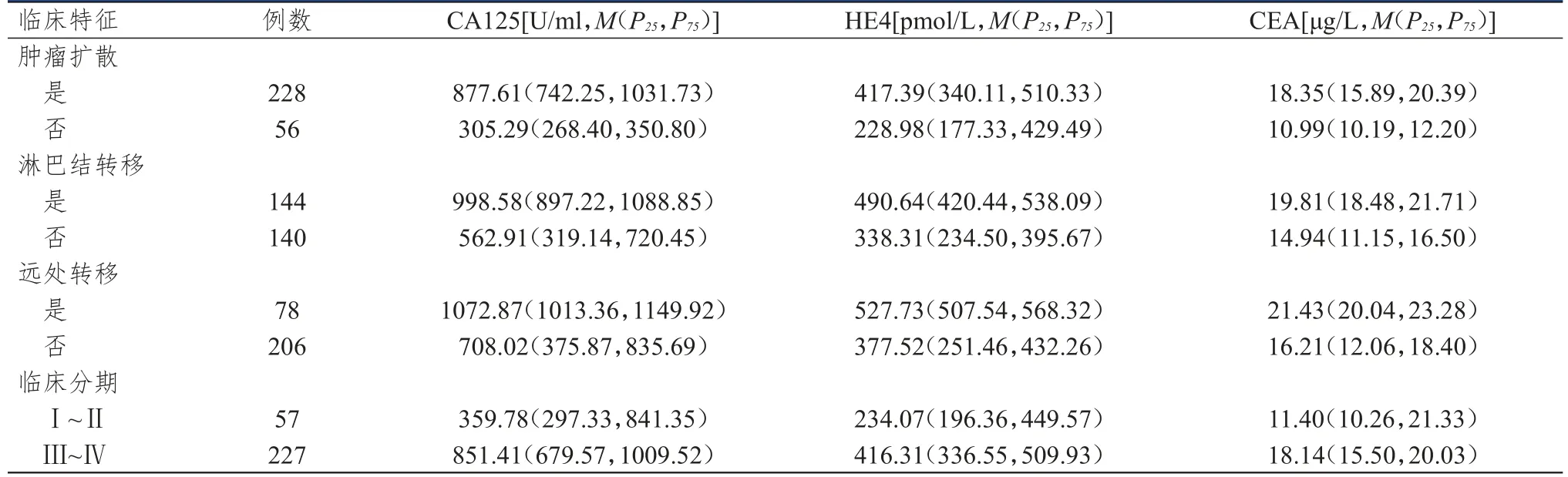
表1 不同临床特征上皮性卵巢癌患者血清CA125、HE4、CEA水平的比较(n=284)
2.2 血清CA125、HE4、CEA单独及联合检测对上皮性卵巢癌患者术前Ⅲ~Ⅳ期的评估价值
ROC曲线显示,血清CA125、HE4、CEA联合检测评估上皮性卵巢癌患者术前Ⅲ~Ⅳ期的AUC高于各指标单独检测(Z=2.342、3.083、3.331,P<0.05)。CA125和HE4单独检测评估上皮性卵巢癌患者术前Ⅲ~Ⅳ期的AUC比较,差异无统计学意义(Z=0.794,P=0.427);CA125和CEA单独检测评估上皮性卵巢癌患者术前Ⅲ~Ⅳ期的AUC比较,差异无统计学意义(Z=1.258,P=0.208);HE4和CEA单独检测评估上皮性卵巢癌患者术前Ⅲ~Ⅳ期的AUC比较,差异无统计学意义(Z=0.703,P=0.482)。(表2、图1)
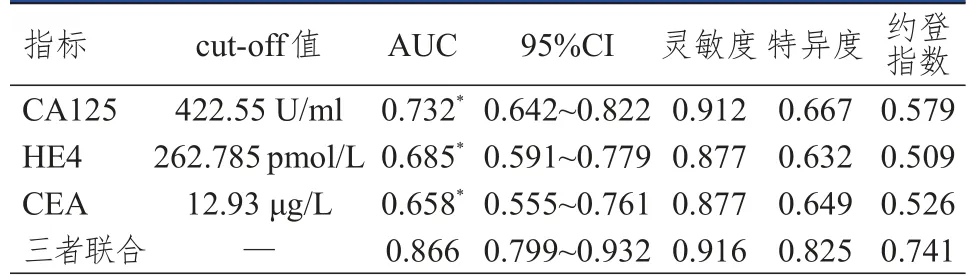
表2 血清CA125、HE4、CEA单独及联合检测对上皮性卵巢癌患者术前Ⅲ~Ⅳ期的评估价值

图1 血清CA125、HE4、CEA单独及联合检测评估上皮性卵巢癌患者术前Ⅲ~Ⅳ期的ROC曲线
3 讨论
卵巢癌的发生与遗传因素、内分泌紊乱、致癌物质接触等有关,以上皮性卵巢癌多见[9]。上皮性卵巢癌恶性级别高,病情进展快,需要及早实施手术治疗,而术前准确评估此类患者的临床分期有助于合理选择术式,明确手术切除范围。目前临床上对上皮性卵巢癌患者常用的术前临床分期判断方法主要包括CT、MRI等影像学检查方法,能够了解肿瘤边界、大小、形态、扩散情况等,但是对于早期微小病灶的诊断准确度较低,对临床分期的判断也有一定的局限[10-11]。因此,临床医师应探讨新的、准确度高的上皮性卵巢癌术前临床分期评估方法。
肿瘤标志物是指特征性存在于恶性肿瘤细胞,或由恶性肿瘤细胞产生,或由宿主在恶性肿瘤刺激下产生的分子,能够反映肿瘤的发生和发展情况,有助于评价肿瘤的治疗反应、评估病情进展。目前在恶性肿瘤临床诊疗中,越来越多的肿瘤标志物被挖掘和广泛应用,并且为恶性肿瘤的诊疗提供了方便。本研究中,肿瘤扩散、淋巴结转移、远处转移上皮性卵巢癌患者的血清CA125、HE4、CEA水平分别明显高于无肿瘤扩散、无淋巴结转移、无远处转移的患者,表明血清CA125、HE4、CEA水平与上皮性卵巢癌患者的肿瘤扩散、淋巴结转移和远处转移均可能具有相关性。CA125是一种高分子量糖蛋白,分子量为200~1000 kD,来源于胚胎发育期的体腔上皮,正常卵巢组织中不存在CA125,其在上皮性卵巢癌中较为常见。已有研究证实,血清CA125水平升高与卵巢癌、宫颈癌等恶性肿瘤的发生均有关,也是卵巢癌首选的肿瘤标志物[12-13]。另有研究显示,浆液性上皮性卵巢癌患者的血清CA125水平高于其他类型的上皮性卵巢癌患者[14]。HE4与CA125相互独立,属于新的卵巢癌特异性标志物,其分子量为25 kD,属于分泌型糖蛋白,主要由卵巢上皮分泌,正常情况下其水平较低,当恶性肿瘤发生后卵巢上皮可分泌大量的HE4。有研究表明,HE4诊断卵巢癌的特异度较好,且优于CA125[15]。另有研究证实,HE4大量表达可参与上皮性卵巢癌的发生发展过程[16]。CEA是一种酸性糖蛋白,具有人类胚胎抗原特性,主要存在于内胚层细胞分化形成的恶性肿瘤细胞表面,属于一种广谱肿瘤标志物。有研究显示,上皮性卵巢癌患者的血清CEA水平高于同年龄段正常健康女性和卵巢良性肿瘤患者,且血清CEA水平与肿瘤大小、淋巴结转移均有关[17]。由此可知,血清CA125、HE4、CEA与上皮性卵巢癌的发生发展有关,在肿瘤扩散、淋巴结转移、远处转移的患者中,三者的水平均更高。
此外,本研究还发现,Ⅲ~Ⅳ期上皮性卵巢癌患者的血清CA125、HE4、CEA水平均明显高于Ⅰ~Ⅱ期患者(P<0.01)。ROC曲线显示,血清CA125、HE4、CEA联合检测评估上皮性卵巢癌患者术前Ⅲ~Ⅳ期的AUC高于各指标单独检测(P<0.05)。说明血清CA125、HE4、CEA联合检测对上皮性卵巢癌患者术前临床分期的评估价值较好。赵娟等[18]研究表明,血清CA125联合HE4检测可诊断上皮性卵巢癌,且对肿瘤复发、疾病进展等预后不良的预测价值较高。李卫兵等[19]研究发现,上皮性卵巢癌患者的血清HE4水平高于卵巢良性病变患者和健康对照者,且其水平与临床分期、淋巴结转移、腹腔积液有关。张霆等[20]研究发现,Ⅲ~Ⅳ期、淋巴结转移、中低分化、有腹腔积液的上皮性卵巢癌患者血清CA125、HE4、CEA水平分别高于Ⅰ~Ⅱ期、无淋巴结转移、高分化、无腹腔积液的患者,对患者随访4年,结果发现,死亡患者初始血清CA125、HE4、CEA水平均明显高于生存患者,说明上述指标与上皮性卵巢癌患者的病情及预后有关。国外相关报道证实,CA125、HE4、CEA在不同临床特征上皮性卵巢癌患者中的表达水平差异显著[21-22],本研究结果与其报道结果一致。本研究将CA125、HE4、CEA联合用于评估患者的临床分期,可充分利用各自的优势,减少误诊,提高准确度。三者联合对患者术前临床分期的评估价值较高,并对进一步治疗选择初始肿瘤细胞减灭术,还是新辅助化疗后行中间型肿瘤细胞减灭术,具有一定的指导价值。
综上所述,肿瘤扩散、淋巴结转移、远处转移、Ⅲ~Ⅳ期上皮性卵巢癌患者的血清CA125、HE4、CEA水平均较高,三者联合检测可评估上皮性卵巢癌患者的临床分期,从而指导临床治疗。
