三阴性乳腺癌免疫疗法的研究进展△
2023-01-12吴沁航李明慧王昕玮张效海
吴沁航,李明慧,王昕玮,张效海
南京中医药大学药学院,南京 210023
乳腺癌是女性较常见的肿瘤,也是全球病死率较高的疾病之一。三阴性乳腺癌(triple negative breast cancer,TNBC)是乳腺癌的一种亚型,雌激素受体、孕激素受体以及人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达均为阴性,占乳腺癌的10.00%~20.80%,组织分化较差,临床治愈率低[1-2]。TNBC的发病年龄较小,根据2020年流行病学数据显示,15%~20%的TNBC患者为40岁以下的年轻女性,同时伴有较高的内脏转移率,手术后复发率达25%,且平均复发时间仅为19~40个月,3个月死亡率高达75%[3-4]。化疗是目前临床治疗TNBC的主要手段,包括紫杉醇类(紫杉醇、多西他赛等)、蒽环类(多柔比星、表柔比星等)和铂类(顺铂、奥沙利铂等)药物[5]。然而化疗药物毒性较大,患者一旦发生化疗药物耐药,肿瘤会迅速复发和转移,因此寻找适合TNBC的新药物及治疗手段已迫在眉睫。近年来,随着对TNBC研究的不断深入,发现TNBC较其他类型乳腺癌具有更高的肿瘤免疫浸润率及突变率[6-8]。随着嵌合抗原受体T细胞(chimeric antigen receptor T cell,CAR-T)技术、程序性死亡受体 1(programmed cell death 1,PDCD1,也称PD-1)/程序性死亡受体配体 1(programmed cell death 1 ligand 1,PDCD1LG1,也称PD-L1)等免疫检查点抑制剂在骨髓瘤、晚期黑色素瘤、普通乳腺癌等治疗中获得成功,免疫治疗给TNBC患者带来了希望。目前临床上用于TNBC的免疫疗法主要有肿瘤疫苗、免疫检查点抑制剂、过继性免疫疗法、溶瘤病毒等。本文结合国内外的最新研究成果,对TNBC的免疫疗法进行综述,为TNBC的新药开发及临床治疗提供参考。
1 肿瘤疫苗
肿瘤疫苗有预防和治疗两种作用,前者通过使健康人接种疫苗产生免疫记忆,防止特定肿瘤的发生,如宫颈癌疫苗;后者通过加强或激活患者自身的免疫系统来控制肿瘤,其中大多数通过激活特异性CD8+T细胞发挥治疗作用,如CIMAvax-EGF(非小细胞肺癌治疗性疫苗)和sipuleucel-T(晚期前列腺癌治疗性疫苗)[9-11]。当前处于临床前研究阶段的TNBC疫苗主要有癌-睾丸抗原疫苗、个体化肽疫苗(personalized peptide vaccine,PPV)、衍生肽疫苗和runt相关转录因子2(runt-related transcription factor 2,RUNX2)-树突状细胞(dendritic cell,DC)疫苗。
TNBC细胞过表达多个肿瘤睾丸抗原(cancer testis antigen,CTA),如黑色素肿瘤抗原(melanoma antigen,MAGE)、Wilms肿瘤 1(Wilms tumor 1,WT1)和纽约食管鳞状细胞癌抗原1(New Yorkesophageal squamous cell carcinoma 1,NY-ESO-1)。临床试验NCT00623831显示,对于高表达NYESO-1的混合细菌疫苗(mixed bacterial vaccine,MBV),乳腺癌患者每周通过固定剂量(60 800 EU)病灶内注射两次,在发热情况下MBV可激活大量的白细胞介素(interleukin,IL)-6、IL-1β等免疫调节因子,使肿瘤消退[12]。PPV是根据肿瘤患者的个体遗传结构和功能,从一系列候选肽中选择与人类白细胞抗原(human leukocyte antigen,HLA)-ⅠA相匹配的多肽制成的肿瘤疫苗[13]。Umni00001844Ⅱ期临床研究收集了79例转移性复发乳腺癌患者,其中18例TNBC患者接受PPV治疗,根据细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)和免疫球蛋白G(immunoglobulin G,IgG)水平分析,其中1例患者完全缓解,1例患者部分缓解,中位无进展生存期(median progression-free survival,mPFS)达7.50个月,中位总生存期(median overall survival,mOS)为 11.1 个月,未发现严重的不良反应[14]。AE37是一种HER2衍生肽疫苗,由Ii-Key肽与HER2/neu杂交产生。Ii-Key的修饰可以使AE37的抗原呈递能力加强,刺激肿瘤患者的CD4+和CD8+T细胞诱导HER2特异性T细胞产生免疫应答[15]。在包括298例乳腺癌病例的临床研究对此疫苗进行了评估,患者随机被分为AE37+巨噬细胞粒细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)组和单独使用GM-CSF的对照组,结果发现,AE37+GM-CSF组患者的复发率为12.40%,比对照组降低了1.40%。在TNBC亚群中,AE37疫苗接种组患者的5年无病生存率(disease free survival,DFS)为77.70%,较对照组的49.00%提高了28.70%[16]。RUNX2在乳腺癌中高表达,其能促进细胞增殖,抑制p53并调节下游基质金属蛋白酶(matrix metalloproteinase,MMP)9、MMP13和血管内皮生长因子(vascular endothelial growth factor,VEGF)活性。在RUNX2-DC疫苗抗TNBC的研究中发现,该疫苗可使DC富集在肿瘤周围,识别TNBC特异性抗原并呈递给淋巴细胞,激活免疫反应消除肿瘤。该疫苗还可通过激活CTL和辅助性T细胞1(helper T cell 1,Th1)反应,促进IL-12、IL-18、γ干扰素(interferon-γ,IFN-γ)等细胞因子的表达,抑制TNBC新生血管生成[17-18]。
2 免疫检查点抑制剂
免疫检查点是一类免疫抑制性分子,通过T细胞上的配体/受体相互作用,调控免疫反应的强度和广度,从而减少自身正常组织受到伤害[19]。免疫检查点分子的过度表达或功能增强会导致机体的免疫功能受到抑制,使肿瘤细胞产生免疫逃逸[20]。
2.1 PD-1/PD-L1抑制剂
效应T细胞表达的PD-1,与肿瘤细胞及抗原呈递细胞表面上的PD-L1相结合,抑制T细胞活性和细胞因子释放,诱导T细胞凋亡[21]。
2.1.1 PD-L1和PD-1抑制剂 抗PD-L1抗体阿替利珠单抗(Atezolizumab)作为一线疗法在临床抗肿瘤治疗中得到了广泛研究,其单独用药治疗TNBC具有良好的耐受性及持续的临床效果。Ⅰ期临床试验NCT01375842显示,阿替利珠单抗治疗转移性TNBC患者的mPFS为1.40个月,mOS为17.60个月,治疗相关不良事件(treatment related adverse event,trAE)发生率为63%,其中79%为较轻的1~2级[22]。Ⅱ期临床试验KEYNOTE-086评估了PD-1抑制剂帕博利珠单抗(Pembrolizumab)作为单一疗法治疗至少接受过一次全身治疗的转移性TNBC(A组)和未接受过全身治疗的转移性TNBC(B组)的效果,结果显示,A组患者的mOS为9.00个月,疾病控制率为7.60%,而B组患者的mOS为18.00个月,疾病控制率为23.80%,B组mOS和疾病控制率较A组均有明显增长,表明帕博利珠单抗对未经治疗的转移性TNBC患者有更持久的抗肿瘤活性[23]。进一步Ⅲ期临床试验KEYNOTE-119比较了帕博利珠单抗和化疗治疗TNBC的效果,帕博利珠单抗组在综合阳性分数(combined positive score,CPS)≥1和≥10的情况下,mOS分别为10.70、12.70个月,较化疗组的10.20、11.60个月没有显著改善,但当患者CPS≥20时,帕博利珠单抗组患者的mOS为14.90个月,明显优于化疗组的12.50个月[24]。
2.1.2 PD-1/PD-L1抑制剂与化疗联合 PD-1/PD-L1抑制剂联合化疗治疗TNBC的疗效显著。Ⅲ期临床试验IMpassion130探讨了阿替利珠单抗+白蛋白紫杉醇与安慰剂+白蛋白紫杉醇的治疗效果,结果显示,阿替利珠单抗+白蛋白紫杉醇组患者的mPFS比安慰剂+白蛋白紫杉醇组延长了1.7个月,mOS延长了3.70个月;在PD-L1免疫细胞(immune cell,IC)阳性TNBC患者中,阿替利珠单抗+白蛋白紫杉醇组患者的mPFS为7.50个月,比安慰剂+白蛋白紫杉醇组延长了2.50个月,mOS延长了9.50个月[25]。2019年3月美国食品药品管理局(Food and Drug Administration,FDA)批准阿替利珠单抗与白蛋白紫杉醇联合用于治疗局部晚期或PD-L1阳性转移性TNBC。此外,Ⅲ期临床试验KEYNOTE-355显示,帕博利珠单抗联合紫杉醇或卡铂治疗TNBC患者的mPFS从5.60个月延长到9.70个月[26]。帕博利珠单抗联合化疗于2020年11月获得了FDA的加速批准,用于局部复发、无法手术或转移性TNBC患者的治疗。
2.2 细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte associated protein 4,CTLA4)抑制剂
CTLA4是一种T细胞跨膜受体,与CD28属同源性蛋白,相互竞争性结合B7分子[27]。CTLA4主要通过细胞内和细胞外两种途径抑制T细胞活性:在细胞内,CTLA4与蛋白磷酸酶2A(protein phosphatase 2A,PP2A)和蛋白磷酸酶 6(protein phosphatase 6,PP6)相互作用,下调CD28信号通路;在细胞外,CTLA4通过产生IL-10、转化生长因子-β(transforming growth factor-β,TGF-β)等细胞因子抑制抗原呈递细胞表面B7蛋白的表达,抑制CD28与B7的结合[28]。CTLA4抑制剂伊匹单抗(Ipilimumab)和曲美木单抗(Tremelimumab)目前在治疗实体瘤方面取得了一定的进展。伊匹单抗可与人白细胞IgG受体结合,通过抗体依赖细胞介导的细胞毒性(antibody dependent cell mediated cytotoxicity,ADCC)作用降低调节性T细胞(regulatory T cell,Treg)比例,促进 T 细胞活化[29]。在以曲美木单抗为单一疗法的临床试验NCT02527434中显示,12例TNBC患者的客观缓解率(objective response rate,ORR)达8.30%,mOS达12.88个月[30]。
3 过继性免疫疗法
过继免疫细胞输注是指分离肿瘤患者自身的肿瘤浸润淋巴细胞或外周血淋巴细胞,在体外进行分选、扩增、活化后输回患者体内,激活机体的免疫应答,高效杀灭肿瘤细胞。
3.1 CAR-T细胞
经修饰以表达嵌合抗原受体的外周血T细胞被称为CAR-T细胞。CAR结构通常由附着于细胞外柔性铰链和跨膜区域的抗原识别域组成,跨膜区域将抗体锚定到细胞表面,并进一步将其连接到T细胞受体的信号转导域。CAR-T旨在将抗体的肿瘤识别能力与T细胞的抗肿瘤能力结合起来,使T细胞定向到肿瘤细胞表面的特定抗原,活化T细胞及溶细胞活性达到抗肿瘤目的[31]。酪氨酸激酶受体c-Met在50%的乳腺肿瘤中过表达。Tchou等[32]通过对TNBC异种移植瘤小鼠注射c-MetCARmRNA转导的T细胞,发现肿瘤生长受到抑制,肿瘤前缘和坏死区被巨噬细胞包围,免疫组化分析显示注射部位有广泛的肿瘤坏死和细胞碎片,c-Met免疫反应性丧失。在众多肿瘤相关抗原测试中,间皮素是一种在67%的TNBC样本中过表达的细胞表面抗原,过表达间皮素可组成性激活核因子κB(nuclear factor-κB,NF-κB)、促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)、磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)等信号通路,促进肿瘤细胞增殖并抑制其凋亡。此外,在44个原发性TNBC病变中发现有72.70%的病变高表达软骨蛋白硫酸蛋白聚糖4(chondroitin sulfate proteoglycan 4,CSPG4),其表达量与患者总生存期和复发时间均呈负相关,在TNBC干细胞中也检测到了CSPG4的表达,并被认为是TNBC复发和耐药的主要原因[33]。针对这些靶点所设计的CAR-T细胞可能对TNBC起有效的治疗作用。目前,在CAR-T细胞领域进行的抗TNBC研究多处于临床前研究阶段,其主要靶点及抗肿瘤活性详见表1。
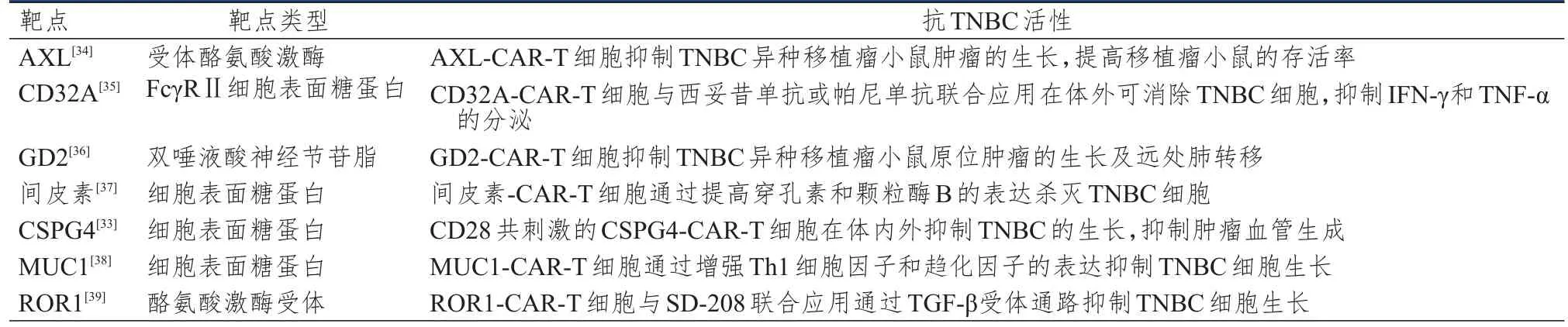
表1 CAR-T细胞抗TNBC的靶点及活性
3.2 CAR-自然杀伤(natural killer,NK)细胞
NK细胞是一种非特异性肿瘤杀伤细胞,在功能上类似于CD8+细胞毒性T细胞,通过细胞毒性机制分泌穿孔素裂解靶细胞[40]。NK细胞拥有独特的生物学特性,可以异种移植,是CAR系列非常具有吸引力的治疗方式[41]。Hu[42]发现组织因子(tissue factor,TF)是50%~85%的TNBC患者的共同表面靶点,以TF为靶点设计的TF-CAR-NK在体内可有效减小TNBC细胞系和患者来源的异种移植瘤小鼠的肿瘤体积,为CAR-NK靶向治疗TNBC确立了可行性。
3.3 细胞因子诱导产生的杀伤细胞(cytokine-induced killer cell,CIK)
CIK是具有CD3+CD56+免疫表型的细胞毒性T淋巴细胞亚型[43]。CIK具有强大的非主要组织相容性复合体(major histo-compatibility complex,MHC)限制性肿瘤杀伤能力,对实体瘤和血液恶性肿瘤均有杀灭作用,因其不易受免疫抑制性药物的影响,是较理想的过继性细胞类型。CIK细胞由IFN-γ、抗CD3抗体和IL-2诱导的人外周血单核细胞产生,通过表面趋化因子淋巴球功能性抗原1(lymphocyte function-associated antigen 1,LFA-1)与肿瘤细胞上的配体结合,激活CIK细胞释放穿孔素和细胞颗粒毒素,裂解肿瘤[44]。Sommaggio等[45]发现,在TNBC移植瘤小鼠模型中,西妥昔单抗与CIK细胞联合应用可有效抑制肿瘤的转移和扩散,显著延长小鼠mOS(西妥昔单抗-CIK组42天,西妥昔单抗组25天)。Li等[46]在一项乳房切除术后TNBC患者的研究中发现,常规化疗(如蒽环类、紫杉醇等药物)后接受CIK免疫治疗的患者5年DFS达到77.90%,总生存率达到94.30%,较仅接受常规化疗患者的69.80%和85.60%均有显著提高,并且没有发现严重的不良反应。
4 溶瘤病毒
溶瘤病毒是一种天然或经人工修饰的病毒,能选择性破坏肿瘤细胞,避免损伤大量的正常细胞[47]。至今为止,全球已经批准了3个溶瘤病毒用于肿瘤的治疗:第一个是2004年拉脱维亚批准用于治疗黑色素瘤的RNA病毒;第二个是2005年中国批准用于治疗鼻咽癌的转基因腺病毒H101;第三个是2015年美国FDA批准用于局部治疗初次手术后复发性黑色素瘤的Talimogene laherparepvec(T-VEC)[48]。溶瘤病毒抗肿瘤机制主要有两种:①直接感染肿瘤细胞和相关内皮细胞,使肿瘤细胞裂解;②改变肿瘤微环境,招募更多免疫细胞,激活抗肿瘤免疫应答[49]。溶瘤病毒进入肿瘤主要取决于宿主细胞上的受体,例如多发性骨髓瘤、黑色素瘤的细胞间黏附因子1和衰变加速因子,它们的过表达有助于溶瘤病毒进入肿瘤细胞,随后病毒在细胞质和细胞核中复制、组装、扩散,最终导致肿瘤细胞裂解死亡。被感染的肿瘤细胞裂解后释放出大量子代溶瘤病毒可进一步感染周围的肿瘤。此外,病毒感染会引起炎症,诱导DC细胞向肿瘤聚集,产生广泛的抗肿瘤免疫效应[50]。Ghouse等[51]评估了一种表达IL-12的基因工程溶瘤性单纯疱疹病毒G47Δ-mIL12对4T1、HCC1806和MDAMB-468细胞的活性,发现G47Δ-mIL12可有效杀灭小鼠和人源的乳腺癌细胞,降低TNBC细胞转移率。溶瘤病毒与化疗药物的联合应用还可提高化疗药的靶向性。Berry等[52]将呼肠孤病毒与多柔比星联合应用,增强了TNBC细胞中多柔比星的浓度和呼肠孤病毒的溶瘤能力,并且该研究发现,与药物偶联不会影响病毒的附着力、感染性和复制能力。
5 调节肿瘤微环境(tumor microenvironment,TME)
TME由肿瘤细胞、免疫细胞、肿瘤相关成纤维细胞、细胞外基质、细胞因子等组成,TME中各免疫细胞和免疫分子相互作用,影响肿瘤的发生发展以及临床治疗效果[53]。其中,肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)与 TNBC 的预后密切相关,TIL低水平的早期TNBC患者易出现浸润性导管瘤,而TIL高水平TNBC患者具有更好的病理学完全缓解率、OS和DFS,并且其值会随着TIL浸润率的升高而升高[54-55]。肿瘤相关巨噬细胞则主要通过诱导血管生成、抑制T淋巴细胞活性、介导药物抗性促进肿瘤的生长和转移[56]。
调控TME是防治肿瘤的重要途径。Yuan等[57]发现,抑制MMP7可促进CXC趋化因子配体16(CX-C chemokine ligand 16,CXCL16)的表达,吸引携带相关受体的CD4+、CD8+T细胞以及NK细胞向肿瘤聚集,改善TNBC微环境,提高免疫治疗效果。中药百里醌是黑种草中的生物活性物质,可调控肿瘤相关巨噬细胞、肿瘤相关脂肪细胞、肿瘤相关成纤维细胞、TIL、IL-6等免疫细胞和炎症分子活性,起到预防和治疗TNBC的作用[58]。
6 小结与展望
人体免疫系统与肿瘤紧密联系、相互作用,免疫疗法通过增强肿瘤细胞的免疫原性和对效应细胞杀伤的敏感性,应用免疫细胞和效应分子协同机体的免疫系统控制与消除肿瘤,是一种高效的抗肿瘤方法。当前,肿瘤疫苗、免疫检查点抑制剂、过继性免疫疗法和溶瘤病毒在TNBC治疗中已显示出强大的抗肿瘤活性。肿瘤是一种全身性疾病,目前关于TNBC的免疫治疗仍存在着一些挑战,如许多TNBC相关抗原除在肿瘤细胞高表达外,在正常细胞中也有不同程度的表达,靶向这些抗原的过继性免疫治疗可能损伤机体正常组织,产生不良反应;患者对免疫治疗的反应不同,疗效个体差异较大;TNBC细胞迁移能力强,对靶向药物治疗应答不佳等。因此,进一步寻找新的TNBC特异性治疗靶点、CAR结构优化、推动个性化治疗是今后发展的方向。随着对免疫应答和TNBC免疫微环境的认识不断加深,新型免疫检查点抑制剂、重塑抗肿瘤微环境、免疫治疗与非免疫治疗相结合等研究正在不断推进,将进一步提高TNBC免疫治疗的疗效、适用性和安全性。
