酶法纯化麦麸不溶性膳食纤维的结构及理化性质
2023-01-12张欣邹锦成刘琳谭葆瑶赵雷胡卓炎王凯
张欣,邹锦成,刘琳,谭葆瑶,赵雷,胡卓炎,王凯
(华南农业大学食品学院,广东广州 510642)
麦麸即麸皮,是小麦制粉工业的主要副产品。在碾磨和精炼小麦时麦麸多被丢弃,导致麦麸资源的有效利用率低。麦麸中有丰富的膳食纤维,占麦麸总质量的50%以上[1]。根据水溶性的不同,膳食纤维可以分为水溶性膳食纤维(Soluble Dietary Fiber,SDF),例如果胶,及水不溶性膳食纤维(Insoluble Dietary Fiber,IDF),通常包括纤维素、不溶性半纤维素和木质素[2]。麦麸膳食纤维中90%以上为不溶性膳食纤维[1]。研究表明,摄入适量的膳食纤维可以降低肥胖、糖尿病、胃肠道疾病等疾病的发病率[3,4],因此膳食纤维摄入量可被视为健康饮食的标志[5]。而IDF 在人体中发挥着促进肠道蠕动、吸附油脂、重金属和其他有毒物质等重要作用[6]。事实上,人体摄入的膳食纤维中IDF 的摄入量需达到50%~75%才能达到最佳的健康益处[7]。此外,由于IDF 具有较好的吸水性、吸油性等理化性质,加入到面制品、肉制品及饮料等食品中,不仅能提高产品的营养价值,还能改善产品的品质[8]。因此,将麦麸中的IDF 进行分离纯化加以利用,对于提高麦麸的附加值,以及改善人体健康方面的作用不容忽视。
目前,膳食纤维的提取方法主要有化学法、酶法和生物发酵法[9]。比较而言,化学法(如酸法和碱法)成本低,但其制备过程的强酸或强碱条件可能会破坏膳食纤维的结构,从而影响其理化性质,且制备过程中产生的污染物会对环境造成影响。生物发酵法是利用微生物发酵产酶去除原料中杂质,从而提取膳食纤维,但发酵产酶的量可能不足,导致除杂不充分,产品纯度不高。酶法提取是利用酶(如蛋白酶、α-淀粉酶等)降解原料中的杂质成分,对膳食纤维进行提取纯化。酶法具有反应条件温和且节约能源的优点,在提取多种原料中的IDF 已得到广泛使用。曹银等[11]利用酶法(α-淀粉酶、蛋白酶和脂肪酶)提取大麦槽中的IDF,得到大麦槽IDF 的纯度高达87.14%。Yang 等[10]利用酶法(α-淀粉酶、中性蛋白酶和糖化酶)提取金针菇、胡萝卜、燕麦中的IDF,并对三个原料中IDF 的结构、理化特性进行测定,结果表明不同来源的IDF具有不同形态(片状、块状、纤维长条状等)和理化特性(持水性、持油性和膨胀度等)。麦麸中膳食纤维含量丰富,但目前对酶法提取麦麸IDF 的工艺条件优化以提高产物纯度的研究不足,对于麦麸IDF 的结构及理化性质的评价不充分。而优化麦麸IDF 的纯化工艺条件,并对其结构和理化性质进行研究,将为麦麸IDF 在食品中的应用提供理论和实践指导。本研究采用α-淀粉酶和碱性蛋白酶处理麦麸,对IDF 进行提取纯化,分别讨论碱性蛋白酶及α-淀粉酶的用量及处理时间对麦麸IDF 纯度的影响,并对麦麸IDF 的化学组成、结构特征和理化性质等进行评价。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
麦麸,购于当地市场;α-淀粉酶(4 000 U/g)、碱性蛋白酶(200 U/mg)购于上海源叶生物科技有限公司;总淀粉含量试剂盒,爱尔兰Megazyme 公司;其余化学试剂均为分析纯。
1.1.2 主要仪器
Uvmini-1240 紫外可见分光光度计,日本SHIMADZU 公司;EVO MA 15 扫描电子显微镜,德国ZEISS 有限公司;X 射线衍射仪,荷兰帕纳科公司;Vertex70 型傅里叶红外光谱仪,德国布鲁克公司;MR Hel-Tec (CN)磁力搅拌器,德国Heidolph 公司。
1.2 方法
1.2.1 麦麸不溶性膳食纤维的提取纯化
麦麸IDF 的提取参考Hua 等[12]的方法,并做适当修改。先用蒸馏水洗涤麦麸原料,水洗离心数次后,将麦麸分散于蒸馏水中(1:10,m/V),用1 mol/L 柠檬酸调节pH 值至5.5,在55 ℃搅拌1.5 h 后用蒸馏水洗涤以分解植酸。离心弃去上清液后取沉淀物分散于蒸馏水中(料液比1:10),用2 mol/L 的NaOH 调节pH值至7.5,然后加入一定量的碱性蛋白酶,于55 ℃水解一定时间以除去样品中的蛋白质,沸水浴加热10 min灭酶,离心后收集沉淀物得去除蛋白质的麦麸。采用甲醛滴定法测定上清液中氨基酸态氮质量分数,可得蛋白质水解度。将去除蛋白质的麦麸样品与蒸馏水按1:10(m/V)的比例混合,用柠檬酸(1 mol/L)调节pH值至6,用α-淀粉酶在60 ℃水解样品中的淀粉,水解后沸水浴10 min 灭酶。离心后以上清液中的麦芽糖当量为淀粉水解度的指标,利用PAHBAH 法测定淀粉水解度[13],沉淀物即为麦麸IDF。最后用3%过氧化氢(1:10,m/V)对经上述处理的麦麸IDF 进行脱色,于室温下搅拌1.5 h 后离心,沉淀物进行冷冻干燥,粉碎并过60 目筛后,收集样品备用。
1.2.2 化学组成
采用凯氏定氮法测定蛋白质含量(GB 5009.5-2016),索氏抽提法测定脂肪含量(GB 5009.6-2016),采用食品中总灰分的测定方法测灰分含量(GB 5009.4-2016)。淀粉含量的测定使用Megazyme 总淀粉含量试剂盒[14]。总膳食纤维及不溶性膳食纤维含量采用食品中膳食纤维的方法测定(GB 5009.88-2014)。
1.2.3 微观结构分析
利用扫描电子显微镜(SEM)观察麦麸IDF 的微观结构。将干燥的样品用双面胶固定在铝金属的短板上,用真空镀膜仪(EMACE600,德国)给样品镀上一层金属薄膜,使其导电。在10 kV 的电压条件下捕获放大500 倍及1 000 倍的样品图像。
1.2.4 结晶结构分析
利用X-射线衍射仪(XRD)测定麦麸IDF 的结晶结构。扫描速度为4°/min,负载电压为40 kV,电流为40 mA,得到扫描范围为4°到45°的衍射图样[15]。
1.2.5 红外光谱分析
使用傅里叶红外光谱仪(FT-IR)测定麦麸IDF 分子中的官能团[16]。将样品与溴化钾以1:100(m/m)的比例混合,设置分辨率4 cm-1,扫描次数32 次,在扫描波长为400~4 000 cm-1范围内读取光谱。
1.2.6 麦麸不溶性膳食纤维的理化性质
1.2.6.1 持水性
参考Zhang 等[17]的方法,称取样品干基1.00 g(W1),加入蒸馏水(料液质量比为1:40),25 °C 下磁力搅拌1 h后,离心去除上清液(3 500 r/min,15 min),称取滤渣质量记为W2,按下式计算样品的持水性(A,g/g)。

1.2.6.2 持油性
参考Zhang 等[17]的方法,称取1.00 g(M1)样品,按料油质量比为1:20 加入花生油后混匀,恒温25 °C静置1 h 后离心15 min(3 500 r/min),弃去上清液油层,用滤纸抺除残留在离心管壁上的油,残渣的质量记为M2,按下式计算样品的持油性(B,g/g)。

1.2.6.3 膨胀度
参考Gouw 等[18]的方法,称取0.50 g 样品于10 mL量筒中,加入5 mL 蒸馏水。适当振荡后于室温下放置24 h,使其充分溶胀后测定样品溶胀体积。

式中:
C——膨胀度,mL/g;
V——样品溶胀体积,mL;
m——样品质量,g。
1.2.6.4 亚硝酸根离子吸附能力
将0.50 g 样品与100 mL浓度为100 μmol/L的亚硝酸钠溶液混合,用0.1 mol/L HCl 调节体系pH 值至2.0,于37 ℃下磁力搅拌2 h,混合物于3 500 r/min 离心15 min,取上清液,亚硝酸盐含量按照盐酸萘乙二胺法测得,通过紫外分光光度计测得反应前后亚硝酸盐含量,根据反应前后的浓度差计算亚硝酸根离子吸附能力,检测波长为538 nm[19]。
1.2.7 数据统计分析
所有试验均重复至少两次,采用SPSS 25.0 对数据进行统计分析,采用方差分析法(ANOVA)进行显著性差异分析,当p<0.05 时认为有显著性差异。
2 结果与讨论
2.1 麦麸不溶性膳食纤维的提取纯化
2.1.1 碱性蛋白酶添加量对蛋白质水解程度的影响
用碱性蛋白酶水解麦麸中的蛋白质,研究碱性蛋白酶用量(分别为麦麸干基质量的0.5%、1.0%、1.5%、2.0%和2.5%)对蛋白质水解程度的影响,酶解时间为2 h,结果见图1a。由图可知,当碱性蛋白酶用量在0.5%~2.0%时,蛋白质的水解程度随碱性蛋白酶添加量增大而上升,这是由于增加酶用量可以提高酶与底物结合的概率从而提高蛋白质水解率。当碱性蛋白酶用量大于2.0%时,酶解液中氨基酸态氮质量分数不再增加(氨基酸态氮质量分数表征上清液中游离氨基酸含量),即蛋白质水解程度趋于稳定,说明继续增加酶用量不能进一步提高蛋白质水解程度,反而会增加成本。
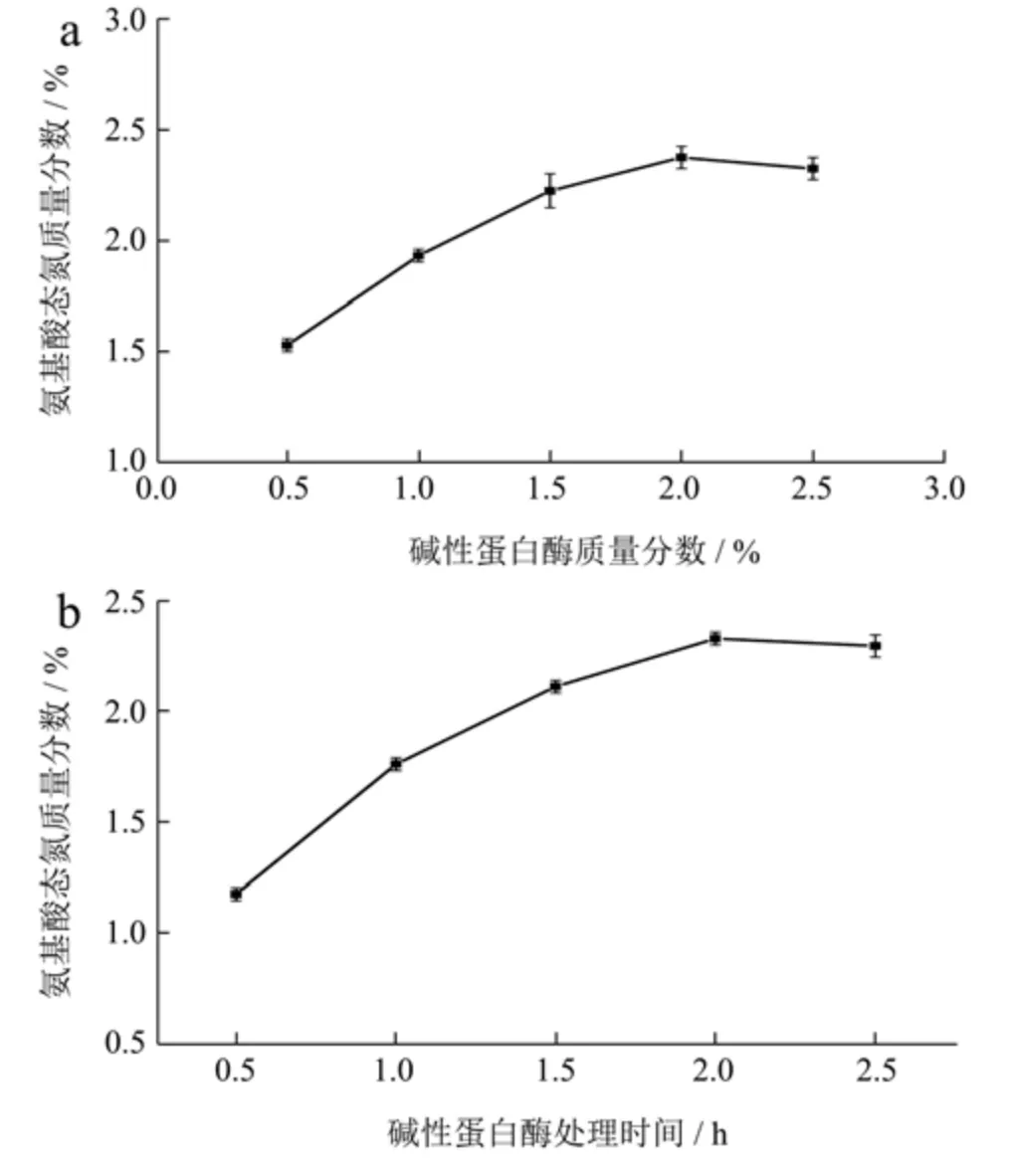
图1 碱性蛋白酶用量及处理时间对蛋白质水解程度的影响Fig.1 Effects of alkaline protease amount and treatment time on protein hydrolysis degree of wheat bran
2.1.2 碱性蛋白酶处理时间对蛋白质水解程度的影响
图1b 显示碱性蛋白酶(占麦麸干基质量的2.0%)的作用时间(分别为0.5 h、1.0 h、1.5 h、2.0 h 和2.5 h)对蛋白质水解程度的影响。结果表明,当酶解时间为0.5~2 h 时,蛋白质的水解程度随反应时间的延长而提高。水解时间大于2 h 时,蛋白质水解程度无显著提高,趋于稳定。这是由于随酶水解时间的延长,酶活力会下降,且不断堆积的反应产物可能抑制酶促反应的继续进行。
2.1.3α-淀粉酶的添加量对淀粉水解程度的影响
图2a 为α-淀粉酶添加量对淀粉水解程度的影响,其中酶用量分别为1.5%、2.0%、2.5%、3.0%、3.5%、4.0%(以麦麸干基质量为标准),作用时间为2.5 h。由图可知,当α-淀粉酶添加量为1.5%~3.5%时,淀粉的水解程度随α-淀粉酶用量增加而上升。酶用量达到3.5%时,体系中的淀粉水解程度达到最大,且随着酶用量的继续加大,体系中淀粉水解程度不再增加趋于稳定。

图2 α-淀粉酶用量及处理时间对淀粉水解程度的影响Fig.2 Effects of α-amylase amount and treatment time on starch hydrolysis degree
2.1.4α-淀粉酶水解时间对淀粉水解程度的影响
采用α-淀粉酶(用量为麦麸干基质量的3.5%)对经碱性蛋白酶处理后的样品中的淀粉进行水解,研究水解时间(分别为0.5 h、1.0 h、1.5 h、2.0 h 和2.5 h)对淀粉水解程度的影响,结果见图2b。由图可知,反应时间在0.5~2 h 时,随着α-淀粉酶处理时间的增加,淀粉的水解程度逐渐上升。当水解时间大于2 h,酶解液中麦芽糖含量总体趋于稳定,淀粉水解程度不再增加,此时淀粉几乎被完全水解。
2.2 麦麸不溶性膳食纤维的化学组成
采用碱性蛋白酶(用量为麦麸干基质量的2.0%即4 000 U/g 麦麸,酶解2 h)和α-淀粉酶(用量为麦麸干基质量的3.5%即140 U/g 麦麸,酶解2 h)除去麦麸中的蛋白质和淀粉后,分离得到麦麸IDF 样品(提取率91.16%),测定麦麸及麦麸IDF 的化学组成,结果如表1 所示。麦麸和麦麸IDF 中脂肪质量分数分别为2.67%和2.17%,低的脂肪含量表明其具有成为低热量食品成分的潜在应用价值。膳食纤维占麦麸干基质量的51.20%,是麦麸的主要成分。采用酶法除去蛋白质和淀粉等杂质后得到的麦麸IDF 中,淀粉和蛋白质质量分数由麦麸的27.05%和18.51%分别降低至0.56%和4.26%,说明淀粉和蛋白质组分被有效除去。灰分质量分数保持在约5.75%~5.56%。IDF 提取物中总膳食纤维质量分数升至86.50%,其中IDF 质量分数达82.56%。

表1 麦麸及麦麸不溶性膳食纤维(IDF)的化学组成Table 1 Chemical components of wheat bran and wheat bran insoluble dietary fiber (IDF)
2.3 麦麸不溶性膳食纤维结构性质
2.3.1 微观结构
麦麸IDF 的SEM 图像如图3 所示。由图3a 可观察到的麦麸IDF 颗粒的形状和大小不规则,多呈长条状,同时可观察到一些不规则的块状和小碎片。由图3b 可观察到麦麸IDF 表面结构疏松并且粗糙,有明显的孔洞和裂缝。有研究表明孔洞和裂缝使IDF 具有较大的表面积,且此结构与样品的理化特性相关,可显著影响水合性质(持水性和膨胀度等)及持油性[20]。

图3 麦麸不溶性膳食纤维(IDF)的微观结构Fig.3 SEM images of insoluble dietary fiber from wheat bran (IDF)
2.3.2 结晶结构
图4 为麦麸IDF 的XRD 衍射图谱。如图所示,麦麸IDF 在约21.9°处有明显的衍射峰,在34.5°处出现微弱的衍射峰。一般来说,于15.98°~22°(2θ)范围出现的强衍射峰是纤维素结晶结构的特征峰,对应纤维素结晶结构的002 晶面,2θ为34.5°对应纤维素结晶结构的004 晶面[11,21]。膳食纤维通常由有序结晶区和非晶区组成,其中结晶区主要由结晶纤维素组成,无定形区域由非结晶纤维素、半纤维素和木质素组成[15]。图4结果表明麦麸IDF 中存在结晶纤维素、半纤维素和木质素,且麦麸IDF 是典型的I 型纤维素结晶结构,此结果与人参IDF 的结晶结构的结果类似[12]。
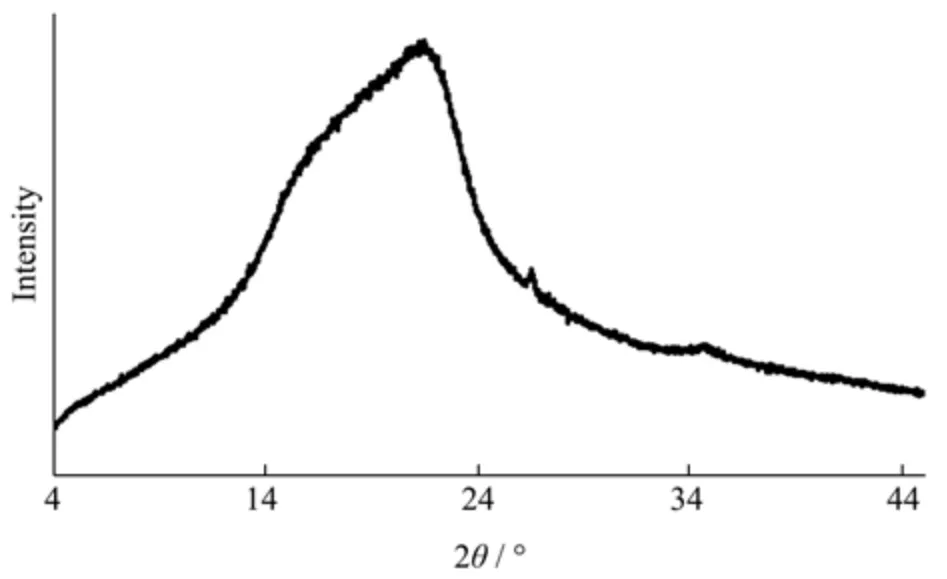
图4 麦麸不溶性膳食纤维(IDF)的结晶结构Fig.4 XRD curve of insoluble dietary fiber (IDF) from wheat bran
2.3.3 红外光谱分析
采用红外光谱仪对麦麸IDF 在分子水平上的官能团和结构基团进行检测,结果见图5。结果显示,麦麸IDF 在3 351.99 cm-1处有一个宽吸收峰,这主要归因于纤维素和半纤维素中-OH 的伸缩振动。在2 924.95 cm-1处存在吸收峰,这是由-CH3或=CH2的C-H 拉伸引起,代表纤维素多糖化合物的典型结构。1 735.77 cm-1处为半纤维素中乙酰基和/或羧基上C=O 的伸缩振动吸收锋。1 514.29 cm-1处的弱峰对应木质素苯环的特征吸收。897.53 cm-1是纤维素中β-D-葡萄糖基的特征吸收峰[12]。上述结果表明,麦麸IDF 具有膳食纤维的典型官能团,结合XRD 结果可知麦麸IDF 的组分包括纤维素、半纤维素和木质素,这与文献报道豆渣IDF 和人参IDF 的结果类似[12,16]。
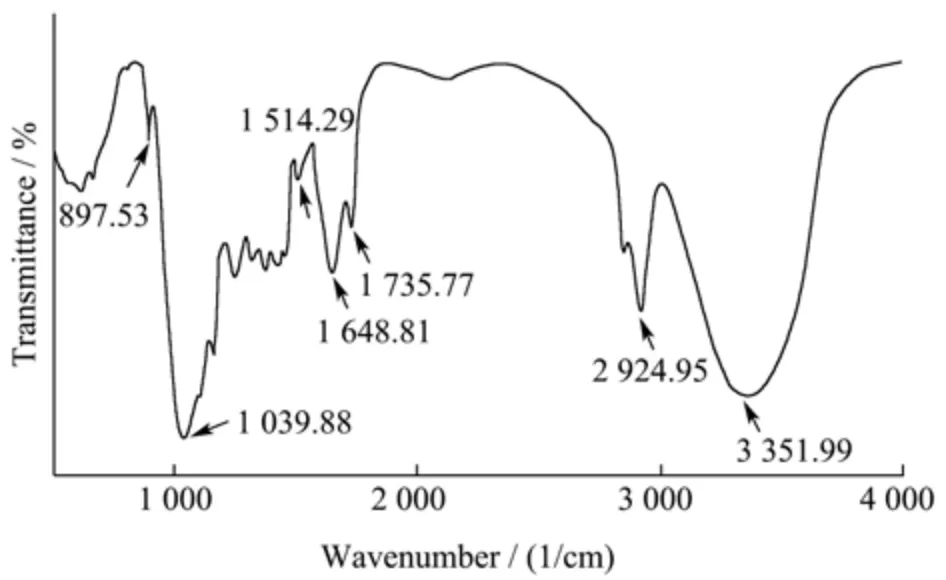
图5 麦麸不溶性膳食纤维(IDF)的红外光谱图Fig.5 The FT-IR curve of insoluble dietary fiber (IDF) from wheat bran
2.4 麦麸不溶性膳食纤维的理化性质
2.4.1 持水性、持油性及膨胀度
持水性、膨胀度和持油性是评价膳食纤维预防和缓解肥胖、肠道疾病等功能性质的重要指标[22]。麦麸IDF 的持水性、膨胀度和持油性结果如图6 所示。由图6a 和图6b 可知,与麦麸相比,麦麸IDF 的持水力和膨胀度均显著增加,其中持水性由1.39 g/g提升到3.82 g/g,膨胀度从1.18 mL/g 增加到2.59 mL/g。麦麸IDF 的持水能力高于经酶法提取的竹笋壳IDF(2.83 g/g)[23]。有研究表明,良好的持水性和膨胀度有利于凝胶的形成和结构的稳定,说明麦麸IDF 具有可应用于果酱等食品中提高食品稳定性的潜力,且较高的持水性和膨胀度有利于提高人体摄入后的饱腹感[8]。从图6c 可看出,麦麸IDF 的持油性为1.78 g/g,显著高于麦麸的持油性(0.75 g/g),与文献报道人参IDF 的持油性(1.78 g/g)接近[12],且明显高于莲藕IDF(0.62~1.50 g/g)[24]。较高的持油性表明麦麸IDF 可应用于肉制品中,赋予肉制品良好的持油能力,有利于改善肉制品的口感。
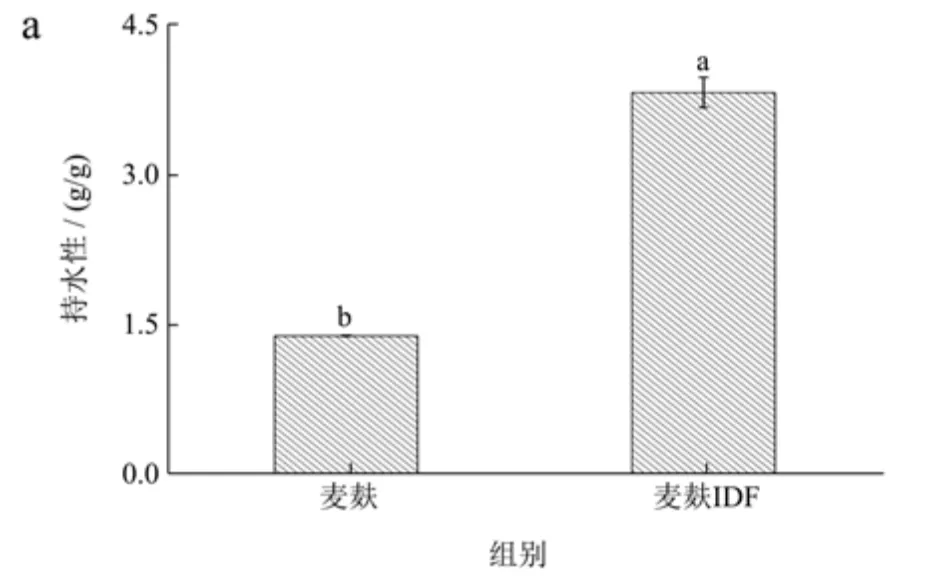
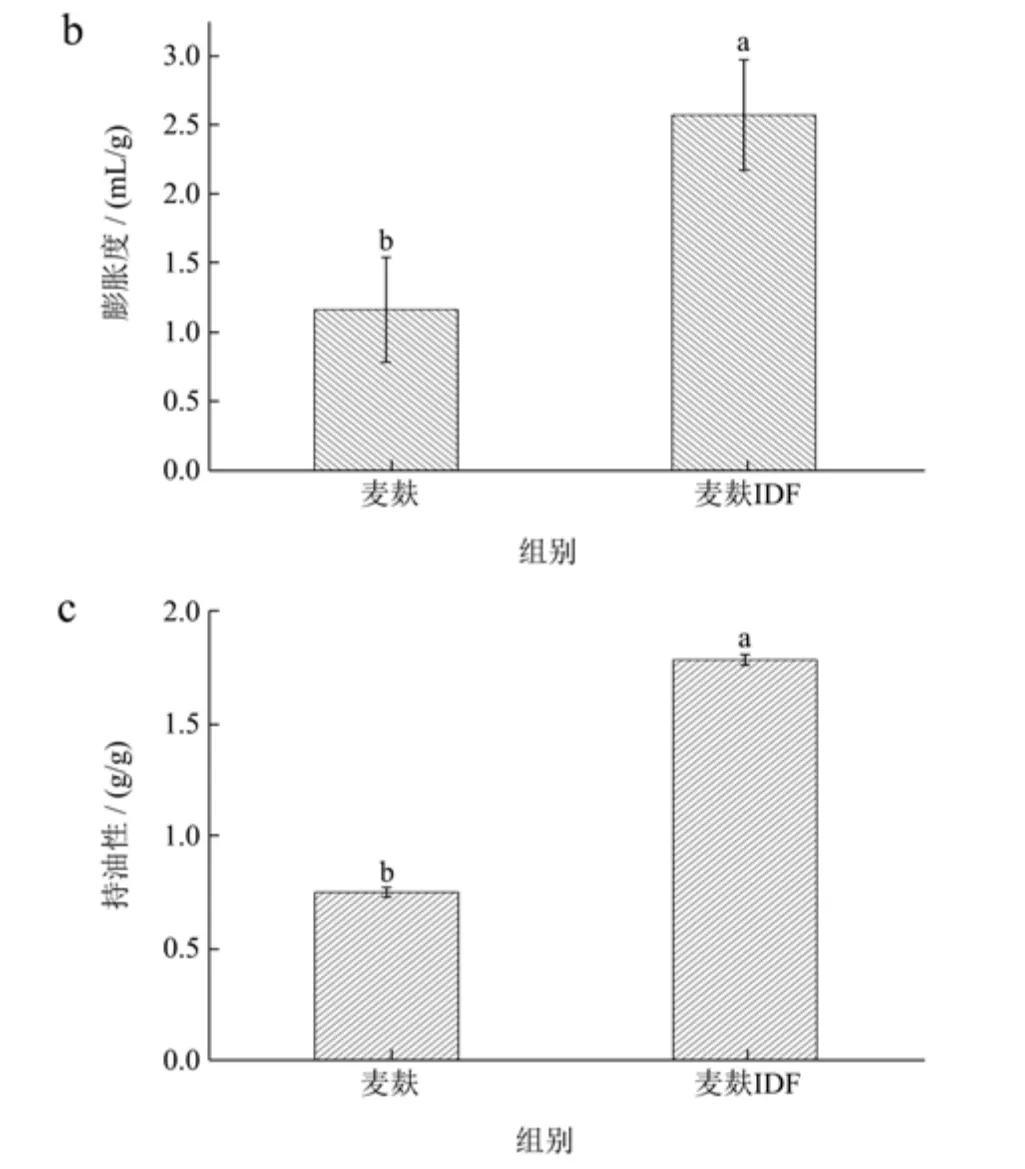
图6 麦麸及麦麸不溶性膳食纤维(IDF)的持水性、膨胀度及持油性Fig.6 Water holding,swelling capacities and oil holding of wheat bran and insoluble dietary fiber (IDF) from wheat bran
2.4.2 亚硝酸根离子吸附能力
亚硝酸会对人体健康产生如致癌致畸等负面影响,前期有研究指出,麦麸膳食纤维具有防癌的作用,并推测这可能与它具有消除亚硝酸根离子的能力有关[19]。因此,本研究测定麦麸IDF 对亚硝酸根离子的吸附能力,结果见图7。由图可知,麦麸与麦麸IDF 的亚硝酸根离子清除率分别为73.57%和95.63%,表明麦麸及麦麸IDF 均具有清除亚硝酸根离子的能力,且麦麸IDF 清除亚硝酸根离子的能力显著强于麦麸,说明麦麸IDF具有较强的用于吸附食品中有害物质的能力。结合SEM 结果分析,这可能是由于麦麸IDF 比麦麸具有更大的表面积,更大的表面各有助于提高亲水性基团和亲脂性基团暴露的可能性,从而提高麦麸IDF 吸附亚硝酸根离子的能力[25]。
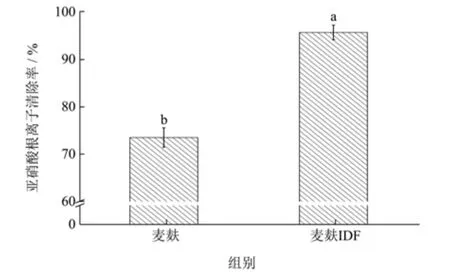
图7 麦麸及麦麸不溶性膳食纤维(IDF)的亚硝酸根离子清除率Fig.7 Nitrite scavenging rate of wheat bran and insoluble dietary fiber from wheat bran
3 结论
本研究以麦麸为原料,采用碱性蛋白酶和α-淀粉酶对麦麸进行酶解以去除蛋白质和淀粉等主要杂质,纯化麦麸IDF。对酶解条件研究的结果表明,当碱性蛋白酶的用量为麦麸干基质量2.0%(即4 000 U/g 麦麸),酶解时间为2 h;α-淀粉酶的用量为麦麸干基质量3.5%(即140 U/g 麦麸),作用时间为2 h 时,对麦麸IDF的提取纯化效果较好,提取物中总膳食纤维含量为86.50%,其中IDF 含量为82.56%。利用SEM 观察麦麸IDF 的表观形貌,观察到麦麸IDF 多呈长条状,表面结构疏松并且粗糙,有明显的孔洞和裂缝,此结构可能有利于提高麦麸IDF 的水合性质及持油性。采用XRD 和FTIR 对麦麸IDF 的结晶结构及官能团进行分析,结果表明麦麸IDF具有典型的I型纤维素结晶结构,主要组分包括纤维素、木质素和半纤维素。与麦麸相比,麦麸IDF 的理化性质得到显著改善,其持水力达到3.82 g/g,膨胀度达2.59 mL/g,良好的持水性和膨胀度说明麦麸IDF可应用于果酱等食品提高食品稳定性,且有利于提高人体摄入后的饱腹感。麦麸IDF 的持油性较好(1.78 g/g),说明其可用于肉制品提高持油能力改善口感。此外,亚硝酸根离子清除率高达95.63%,说明麦麸IDF 可作为功能成分用于食品,可降低亚硝酸盐对人体健康的不良影响。上述结果表明,麦麸IDF具有作为食品配料用于面制品、肉制品、凝胶制品等提高产品稳定性、感官品质和功能性的潜力。
