冷等离子体处理改性大豆分离蛋白及改善其界面性能
2023-01-12王然龚维郭晓璐郑寒胡蒋宁
王然,龚维,郭晓璐,郑寒,胡蒋宁
(大连工业大学食品学院,辽宁大连 116034)
蛋白质的结构和功能特性将影响其在食品工业中的应用[1]。大豆分离蛋白(SPI)作为一种低变性和脱脂豆粕的植物蛋白,由于其可食用性、发泡性、凝胶化等特性已广泛用于食品工业中[2]。SPI 主要含有大豆球蛋白和β-伴大豆球蛋白,具有丰富且平衡的极性和非极性电荷[3]。然而,以往的研究表明,由于其结构和不稳定的界面性能,天然SPI 在食品中的应用度仍然不理想[4]。SPI 的改性是改善其功能特性的常见且有效的方法。据报道,许多化学方法,包括羧甲基化[5]、脱乙酰化[6]和酸水解[7]都可以改性SPI。尽管一些化学修饰方法可以极大地改善SPI 的功能,但改性过程较为复杂、低效且设备较为昂贵[8]。此外,化学试剂残留也是蛋白化学改性的关键挑战。因此,有必要探索一种无溶剂、高效的SPI 改性方法。
等离子体是在高压放电环境中产生的电离的气体,通常被认为是除了固体、液体和气体之外的第四种状态。由于离子、电子、紫外光子和反应性中性物质(自由基和受激原子分子)的存在,可以破坏物质表面的共价键,引发各种化学反应。根据能量供应的类型和传递到等离子体的能量大小,等离子体可分为高温等离子体(TP)和低温等离子体(LTP)。LTP 进一步细分为热等离子体和冷等离子体。在热等离子体中,电子和气体分子等物质之间存在局部热力学平衡。相比之下,冷等离子体中不存在热力学平衡,电子的温度约为104 K,而离子和中性粒子的温度通常接近室温[9]。研究表明,冷等离子体可用于修饰食品表面结构并改变其物理化学性质,且处理过程无溶剂、高效环保[10]。冷等离子体在电离、温度和密度方面具有较大的操作范围,因此在提供干燥、可扩展、无污染、快速、一步的表面改性方法方面具有巨大潜力[11]。据报道,冷等离子体处理蛋白质,可以改变蛋白质的初始结构和残基组成,从而暴露埋藏的疏水基团,使其更加活跃,并在表面上充分展开[12]。蛋白质的界面性能发生显著变化,原因在于冷等离子体中的电子可以与氨基酸中的富电子基团发生反应,从而改变它们的亲水性[13]。冷等离子体处理也是提高蛋白质功能和活性的有效策略[14,15]。基于上述分析,我们推测冷等离子体处理可以用于SPI 改性,有利于SPI 的界面性能改善[16]。
本研究选用冷等离子体技术对SPI 进行改性研究,示意图如图1 所示。对冷等离子体处理后SPI 的荧光光谱、二级结构、溶解度、表面疏水性、游离巯基(-SH)基团、持水能力(WHC)、持油能力(FHC)、粒度、表面变化、表面张力、界面张力和微观结构(SEM,AFM)进行了表征。

图1 冷等离子体改变SPI 特性的主要现象示意图Fig.1 Schematic representation of the main phenomena that the cold plasma changing the character of SPI
1 材料与方法
1.1 材料与设备
大豆分离蛋白(SPI,纯度>90.21%),中国大连博诺生化试剂有限公司。所有其他试剂和化学品均为分析级。所有溶液均用去离子水制备。SCIENTZ-10 ND-真空冷冻干燥机,宁波新芝生物有限公司;等离子体机,苏州欧普斯等离子体技术;F-2700 荧光分光光度计,日本Hitachi 公司;J-1500 圆二光谱仪,日本Hitachi 公司;Lambda 35 紫外分光光度计,美国Perkin Elmer 公司;一体式动静态同步激光光散射,瑞士LSI公司;DT-1202 超声粒度及Zeta 电位分析仪,美国分散科技公司;Tecan Infinite M200 多功能酶标仪,瑞士Tecan 公司;DSA 25 接触角测量仪,德国KRUSS 公司;SB800DT 超声波清洗机,宁波新芝生物有限公司;SU 8010 扫描电子显微镜,日本Hitachi 公司;原子力显微镜AFM5500,日本Hitachi 公司。
1.2 实验方法
1.2.1 悬浮液的制备
将制备好的SPI 分散在PBS(10 mmol/L,pH 值7.0)中,室温下搅拌5 h,制备浓度为10 mg/mL 的SPI 悬浮液。将叠氮钠(0.02%,m/V)作为抗菌剂加入到分散液中,随后,在4 ℃下保存过夜,以确保完全水合。
1.2.2 冷等离子体处理
将约5 mL 的SPI 溶液均匀铺于等离子体石英载体平台上,用等离子体机进行处理。其中等离子体源由两个直径为15 cm 的铝盘电极组成,覆盖在两个聚丙烯电介质(2 mm 厚)上,将装有样品的石英载体平台置于其间。处理参数为:功率50 W,时间分别为0 s(对照)、10 s、30 s、60 s 和120 s。处理后,样品保存在4 ℃冰箱,直至进一步分析。
1.2.3 荧光光谱的测定
按冷等离子体处理时间(0 s、10 s、30 s、60 s 和120 s)将浓度为0.2 mg/mL 的SPI 溶液分为五组,记录荧光光谱。激发波长:280 nm,发射波长:300~500 nm。激发和发射狭缝宽度均设置为5 nm[17]。
1.2.4 圆二(CD)光谱的测定
进行SPI 溶液的CD 光谱测定。光谱记录的波长范围为190~260 nm,扫描速度为20 nm/min,采用0.2 nm间隔,进行三次扫描。通过减去磷酸盐缓冲溶液的光谱进行校正。
1.2.5 溶解度的测定
将2 mg/mL SPI 样品分散在PBS 中,在8 354 r/min离心,20 ℃下离心20 min,以牛血清白蛋白(BSA)为标准,用BCA 法测定上清液中的蛋白质含量。蛋白溶解度(%)为离心前后蛋白浓度之比。
1.2.6 表面疏水性(H0)的测定
用1-苯胺基-8-萘磺酸盐(ANS)作为荧光探针测定H0。将1 mg/mL SPI 样品在4 ℃下8 354 r/min 离心15 min。测定上清液中的蛋白浓度后,用相同的缓冲液连续稀释各上清液至所需浓度。然后分别从每个稀释的分散液中取4 mL,并加入40 μL 的8.0 mmol/L ANS 溶液。测量荧光强度(FI),激发波长:390 nm,发射波长:470 nm。H0为FI 与蛋白浓度(mg/mL)的初始斜率。
1.2.7 游离巯基(-SH)的测定
游离-SH 含量按照Yan 等[18]先前描述的方法进行测定,并做了一些修改。用Tris-Gly 缓冲液(0.086 mol/L Tris-HCl,0.09 mol/L Gly 和4 mmol/L EDTA,pH 值8.0)将每个样品等份稀释到蛋白浓度为0.2%。然后加入0.08 mL 浓度为4 mg/mL 的DTNB 溶液,涡旋混合(除空白)。并将混合后的溶液立即在室温黑暗环境下静置30 min。用紫外-可见分光光度计在412 nm 处测量上清液的吸光度。

式中:
Q——游离巯基(-SH)含量,μmol/g;
A412——样品在412 nm 处的吸光度;
D——稀释因子;
C——蛋白浓度,g/L。
1.2.8 持水力(WHC)和持油力(FHC)的测定
取1.0 g 样品于离心管,加入10 mL 蒸馏水,涡旋混合。室温下放置30 min 后以3 000 r/min 离心20 min。计算持水力(Water-holdingcapacity,WHC)的公式为:

式中:
H——持水力,g/g;
W1——离心前的质量,g;
W2——离心后的质量,g。
持油力(Fat-holdingcapacity,FHC)的测定同WHC稍作修改。将样品(1.0 g)放入离心管中,加入5 mL大豆油,充分混合。室温下放置30 min 后以3 000 r/min离心20 min。FHC 的计算公式为:

式中:
F——持油力,g/g;
W1——离心前的重量,g;
W2——离心后的重量,g。
1.2.9 粒径和ζ-电位的测定
动态光散射(Dynamiclightscattering,DLS)方法评估SPI 溶液的粒径。将SPI 溶液稀释后用0.45 μm 孔径的过滤器过滤,比例约为1:1 000(V/V)。用超声粒度仪在25 ℃下测量SPI 溶液的ζ-电位。
1.2.10 动态界面张力的测定
利用光学接触角仪在25 ℃下记录表面压力和表面扩张参数的时间变化,监测SPI 溶液在气水界面和油水界面的动态表面特性。将一滴SPI 溶液(6 μL)送入光学玻璃中,静置90 min,使其在空气-水表面实现吸附。同样,将一滴SPI 溶液(35 μL)滴入装有纯化油的光学玻璃比色皿中,静置180 min,实现油水表面的吸附。根据拉普拉斯基本方程计算表面张力和界面张力(σ)。实验所用油为大豆油,由于大豆油含有表面活性剂和其他杂质,因此在使用前对大豆油进行了净化。具体操作如下:将4 g Florisil 分子筛加入100 mL 大豆油中搅拌4 h,然后以10 000 r/min 离心20 min,去除沉淀杂质,并重复离心操作三次,直到纯水在油相上的界面张力在30 min 内没有显著变化(通过滴状分析法检测)。
1.2.11 扫描电子显微镜(SEM)分析
利用冷场扫描电镜分析了样品的微观结构。简单地说,将样品放入铝样品盘中,并立即在液氮中冷冻,然后转移到低温制备室中,用低温刀切割样品。新制样品表面在-90 ℃下升华并进行蚀刻,并将水移动到几微米的深度以揭示表面下方的结构。升华后,样品喷金并转移到SEM 室。在-175 ℃和10 kV 加速电压下进行分析。
1.2.12 原子力显微镜(AFM)分析
通过原子力显微镜测量SPI 样品的形态。将SPI 样品(0.02 mg/mL)滴到云母片上,在真空下干燥,并进行成像。通过Selector App 软件对样品进行可视化处理。
1.3 数据处理和分析
采用Origin 8.5 软件整理数据和作图。采用SPSS 16.0 软件对得到的数据进行单因素方差分析。
2 结果与讨论
2.1 荧光测量
荧光光谱可用于预测蛋白质在溶剂中的折叠及解折叠。含有发色团氨基酸如色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸残基(Phe)的蛋白质可以表现出较强的内在荧光[19]。不同冷等离子体处理时间(0、10、30、60和120 s)的SPI 荧光光谱如图2 所示。
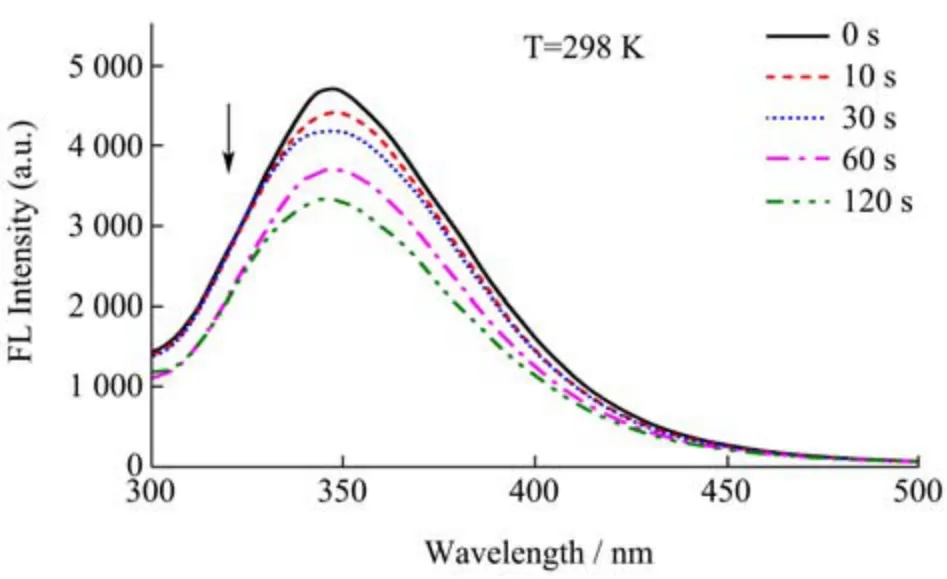
图2 不同冷等离子体处理时间对SPI 荧光光谱的影响Fig.2 Effect of different cold plasma treatment duration on fluorescence spectra of SPI
由于SPI 的所有λmax>330 nm,因此SPI 中的Trp组分暴露于极性环境中。在没有进行冷等离子体处理的情况下,SPI(0.25 mg/mL)在磷酸盐缓冲液中在347.5 nm左右出现的荧光峰,随着冷等离子体处理时间的增加,SPI 荧光强度下降,这表明冷等离子体处理对蛋白质的天然荧光有淬灭作用[20]。同时,观察到轻微的蓝移(从347.5 nm 到345.5 nm),这表明SPI 的环境从亲水性到相对疏水性更强[21]。这可能是冷等离子体可以破坏蛋白质内部的疏水相互作用,并将疏水的氨基残基带到表面。对于经过冷等离子体处理的SPI,其原本埋藏于内部的疏水残基和巯基基团的暴露量可能会增加,有利于SPI 在油水界面的展开,从而提高其表面活性[22]。
2.2 二级结构
表1为冷等离子体处理后圆二光谱表征的二级结构结果。随着冷等离子体处理时间的增加,SPI 样品的几种二级结构成分发生了显著变化(p<0.05)。与未处理SPI 相比,经冷等离子体处理60 s 后,SPI 的α-螺旋含量从31.93%下降到23.56%,而β-折叠含量略有下降,从32.83%下降到27.13%,然后又有所上升。SPI 的无规卷曲含量随着处理时间的增加而增加,在60 s 时达到最大值,然后减少。这些二级结构的变化表明,冷等离子体处理能够诱导蛋白去折叠,结构更加伸展,展开为更灵活的结构,有利于SPI 在界面上的吸附和重组[23]。当处理时间进一步延长时,蛋白质分子可能发生交联。
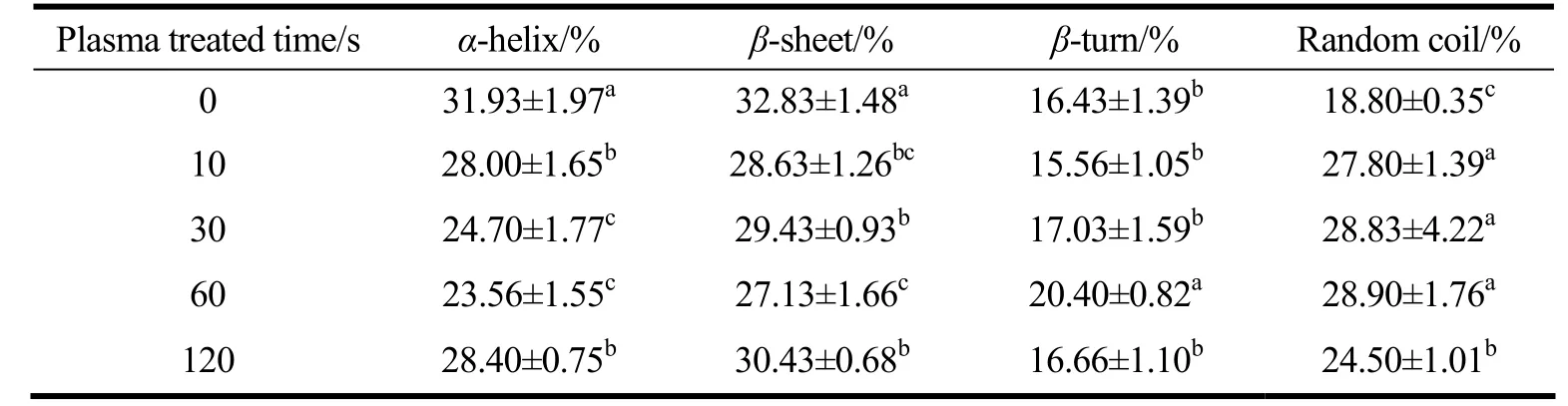
表1 冷等离子体处理时间对SPI 二级结构的影响Table 1 Effect of cold plasma treatment duration on the secondary structures of SPI
2.3 蛋白质的溶解度和表面疏水性
溶解度是评价蛋白质功能性质的重要指标,可以用来评价蛋白质的变性和聚集性。在食品工业中,蛋白质的溶解度与蛋白质的乳化、凝胶化、发泡和打发性能的形成有很大关系[24]。图3a 为SPI 在冷等离子体不同处理时间(0、10、30、60 和120 s)下的溶解度。可以看出,SPI 的溶解度随着处理时间的增加呈先升高后降低的趋势。当处理时间为30 s 时,SPI 的溶解度达到最大值(46.06%)。SPI 溶解度增加可能是由于等离子放电产生的高能粒子的刻蚀作用使蛋白比表面积增加,活性位点暴露,大量的亲水基团被激发,在蛋白表面形成水膜,SPI 的溶解度增加[25]。随着处理时间的延长,SPI 的溶解度下降,这可能是由于持续放电引起蛋白之间的交联,表面活性位点减少,蛋白溶解度降低[26]。此外,蛋白质膨胀后,疏水基团暴露的比例也增加,一些可溶性蛋白经过长时间处理后可能会转化为不溶性的蛋白质聚集体[27]。
蛋白质表面的疏水性是衡量蛋白质分子表面与极性水环境接触的疏水基团数目的一个指标,它与蛋白质功能性质密切相关[28]。冷等离子体处理对SPI 的H0的影响如图3b 所示。观察到随着冷等离子体处理时间的增加,SPI 的H0从2 330.9 增加到3 680.7。其原因可能是由于摩擦力、碰撞力和剪切力的共同作用,改变了SPI的三级结构,使分子内部的疏水基团暴露出来。蛋白质疏水性的提高,有利于蛋白质快速吸附于油水界面,从而改善蛋白质的界面性能。随着时间的进一步增加,SPI可能发生交联反应,暴露了的疏水基团的数量减少导致SPI 的H0降低。Hua 等[29]发现ANS-H0与大豆蛋白的溶解度成反比。相反,Wagner 等[30]研究了溶解度与H0的关系,发现H0越大,溶解度越大。这些相互矛盾的观察结果可能是由于蛋白质分子表面疏水基团之间分子间相互作用的程度不同造成的[31]。而在本研究中,我们发现大豆蛋白的溶解度和表面疏水性在处理早期呈正相关,当处理时间大于60 s 时呈负相关。
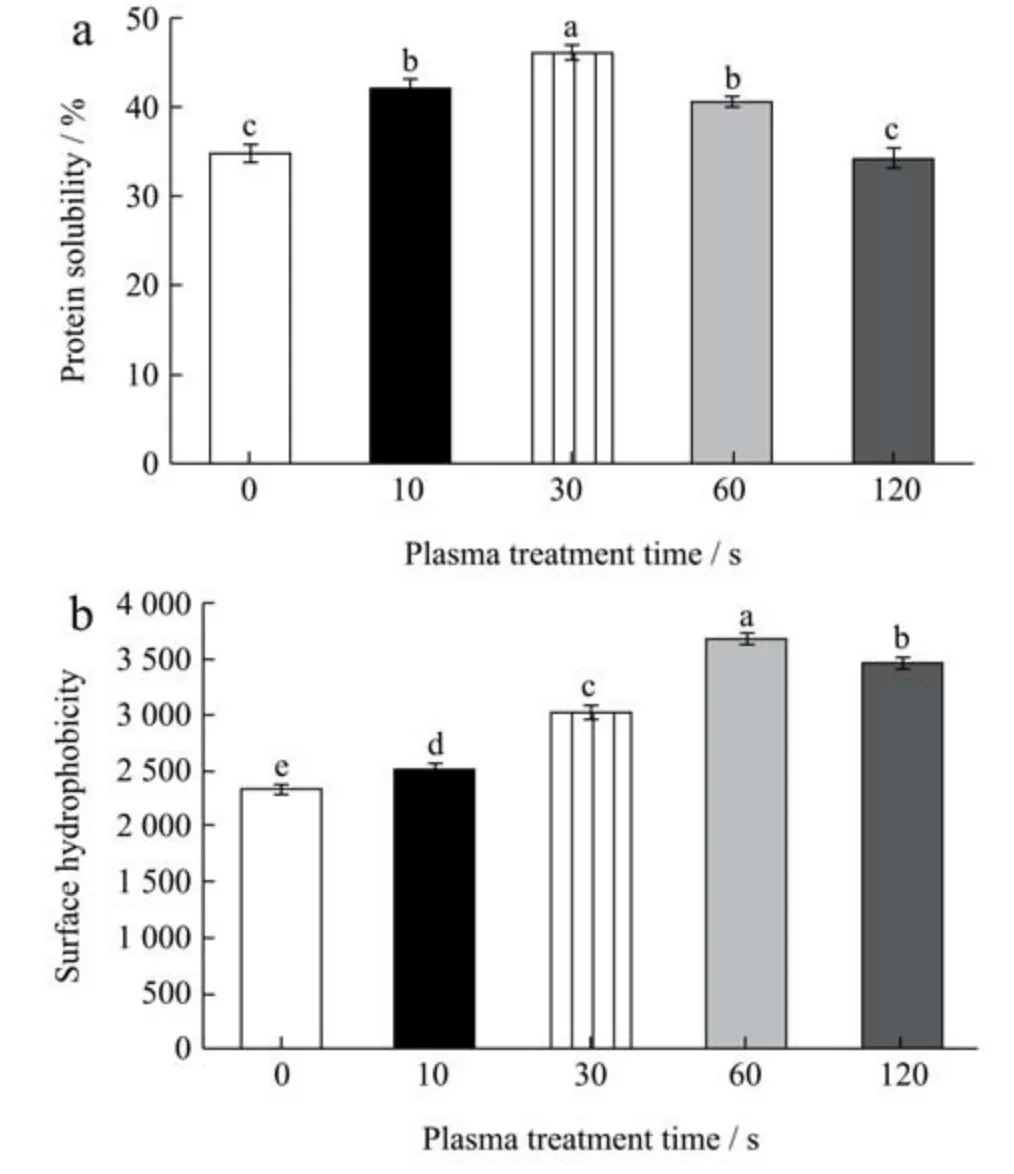
图3 不同冷等离子体处理时间对SPI 蛋白溶解度(a)和表面疏水性(b)的影响Fig.3 Effect of different cold plasma treatment duration on protein solubility (a) and surface hydrophobicity (b) of SPI
2.4 游离巯基含量
巯基的含量的变化可以揭示蛋白质构象的变化,对蛋白质的功能特性起着重要作用。从图4 可以看出,处理后的SPI 游离巯基含量明显增加。此外,随着冷等离子体处理时间的增加,巯基基团含量也有所增加,从9.77 μmol/g 蛋白(未处理SPI)增加到17.76 μmol/g蛋白(50 W,60 s)。巯基含量的增加可能是由于冷等离子体处理可以破坏二硫键,二硫键的减少会导致巯基的形成,并且巯基暴露在SPI 分子的表面[32]。

图4 不同冷等离子体处理时间对SPI 巯基含量的影响Fig.4 Changes in free sulfhydryl content of SPI with different cold plasma treatment duration
2.5 持水能力(WHC)和持油能力(FHC)
蛋白质的WHC 和FHC 在食品的质地中起着重要的作用,尤其是肉糜、乳制品和烘焙面团。如图5 所示,SPI 经冷等离子体处理后的WHC 和FHC 值均高于未处理的SPI,且随着处理时间的增加而增加。这可能是由于冷等离子体处理导致蛋白表面结构发生变化,使其结合水的能力增强。与此同时,等离子处理也会使疏水基团(图3b)暴露,增强油和蛋白之间的作用力,从而提高FHC。在处理60 s 时,SPI 的WHC达到最大值(7.05 g/g 蛋白),而在120 s 时,FHC 达到最大值(2.65 g/g 蛋白)。已有研究报道,蛋白质的FHC与其结构有关,特别是非极性侧链基团、分子大小、柔韧性和变性程度[33]。随着蛋白质表面积的增加,可以吸收更多的油脂,有利于SPI 在乳液方面的应用。
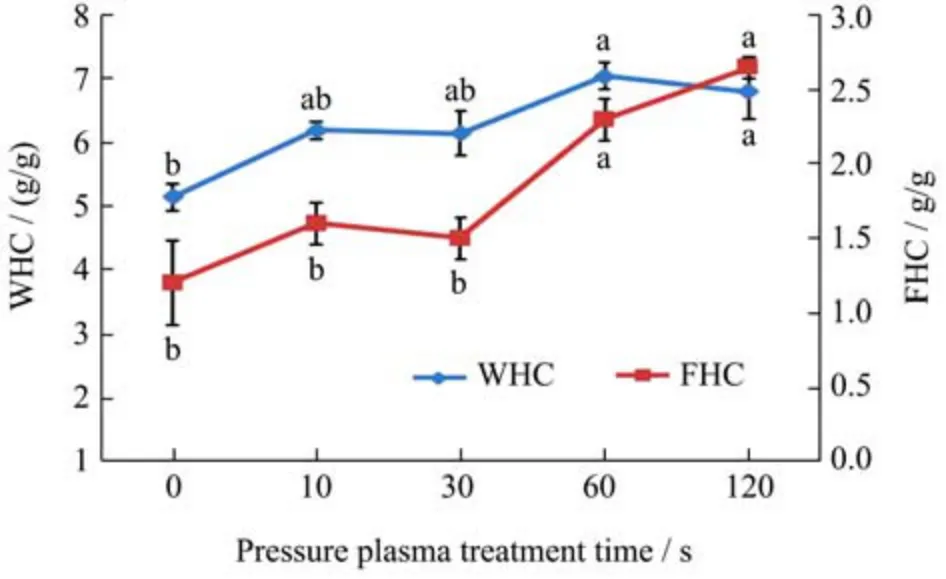
图5 不同冷等离子体处理时间对SPI 持水力和持油力的影响Fig.5 Changes in WHC and FHC of SPI with different cold plasma treatment duration
2.6 ζ-电位和粒径大小
蛋白质颗粒表面的有效电荷主要取决于蛋白质表面的负电荷,溶液体系的稳定性可以通过绝对ζ-电位的值来衡量[34]。本研究中检测的所有样品的ζ-电位均为负值(图6a),这表明冷等离子体处理的SPI 含有更多带负电荷的氨基酸。结果表明,前60 s 的处理可以增加蛋白质表面的负电荷和粒子间的静电斥力,打破蛋白粒子的聚集,从而使蛋白分散体系的稳定性更好。此外,冷等离子体处理通过蛋白质二级结构的构象变化(表1)导致一些先前被掩埋的氨基酸暴露,冷等离子体化学反应物氧化氨基酸残基会将它们转化为带负电荷的副产物,导致ζ-电位有所降低。冷等离子体处理样本的ζ-电位值之间的差异也可能归因于结构变化对蛋白质表面可用的带正电/负电氨基酸残基比率的影响。随着处理时间的进一步增加,ζ-电位绝对值有所降低,可能是由于蛋白质之间的交联聚集所致。蛋白质表面有效电荷对界面性能非常重要,也会影响蛋白质在水相中的溶解度[35]。因此,冷等离子体处理可用作增加蛋白质表面电荷的有效方法,从而通过增加液滴之间的静电排斥力来改善乳液的稳定性[36]。冷等离子体处理对粒径分布的影响见图6b。所有样品均表现出单峰分布曲线,但峰的大小和位置随处理时间而变化。当蛋白浓度为10 mg/mL 时,天然SPI 样品的粒径范围为10 nm~100 nm。随着冷等离子体处理时间的增加,粒径的分布范围减小,粒径大小更为均匀。同时,经处理后,较大尺寸的蛋白样品颗粒消失,说明冷等离子体处理改变了SPI 的结构,形成了较为均匀的分散体。但仍有较宽的粒径分布范围,部分粒径增大可能是因为处理过程中蛋白质发生了聚集,而部分粒径减小,这可能是由于冷等离子体处理过程中蛋白质肽链断裂。
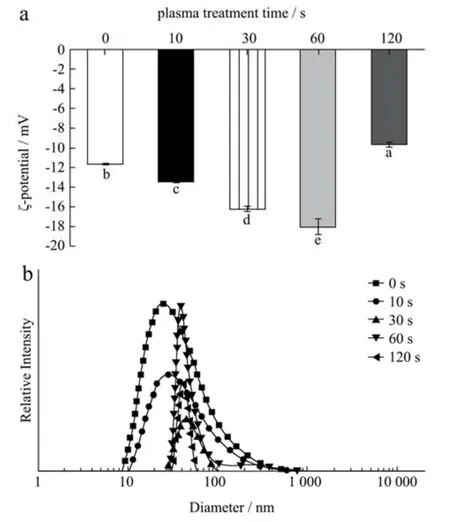
图6 不同冷等离子体处理时间对SPI ζ-电位(a)和粒径(b)的影响Fig.6 Effect of different cold plasma treatment duration on the ζpotential (a) and size (b) of SPI
2.7 表面张力和界面张力分析
为阐明蛋白质在气-水表面和油-水界面的吸附行为,监测了SPI 的表面张力和界面张力的时间演变。一般来说,蛋白质分子靠近液滴表面,会降低液滴的表面张力和界面张力[37]。如图7a 所示,未经处理的SPI和经过冷等离子体处理的SPI 都能在气水界面被吸附,并显著降低表面张力。其中,经冷等离子体处理后的SPI 降低表面张力的能力远高于未经处理的SPI,并且在一定范围内,处理时间的增加导致表面张力下降更为明显,这可能是由于蛋白质的疏水面积增加(图3a)所致。从图7b 可以看出,与对照组相比,冷等离子体处理后蛋白的油水界面张力初始值降低,说明冷等离子体处理可以改善SPI 的界面性能。一般来说,蛋白质分子降低相邻液体界面张力的能力受到蛋白质的物理化学和结构性质的影响。因此,蛋白质结构的任何变化都会改变蛋白质在界面上的吸附速率及其界面性能。柔性结构的存在和二硫键数量的减少会增加蛋白质在界面上的吸附[38]。之前的研究结果证明经过冷等离子体处理的SPI,其溶解度(图3a)、疏水性(图3b)和游离巯基(图4)都会相对提高,这些因素有利于提高SPI 在界面上的吸附速率,从而界面张力降低。并且可以发现,在所有样品中当处理时间为60 s 时两相间张力最小,说明此条件下SPI 界面性能最好。
2.8 微观结构分析(SEM 和AFM)
用SEM 观察冷等离子体处理对SPI 微观结构的影响。图8a~8c 为不同SPI 在放大系数为1 000 倍时的一组SEM 图像。可以观察到,处理后的样品比未处理的样品A 有更大、更多样的结构。冷等离子体处理后的变化是由于SPI 分子展开以及表面疏水基团(图3b)和游离巯基基团暴露量(图4)的增加所致。以上结果表明,高碰撞、高摩擦和高剪切力的处理可能会改变SPI 聚集体的表面形貌,导致微观结构的变化,从而影响蛋白质的粒径大小和粒径分布(图6b)。通常情况下,分散体中较小的团聚物可能会导致较高的溶解度,尽管样品在干燥状态下经过处理后聚集体较大,但分散状态下较小[27]。与未处理样品相比,经冷等离子体处理后的SPI 分散体更小,粒径分布范围更窄(图6b)。这些研究结果与SPI 蛋白在冷等离子体处理后溶解度的提高(图3a)是一致的。
采用AFM 观察冷等离子体处理对SPI 形态的影响。从图8d~8g 的高度图和相位图可以看出,未处理的SPI 的表面呈现出带有谷状的粗糙表面,凹凸起伏较大。而在图8g 中,经冷等离子体处理的SPI 表面被蚀刻到一定程度,改变了表面的物理结构,这可能是由于冷等离子体处理产生的高碰撞、摩擦和剪切力造成了SPI 聚集[39]。此外,随着冷等离子体处理程度的增加,表面刻蚀程度增加[40]。
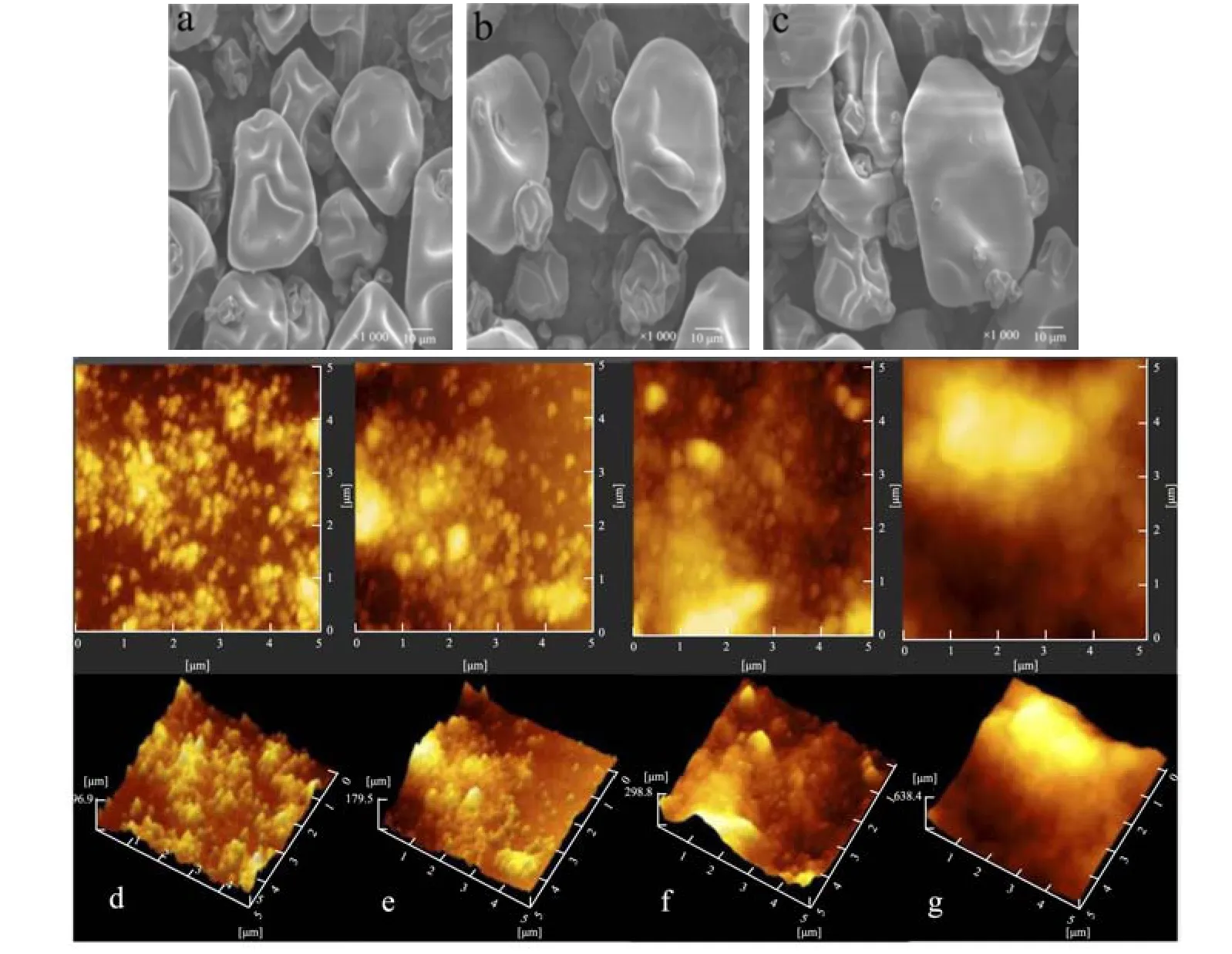
图8 大豆分离蛋白经冷等离子体处理不同时间的SEM 图像(a~c,×1 000)及不同冷等离子体处理时间对SPI 的AFM 光谱的影响(d~g)Fig.8 SEM graphs (×1 000) of SPI powders exposed to cold plasma treatment duration (a~c) and effect of different cold plasma treatment duration on AFM spectra of SPI (d~g)
3 结论
本文提供了一种使用冷等离子体修饰大豆分离蛋白(SPI)结构的策略,以拓展其功能,尤其是界面性能。冷等离子体处理可以有效地改变SPI 的二级结构,降低α-螺旋比例(31.93%下降至23.56%),改变蛋白质的三级构象。溶解度曲线的差异表明,处理后SPI在分散体中的非共价相互作用发生了变化,在处理时间为30 s 时达到最大值为46.06%。冷等离子体处理后蛋白溶液的粒径分布范围逐渐减小,ζ-电位绝对值也发生了变化。SPI 的持水力(WHC)和持油力(FHC)都有显著提高。这可能是由于其ζ-电位值、巯基(-SH)含量以及表面疏水性(H0)的变化所致,并且SPI 的界面性能在处理时间为60 s 时最优异。通过形态学研究,我们证实冷等离子体处理的SPI 显示出均匀的聚集状态。综上所述,冷等离子体具有无溶剂工艺、处理时间短、效率高的优点,是未来蛋白质修饰的潜在候选技术,以增强其在食品工业中的应用。
