负载姜黄素的玉米醇溶蛋白-羧甲基壳聚糖纳米复合物的制备表征、体外消化及其抗氧化活性
2023-01-12李婷刘蕾黄敏任格瑞谢湖均董丽娟
李婷,刘蕾,黄敏,任格瑞,谢湖均,董丽娟
(浙江工商大学食品与生物工程学院,浙江杭州 310018)
姜黄素是一种从姜黄植物中分离的、具有二酮结构的天然多酚化合物,具有抗菌、抗氧化、抗病毒、抗癌等特性,在食品、药品和化妆品等领域具有广泛的应用[1-5]。然而,姜黄素难溶于水、易溶于有机溶剂,光稳定性和热稳定性较差,在酸碱条件下容易失活,使得姜黄素的生物利用率很低[6]。因此有必要开发合适的递送系统,改善姜黄素在体外和体内的稳定性,提高其在胃肠中的生物利用率。
多糖和蛋白是常见的天然高分子材料,利用蛋白质和多糖制备复合纳米颗粒被认为是制备食品级给药系统最有前景的方法之一[7-10]。Elbialy 等[11]利用酪蛋白、海藻酸盐及壳聚糖制备了可以封装具有抗癌性能的姜黄素的纳米颗粒,显著提高了姜黄素的包封率(75%),且具有比合成类抗癌药物更好的生物安全性。卵白蛋白和海藻酸钠构建的纳米复合物可以有效封装姜黄素,能提高姜黄素的水溶性和生物利用度[12]。负载姜黄素的海藻酸钠-明胶复合微纤维具有足够的抗机械性能和可降解性能,可作为伤口护理的潜在药物输送系统[13]。
玉米醇溶蛋白(Zein)是一种高度疏水的蛋白质,是疏水活性物质的理想载体。它不仅能够通过疏水作用与姜黄素(CUR)形成复合物,提高姜黄素的水溶性和生物利用度[14,15];而且制备Zein-CUR 纳米复合物不需要大量有机溶剂,有利于实现姜黄素的安全使用。但玉米醇溶蛋白纳米颗粒在水中的再分散性差,在某些环境应力下(pH 值接近等电点、高离子强度和高温等)容易聚集。采用静电沉积或反溶剂沉淀等方法将多糖包覆在玉米醇溶蛋白纳米颗粒上,可以有效解决这个问题[16-18]。羧甲基壳聚糖(CMCS)是壳聚糖的水溶性衍生物,具有良好的生物相容性,可以用来稳定玉米蛋白纳米颗粒。CMCS 包覆玉米醇溶蛋白的纳米粒子已被证明是一种有前途的递送系统,可改善疏水性营养素(如维生素D3)的释放并增强其稳定性[19],还可封装纳他霉素改善其水分散性并用于采后水果保鲜[20]。
本文以粒径、电位、包封率、负载量和多分散系数(PDI)为指标,优化了Zein/CMCS-CUR 纳米复合物的制备条件。利用傅里叶变换红外(FT-IR)、差示扫描量热法(DSC)和X 射线衍射(XRD)探讨了Zein、CMCS 和CUR 之间的相互作用,并通过透射电镜(TEM)和扫描电镜(SEM)研究了纳米复合物的微观形貌变化。通过体外模拟消化实验考查了纳米复合物在模拟胃肠道中的稳定性和缓释性,同时还分析了Zein/CMCS-CUR 纳米复合物的稳定性及抗氧化能力。通过以上研究,以期开发出用于功能食品和药物的姜黄素纳米输送系统。
1 材料与方法
1.1 材料与试剂
玉米醇溶蛋白(Zein),购自Sigma 公司;羧甲基壳聚糖(CMCS,脱乙酰度96%,取代度65%),购自南通兴成生物制品有限公司;姜黄素(CUR)、胃蛋白酶(3816 units/mg)、猪胰脏胰蛋白酶(283 units/mg)、Na2PO4·2H2O(AR,≥98%)、NaCl(AR,99.5%)和NaH2PO4(AR,99.0%),购自阿拉丁有限公司。
1.2 仪器与设备
MX-E 漩涡振荡器,北京大龙;UV-2600 紫外-可见分光光度计,日本Shimadzu 公司;Zetasizer Nano-ZS激光粒度仪,英国Malvern 公司;高度冷冻离心机,德国Eppendorf 公司;红外光谱仪,德国Thermo Scientific公司;差示扫描量热仪,法国Setaram 公司。
1.3 方法
1.3.1 Zein/CMCS-CUR 纳米复合物的制备
Zein(0.04 g)和不同质量的姜黄素(CUR)溶于20 mL 乙醇-水溶液(80:20,V/V)中,Zein 与CUR 的质量比分别为30:1、20:1、10:1 和5:1,分别在400 r/min磁力搅拌2 h,然后与CMCS(0.04 g)在600 r/min 混合2 h,用HCl 和NaOH 溶液将复合物溶液体系的pH值调节至6.5,搅拌2 h 后用旋转蒸发仪将乙醇蒸发(45 °C,8 min),制备得到包载不同浓度CUR 的Zein/CMCS-CUR 纳米复合物溶液。固态Zein/CMCS-CUR 纳米复合物采用冷冻干燥法制得。Zein 与CUR 的比例为30:1、20:1、10:1 和5:1 的样品分别表示为Zein/CMCS-CUR30:1、Zein/CMCS-CUR20:1、Zein/CMCS-CUR10:1、和Zein/CMCS-CUR5:1。
1.3.2 粒径与电位
实验使用Nano-ZS 型激光粒度仪检测样品的粒径和Zeta 电位。所测样品的粒子粒径和多分散性指数(PDI)是通过Stokes-Einstein 方程计算得到的,同时利用Smoluchowski 模型计算出所测样品的Zeta 电位。实验在室温下进行,测量前平衡120 s,每次测量扫描12 次,每个样品平行测量三次,最终取数据平均值。
1.3.3 包封率及负载量的测定
将适量的CUR溶解在无水乙醇中,漩涡震荡10 min后超声30 min 置于冰箱过夜,使其充分溶解,分别配制成不同浓度(2、4、6、8、10 mg/L)的CUR 溶液。利用紫外分光光度计在425 nm 处测得CUR 的吸收值,并绘制标准曲线。
采用超滤离心的方式测定纳米复合物中CUR 的包封率(Encapsulation Efficiency,EE)和负载量(Loading Capacity,LC),具体操作如下:吸取一定体积包载CUR的纳米复合物溶液于超滤离心管(滤膜的截留分子量为3 ku)中,5 000 r/min 下离心20 min,收集下管滤液,利用紫外分光光度计在425 nm 处进行测定。分别通过以下等式(1)和(2)计算EE和LC。

1.3.4 傅里叶变换红外光谱(FT-IR)测定
将新鲜制备的样品进行冷冻干燥后,与溴化钾按照1:100 的比例混合研磨,然后进行压片。设置扫描范围为4 000~400 cm-1,分辨率为4 cm-1,累计扫描32 次,环境温度为25 ℃。
1.3.5 差示扫描量热法(DSC)
称取约5 mg 的冻干后的样品放入铝坩埚进行分析,加热温度设置为20~200 ℃,升温速率设置为10 °C/min,氮气的流速设定为20 mL/min。
1.3.6 X 射线衍射(XRD)
将样品充分研磨至粉末后,放入X 射线衍射仪中。采用Cu-Ka 辐射,在20 ℃、40 kV 和50 mA 的条件下,以10 °/min 的频率在20~80 °的范围内进行扫描。
1.3.7 透射电镜(TEM)分析
样品用超纯水稀释适当倍数,混合均匀后取10 μL稀释液滴在带有碳支持膜的铜网上,静置自然干燥后,使用质量分数2%的磷钨酸溶液负染色4 min,多余的磷钨酸用超纯水进行冲洗,继续在室温下干燥。之后使用透射电子显微镜进行观察,加速电圧为200 kV。
1.3.8 扫描电镜(SEM)分析
将样品用双面粘合剂粘贴,安装在不锈钢上,并在观察之前使用溅射涂布机涂覆金层,用扫描电子显微镜(SEM)在15.0 kV 的加速电压下观察这些样品的微观表面形态。
1.3.9 抗氧化能力测定
(1)ABTS 自由基清除活性
ABTS 自由基是由ABTS(7.4 mmol/L)与过硫酸钾(2.6 mmol/L)以1:1(V/V)的比例混合在暗处反应16 h 生成的。用PBS 溶液(10 mmol/L,pH 值7.4)将上述混合物稀释至吸光度值为0.70±0.01(734 nm 处),获得ABTS 工作溶液。将样品(40 μL)与4 mL ABTS工作溶液混合均匀并反应5 min。AC为4 mL ABTS 与40 μL PBS 溶液混合5 min 后的吸光值,As为4 mL ABTS 与40 μL 样品反应5 min 的吸光值。使用公式(3)确定ABTS 自由基的清除能力(记为D,%)。

(2)DPPH 自由基清除能力测定
选择DPPH 自由基清除活性实验来评估含有不同浓度CUR 的样品的自由基清除能力。称量一定量的DPPH,并将其溶解在无水乙醇(0.1 mmol/L)中。将5 mL 样品与5 mL 新鲜制备的DPPH 乙醇溶液混合。在涡旋振荡器上震荡10 min 后,将其置于黑暗环境中30 min。通过紫外-可见光谱在538 nm 处测量样品吸光度(Asample),Ablank为5 mL 样品与等量乙醇混合后的吸光值,Acontrol为5 mL 的DPPH 与等量的磷酸盐缓冲液混合后的吸光值。使用公式(4)确定DPPH 自由基的清除能力(记为F,%)。

1.3.10 体外消化实验
根据Minekus 等[21]和Hur 等[22]的实验研究,建立了本复合体系的体外模拟消化实验,条件如下:
模拟胃液的配制:取0.5 mL 的浓盐酸定容至25 mL,在该盐酸溶液中加入1 g 胃蛋白酶和0.2 g NaCl后,用超纯水定容至100 mL 并超声10 min 制得模拟胃液(SGF)。
模拟肠液的配制:将0.68 g NaH2PO4和1 g 胰蛋白酶用超纯水溶解定容至100 mL,超声10 min 后低温离心10 min,制得模拟肠液(SIF)。
将样品按照1:1(V/V)的比例置于配好的模拟胃液中并调pH 值为2.0,然后于37 ℃、100 r/min 的恒温水浴摇床中进行模拟消化实验,分别在0、0.5、1、1.5 h后取样进行测定。按照1:1(V/V)的比例像上述消化液中加入模拟肠液,调pH 值为6.8,然后分别在0.5、1、1.5 和2 h 后取样进行测定。模拟胃肠道消化的总消化时间为3.5 h。累积CUR 释放量通过以下公式计算:
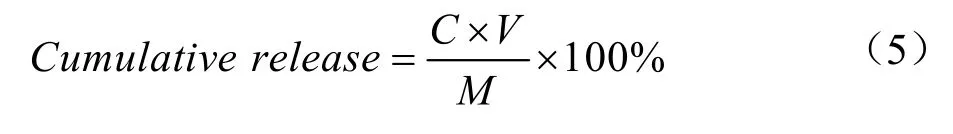
式中:
C——T时刻混合溶液释放的CUR 的浓度,mg/L;
V——T时刻混合溶液体积,mL;
M——复合物中所含CUR 的量,mg。
1.4 统计学分析
每个样品至少测定3 次,以平均值±标准偏差表示,用SPSS 18.0 软件进行显著性分析,p<0.05 认为有显著性差异。
2 结果与分析
2.1 CUR 浓度对纳米复合物的影响
Zein/CMCS 与CUR 的质量比对Zein/CMCS-CUR纳米复合物的粒径、Zeta 电位和多分散性指数(PDI)的影响如表1 所示。Zein/CMCS 纳米复合物的粒径为151.88 nm,Zein-CUR 复合物的粒径为1 198.41 nm,而 Zein/CMCS-CUR 纳米复合物的粒径在98.66~106.03 nm 范围内,明显小于二元纳米复合物的粒径。三元纳米复合物粒径较小可能是由于Zein、CMCS、CUR 之间的相互作用使Zein/CMCS-CUR 纳米复合物被紧密地结合在一起。随着CUR 的浓度的增加,三元纳米复合物(Zein/CMCS-CUR30:1)的粒径由98.66 nm增加到106.03 nm,这可能是因为体系中过多的CUR超出了Zein/CMCS 复合物对CUR 的负荷能力,导致了一部分不溶于水的CUR 附在纳米复合物表面,从而使纳米复合物的粒径增加[23]。但由于CUR 的分子量较小,纳米复合物的整体尺寸仅略有增加。另外,从表1可以看出,所有样品测得的PDI 值均较低,说明Zein/CMCS-CUR 纳米复合物在溶液中分布非常均匀。

表1 Zein、Zein-CMCS、Zein-CUR 和Zein/CMCS-CUR 复合物的粒径、电位、包封率和负载量Table 1 The particle size,Zeta potential,EE and LC of Zein,Zein-CMCS,Zein-CUR and Zein/CMCS-CUR nanoparticles
如表1 所示,Zein/CMCS 纳米复合物的Zeta 电位为-30.30 mV。当Zein/CMCS 与CUR 的比值从30:1 降低到5:1 时,其电势从-18.20 mV 变化到-24.70 mV,这是因为CUR 浓度的增加会加强CUR 与Zein 的疏水相互作用,使得包载在纳米复合物的姜黄素增多,从而引起电位的变化。由表1 可知含有不同浓度姜黄素的Zein/CMCS-CUR 纳米复合物包封率差异不明显,只有样品Zein/CMCS-CUR30:1的包封率低于90%。但从纳米复合物的稳定性考虑,选择粒径最小、包封率较高的Zein/CMCS-CUR10:1为最优比例。
2.2 红外分析
红外光谱中,3 200~3 400 cm-1的波段是由O-H 伸缩振动引起的。从图1 可以看出,Zein 的特征峰为3 413 cm-1,Zein/CMCS 和Zein/CMCS-CUR10:1的特征峰分别移到3 415 cm-1和3 423 cm-1,表明Zein、CMCS和CUR 之间发生了氢键相互作用[24]。Zein 的酰胺I 带和酰胺II 带分别位于1 654 cm-1和1 535 cm-1处,当形成Zein/CMCS 复合物后,特征峰分别移动到1 652 cm-1和1 546 cm-1处;形成Zein/CMCS-CUR10:1纳米复合物后,特征峰分别移动到1 653 cm-1和1 541 cm-1处,这表明Zein、CUR 和CMCS 之间发生了一定程度的静电相互作用[25];以前的研究结果表明Zein 与CUR 之间存在疏水相互作用,因此疏水作用是生成Zein/CMCS-CUR 纳米复合物的另外一个驱动力[26,27]。综上所述,氢键、静电和疏水相互作用是纳米复合物形成的驱动力。
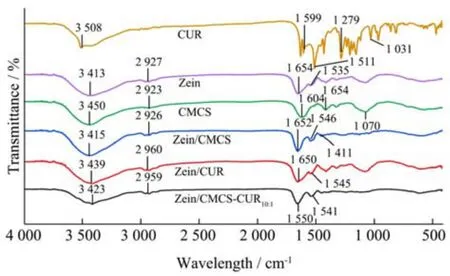
图1 Zein、CMCS、Zein-CUR 和Zein/CMCS-CUR 样品的红外光谱图Fig.1 Infrared spectra of Zein CMCS,Zein-CMCS,Zein-CUR,CMCS-CUR and Zein/CMCS-CUR samples
CUR 的特征吸收峰则分别位于3 508、1 031、1 279、1 511 和1 599 cm-1处,其中3 508 cm-1特征吸收峰由酚羟基的拉伸振动引起,但是在图中Zein/CMCS-CUR10:1纳米复合物中未观察到这些峰[28]。Zhang 等[29]也观察到了类似的结果,CUR 经Zein 和岩藻多糖包埋以后特征峰消失。这是因为CUR 与蛋白和多糖发生氢键或疏水作用后,限制了CUR 中化学键的拉伸和弯曲,导致纳米复合物中CUR 的大多数特征峰消失,表明CUR 已成功包封在纳米复合物中。
2.3 热稳定性分析
如图2 显示,Zein、CMCS 分别在95.2 ℃和122.9 ℃处出现特征吸热峰,是样品中结合水蒸发时的能量吸收所致。CUR 在179.2 ℃处出现一个明显的吸热峰,与Cai 等[30]获得的结果相似(184 ℃),这是由CUR晶体熔化引起的。对于Zein、CMCS 和CUR 的物理混合物,由于物理混合物中姜黄素含量仅为10 wt%,稀释效应导致吸热峰强度急剧降低,并向低温方向移动,因此三者的物理混合物吸热峰出现在129.3 ℃。而DSC 图显示了Zein-CUR、Zein/CMCS-CUR10:1纳米复合物的吸热峰对应的温度为72.7 ℃、101.8 ℃,在其曲线中未观察到CUR 的吸热峰,这意味着CUR 以非晶态封装在纳米复合物中[31],并不是单纯的物理混合。而CMCS的加入,使得 Zein-CUR 的吸热峰 72.7 ℃升至Zein/CMCS-CUR10:1时的101.8 ℃。Dai 等[32]的研究中也有类似的结果,加入卵磷脂后增强了纳米复合物中不同组分之间的疏水作用和静电相互作用,导致吸热峰温度高,从而增加了蛋白质的热稳定性。

图2 Zein,CMCS,CUR,Zein-CUR,Zein/CMCS-CUR10:1物理混合物和Zein/CMCS-CUR10:1样品的DSC 图Fig.2 DSC plots of Zein,CMCS,CUR,Zein-CUR,Zein/CMCS-CUR10:1 physical mixtures and Zein/CMCS-CUR10:1 samples
2.4 XRD 分析
XRD 可用于检测姜黄素的结晶状态。如图3 所示,Zein 的衍射角在10.1°和21.9°附近时,在XRD 图谱中可以观察到两个宽峰。CMCS 在21.4°附近也出现一个宽峰。这些结果表明Zein 和CMCS 以无定型形式存在,纯CUR 特征晶体吸收峰主要分布在2θ=7.7°、17.3°和25.1°处,显示出具有尖锐特征衍射峰的结晶状态,这一结果与Ren 等[33]的研究相一致。当用Zein 对CUR进行封装以后,Zein-CUR 显示出相对平坦的图像,没有明显的姜黄素衍射峰。而这种现象在Zein/CMCS-CUR10:1中表现更加明显,表明姜黄素从结晶状态转变为非晶态,并很好地封装在Zein/CMCS 纳米复合物中[34]。
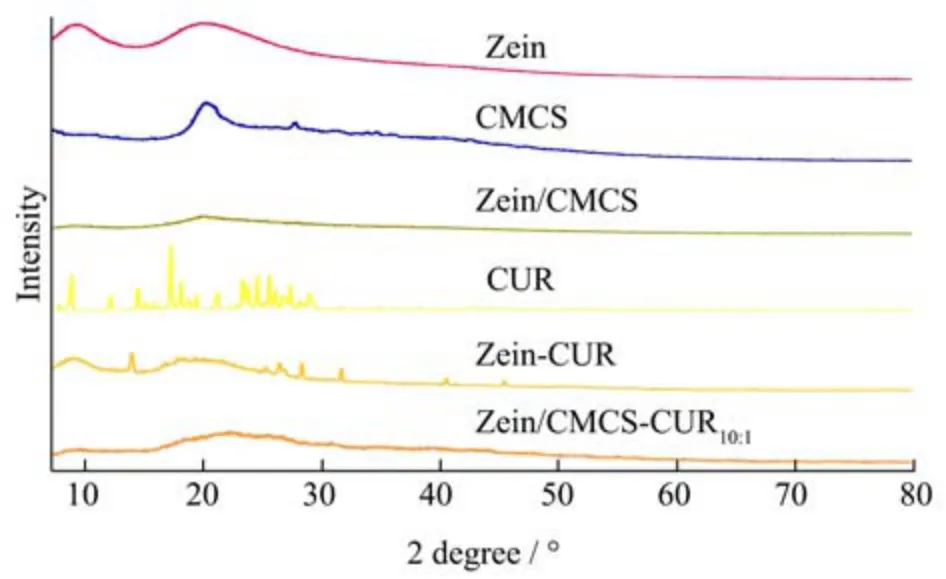
图3 Zein,CMCS,Zein/CMCS,CUR,Zein-CUR 和Zein/CMCS-CUR10:1样品的XRD 图Fig.3 XRD patterns of Zein,CMCS,Zein/CMCS,CUR,Zein-CUR and Zein/CMCS-CUR10:1 samples
2.5 微观形貌分析
图4 的透射电镜测量中可以观察到Zein 为光滑的球形,大概粒径在80~100 nm 左右。Zein/CMCS-CUR10:1纳米复合物呈球形,大多数颗粒的粒径范围为100~200 nm,这与粒径结果一致。粒径的增加可能是由于CMCS 的表面吸附导致的,Meng 等[34]利用玉米醇溶蛋白和羧甲基葡聚糖包载姜黄素的研究中也有类似的结果。从图像中可以观察到Zein-CUR 体系的分散性较差,存在粒子聚集的现象。粒子聚集可能是由蛋白自身的团聚和小分子物质的姜黄素附着在蛋白上造成的。而Zein/CMCS-CUR10:1呈现出均匀、稳定的状态,可能是CMCS 和Zein 之间存在的静电相互作用形成了稳定的复合物,从而阻止了蛋白的聚集。
通过扫描电镜对Zein、CMCS、Zein-CUR 和Zein/CMCS-CUR10:1的微观结构进行了表征,结果如图5 所示。Zein 呈球形,分布较均匀[34],CMCS 呈薄片状,而Zein-CUR 的图像显示其表面较为粗糙且多为聚集状态,可能是多余的CUR 通过疏水作用附着在Zein的表面,这从图4 的Zein-CUR 体系中也可以观察到。而加入CMCS 后,Zein/CMCS-CUR10:1纳米复合物表面变得光滑,这可能是因为CMCS 通过与蛋白作用,从而防止了蛋白聚集,形成了较均匀的纳米复合物,这与TEM 中的结论一致。此外,SEM 样品需要经过冷冻干燥处理,而TEM 样品经稀释后直接制样,制备方法存在不同,因而观察到的样品微观形貌也存在差异。

图4 Zein,CMCS,Zein-CUR 和Zein/CMCS-CUR 的TEM 图像Fig.4 TEM images of Zein,CMCS,Zein-CUR and Zein/CMCS-CUR10:1

图5 Zein,CMCS,Zein-CUR 和Zein/CMCS-CUR10:1的SEM 图像Fig.5 SEM images of Zein,CMCS,Zein-CUR and Zein/CMCS-CUR10:1
2.6 Zein/CMCS-CUR纳米复合物的抗氧化活性
图6 为不同处理条件下CUR 的抗氧化活性。如图所示,CUR、Zein-CUR、Zein/CMCS-CUR10:1的DPPH自由基清除能力分别为55.62%、65.50%和87.12%。Zein-CUR 和DPPH 自由基清除活性高于水中游离的CUR,说明疏水性蛋白Zein 能使CUR 更好地分散在水中。此外,Zein/CMCS-CUR10:1纳米复合物比Zein-CUR复合物表现出更强的自由基清除能力,可能是Zein/CMCS复合物使CUR的共轭二烯结构更容易电离出氢质子与DPPH 反应,从而增强了Zein/CMCS-CUR10:1纳米复合物的自由基清除能力[36]。Zein/CMCS-CUR10:1纳米复合物在ABTS 测定中也表现出最强的自由基清除能力(84.41%)。这些结果表明,在Zein/CMCS 中封装CUR 是增强其抗氧化能力的有效途径。
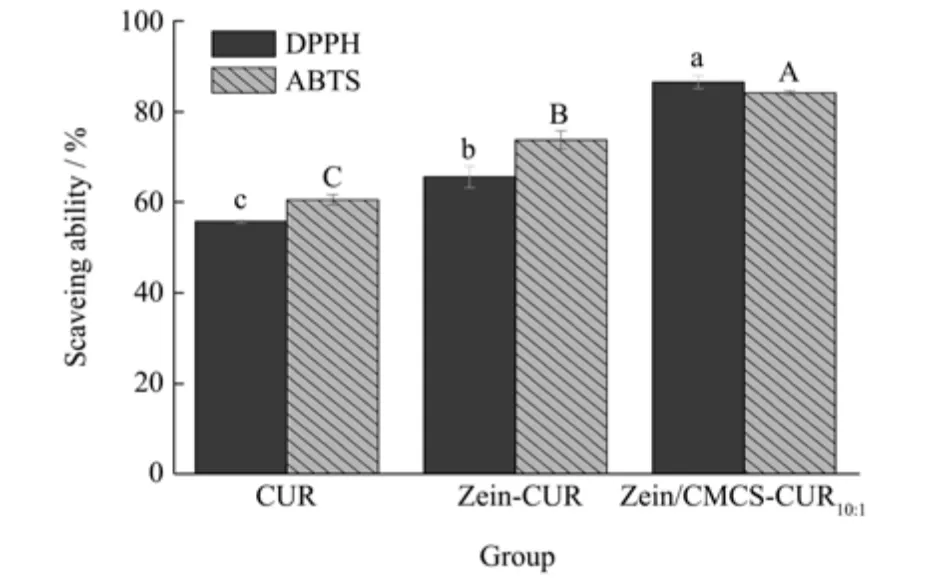
图6 CUR,CMCS-CUR,Zein-CUR 和Zein/CMCS-CUR10:1的抗氧化活性Fig.6 Antioxidant activity of CUR,CMCS-CUR,Zein-CUR and Zein/CMCS-CUR10:1
2.7 Zein/CMCS-CUR 纳米复合物的体外缓释
如图7 所示,将CUR 分别包载在Zein 和Zein/CMCS 中,经胃液消化1.5 h 后释放率分别为26.42%和11.17%,表明Zein/CMCS 复合物在胃液中对CUR 有保护作用,在连续消化3.5 h 后,Zein-CUR 和Zein/CMCS-CUR10:1中CUR 的释放率分别为50.41%和65.28%。实验结果表明Zein/CMCS 有保护CUR 的作用,有利于CUR 在肠道内的释放。胃蛋白酶通过剪切蛋白质中的疏水氨基酸的肽键使蛋白质结构发生改变,而蛋白质和多糖复合物可保护蛋白质的疏水氨基酸,减少蛋白质损坏。Zein 的疏水内核中包载了大部分的姜黄素,在模拟胃液下,Zein/CMCS-CUR10:1纳米复合物阻碍了胃蛋白酶对CUR 的消化,只有少量的CUR 被释放。当Zein/CMCS-CUR10:1纳米复合物转移到模拟肠液中时,环境的pH 的改变致使Zein 与CMCS的相互作用减弱,此时,胰蛋白酶将蛋白质结构破坏,CUR 得以释放。Huang 等[37]研究表明经溶菌酶-κ-卡拉胶复合物包埋的姜黄素在模拟胃液中的释放率为17.91%,在模拟肠液中前1.5 h 内可以快速释放出姜黄素,释放率达到62.56%。因此溶菌酶-κ-卡拉胶复合物可以为姜黄素在模拟胃液中提供屏障和保护作用,而在模拟肠液中快速释放出姜黄素。Xue 等[38]的研究结果表明玉米醇溶蛋白-鼠李糖复合体系在胃液中对CUR 有保护作用,当样品从胃液转移到肠液时,CUR能够快速释放可能是由于涂覆在纳米颗粒表面的鼠李糖的溶解,致使玉米醇溶-鼠李糖体系对CUR 的保护减弱而造成的。其他学者也有相似的报道[39,40]。

图7 CUR 在模拟胃液和肠液中的累计释放率Fig.7 Cumulative release rate of CUR in simulated gastric and intestinal fluids
3 结论
本文以玉米醇溶蛋白和羧甲基壳聚糖为壁材,制备了Zein/CMCS-CUR 纳米复合物,考察了Zein/CMCS 与CUR 的质量比对粒径和包封率的影响,分析了CUR 在模拟胃肠道消化的释放行为。当Zein/CMCS 与CUR 的比例为10:1 时制备的纳米复合物粒径较小(95.37 nm),其zeta 电位为-21.70 mV,包封率和负载量分别为96.63%和4.55%。微观形貌观察发现Zein-CUR 体系呈现表面粗糙且多为聚集的状态,而Zein/CMCS-CUR 纳米复合物呈光滑的球形,且分布均匀。进一步研究Zein、CMCS、CUR 三者之间的相互作用,发现静电相互作用和氢键是组装该纳米复合物的主要驱动力。与游离的姜黄素相比,纳米复合物包载的姜黄素具有更强的DPPH 自由基清除能力和ABTS 自由基清除能力。纳米复合物的体外缓释实验也显示了Zein/CMCS有保护CUR 的作用,有利于CUR 在肠道内的释放。基于以上实验结果,本研究制备的负载姜黄素的纳米复合物具有应用于功能性食品和药物等领域的潜力。
