发际线切口内镜辅助下良性腮腺肿瘤切除术对术后免疫与应激反应的影响
2023-01-10王洁琪钟江龙庄沛林廖隽琨周斌范松
王洁琪 钟江龙 庄沛林 廖隽琨 周斌 范松
中山大学孙逸仙纪念医院口腔科(广州 510120)
近年来,内镜手术逐渐广泛应用,成为许多外科手术的标准和首选技术[1-9]。借助内镜放大的手术视野和良好的照明,外科医生可更精细的辨别和分离解剖结构[10]。腹腔镜辅助下直肠切除[6,8]、胃切除[4]、结肠切除[11]、腹疝修补[2],神经外科[12]、头颈区域的内镜辅助手术[1,3,13]等被认为优于传统开放手术,因为其降低了解剖结构损伤的风险,减少术中出血,减轻术后疼痛,减少炎症反应和术后应激,且获得更好的美观效果。
传统的腮腺良性肿瘤切除手术采用改良的布莱尔切口(s型耳前下颌下切口),术后瘢痕明显,影响美观[14],而内镜辅助下腮腺肿瘤切除术术后疤痕短更隐蔽,术后美观效果更好,日益受临床医生青睐[7,13,15]。
创伤会导致内分泌和代谢功能的改变,引发应激反应,内镜手术一般被认为可以减少手术创伤[16]。目前探讨比较内镜手术与常规开放入路术后的炎症反应和免疫功能的研究众多[10-11,16-20],但关于内镜辅助下腮腺肿瘤手术对免疫反应及手术应激反应的研究鲜见,腮腺区域的内镜手术仍有争议。因此,本研究的目的是评估内镜辅助下采用发际线切口的良性腮腺肿瘤切除术对术后免疫反应和手术应激的影响。
1 资料与方法
1.1 一般资料 纳入中山大学孙逸仙纪念医院口腔颌面外科收治的47例腮腺良性肿瘤患者,随机分为内镜组和常规开放性手术组。内镜组纳入25例患者,其中男14例,女11例,平均年龄51.8岁;常规组纳入22例患者,其中男13例,女9例,平均年龄54.3岁。所有病例均经超声引导下穿刺活检病理诊断为腮腺良性肿瘤。纳入标准:位于腮腺浅叶的良性肿瘤,无放疗史,既往无面瘫;排除标准:术前超声引导下针吸活检结果为可疑恶性腮腺肿瘤、涎腺炎、复发肿瘤。所有患者都充分了解这两种方法的优缺点,并同意手术。该手术经过医院伦理委员会的批准。所有手术均由同一名外科医生完成。
1.2 手术方法 手术均在全身麻醉下进行。患者取仰卧位,头部转向健侧。内镜组采用了发际线切口(图1)。术前MRI或CT扫描评估肿瘤体积,切口长度大于肿瘤的最大直径约1 mm。在发际线后1 cm处的耳下头皮切开,长4.3~7.0 mm,分离皮瓣至暴露胸锁乳突肌,然后在内镜(直径4 mm,长度30 cm;Stryker Endoscopy,美国)下解剖暴露腮腺浅层。为了给肿瘤解剖提供足够的可视化空间,整个皮瓣被分离到超过肿瘤大小的程度。手术助手手持牵引器牵拉周围软组织以维持手术空间,术者应用30°内镜解剖分离肿瘤,内镜可提供良好的放大视野和照明,有助于保护肿瘤包膜的完整性和面神经分支的解剖。肿瘤切除后送冷冻切片活检确认肿瘤均为良性。最后,冲洗术区,彻底控制出血,然后放置引流装置(图2)。术后予以口服颠茄片,减少腮腺唾液分泌。术后7 d拆除缝线。常规组采用“S”型耳前和下颌下切口进行开放式手术切除腮腺良性肿瘤。内镜组及常规组手术入路及切口范围如图3所示。

图1 内镜入路手术切口设计和建立手术操作空间范围Fig.1 The incision design and the potential establishment of a working space

图2 缝合后放置引流装置Fig.2 The incision was sutured with a closed suction drain

图3 通过发际线切口(左)和传统的“S”形耳前和下颌下切口(右)分离腮腺良性肿瘤示意图Fig.3 Schematic illustration of the dissection of benign parotid tumors through a hairline incision(left)and a conventional“S”-shaped preauricular and submandibular incision(right)
1.3 评价指标
1.3.1 围手术期及手术临床预后 记录及评价两组患者围手术期及术后临床结果,包括肿瘤直径、切口长度、手术时间、术中出血量、术后引流量、引流时间、术后并发症、病理类型、随访时间、肿瘤复发情况。术后每24小时测量引流量,引流量<20 mL/24 h后拔除引流管。采用视觉模拟评分(VAS)[1]对术后疼痛进行评分,以及评估患者对术后切口外观的满意度。
1.3.2 术后免疫反应及手术应激反应 在4个不同的时间点采集外周血和血清。第一个样本(T0)在麻醉后和手术开始前采集(基线)。第1组标本(T1)、第2组标本(T2)、第3组标本(T3)分别于术后12、24、72 h采集。外周血通过4℃3 000 r/min离心10 min获得血清,并检测IL-6、IL-8、IL-10、IL-1β、TNF-α、C反应蛋白(CRP)、皮质醇、促肾上腺皮质激素(ACTH)和生长激素。
1.4 统计学方法 应用SPSS 20.0软件进行统计分析。各项参数作基本统计量描述,符合正态分布的计量资料以()表示,计数资料以例(%)表示,两组间采用独立样本t检验,计数资料两组间采用χ2检验。评价指标组间比较采用χ2检验和Mann-WhitneyU检验。P<0.05为差异有统计学意义。
2 结果
2.1 基线资料比较 47例腮腺良性肿瘤患者中,25例接受内镜辅助下发际线切口肿瘤切除术,22例接受常规开放式手术。患者的基线资料见表1。内镜组与常规组在年龄、性别、体质量指数(BMI)、美国麻醉学协会(ASA)评分、肿瘤直径、病理类型、随访时间等差异无统计学意义(P>0.05),两组具有可比性。
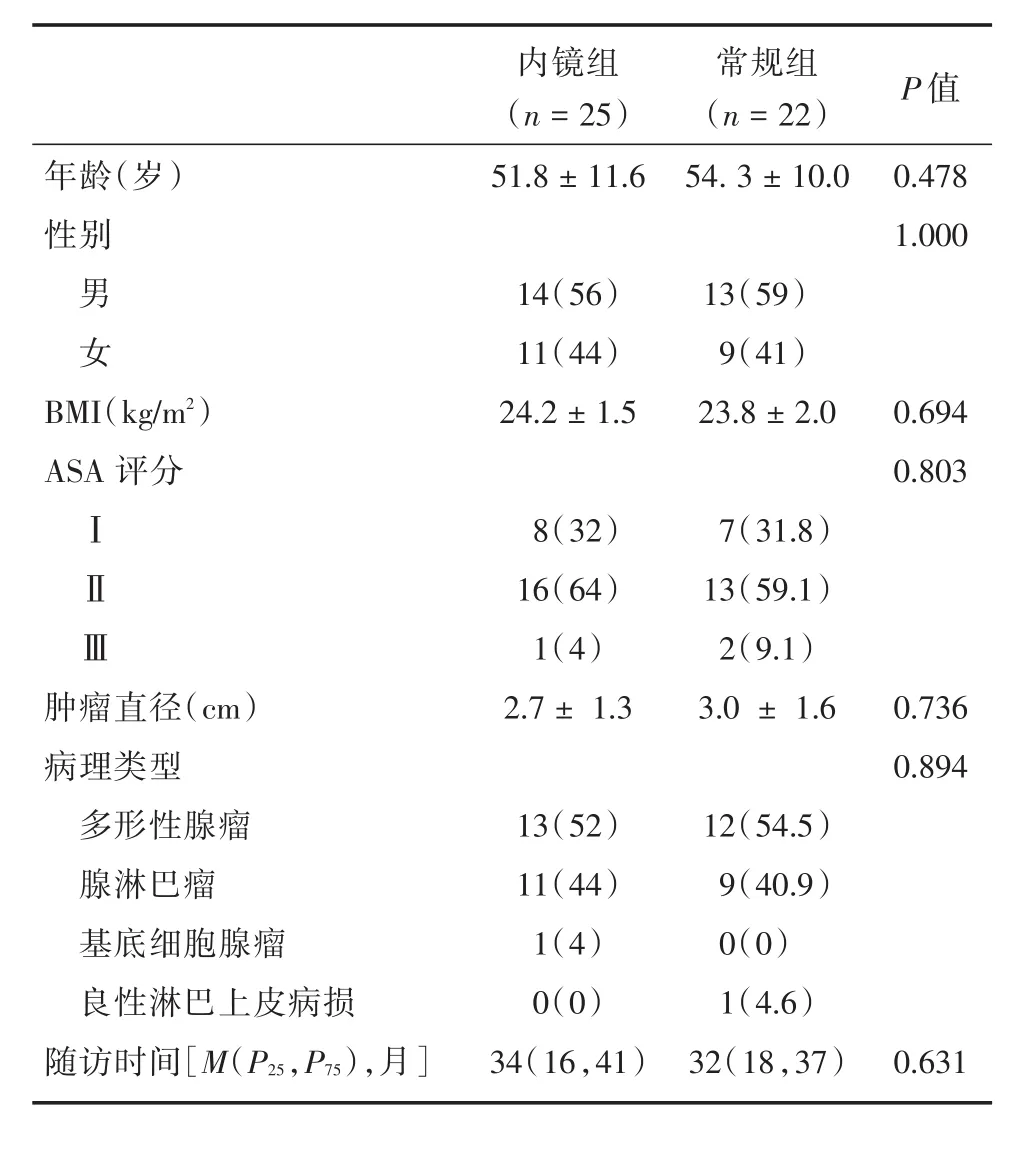
表1 患者基线资料Tab.1 Patients'baseline information 例(%)
2.2 手术相关临床结果 围手术期和术后的临床结果见表2。两组的切口长度,术中出血量,术后引流量,术后疼痛评分及对美观效果满意度差异有统计学意义(P<0.05)。内镜组切口长度显著短于常规组[(5.3 ± 0.6)cmvs.(9.8 ± 1.5)cm,P< 0.001],内镜组术中出血量显著低于常规组[(48.9±10.4)mLvs.(82.8± 29.3)mL,P=0.004],内镜组患者对术后美容效果的满意度高于常规组(P=0.027)。然而,内镜组术后引流量显著高于常规组[(69.5±13.1)mLvs.(50.3 ± 9.7)mL,P=0.024],且内镜组术后疼痛评分明显高于常规组(P=0.039)。中位数随访时间内镜组34个月,常规组32个月,均未见肿瘤复发。
表2 围手术期及术后治疗结果Tab.2 intra-operative and postoperative therapeutic outcomes ±s
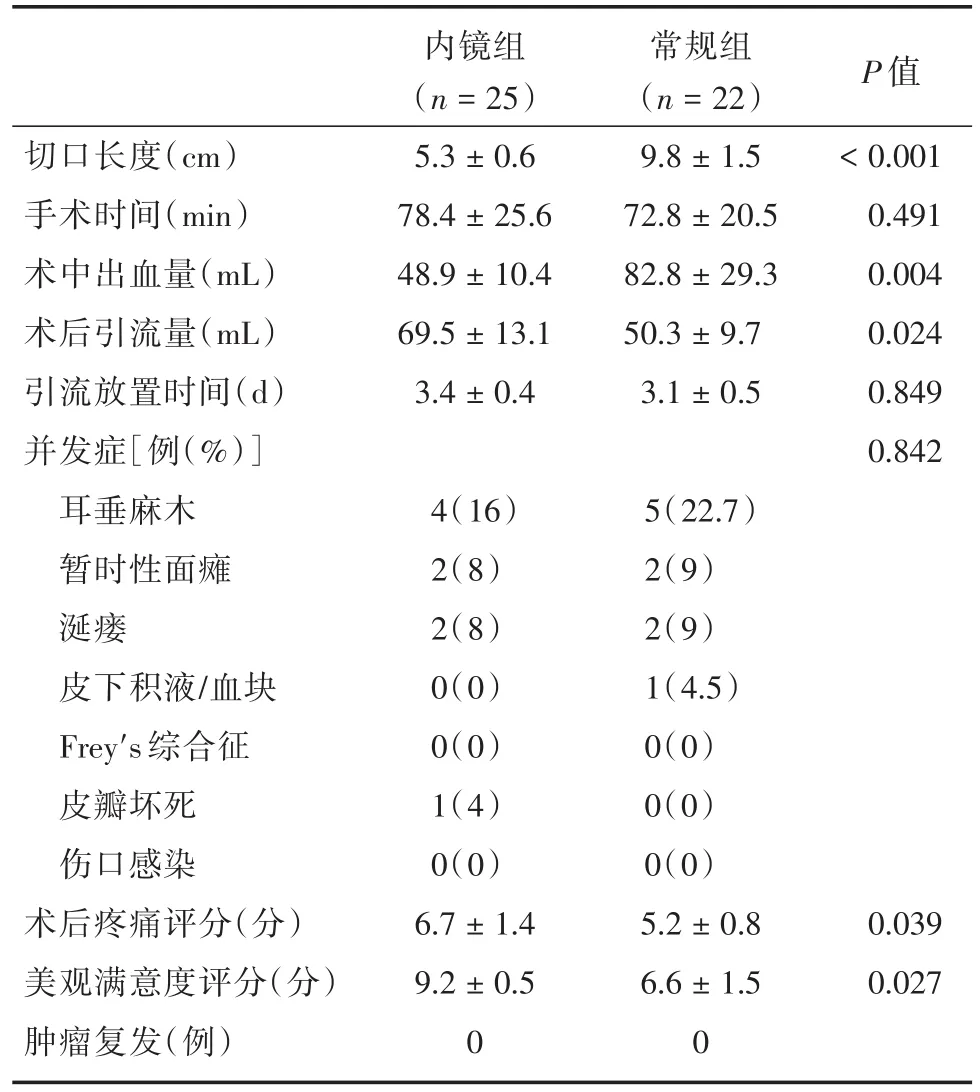
表2 围手术期及术后治疗结果Tab.2 intra-operative and postoperative therapeutic outcomes ±s
切口长度(cm)手术时间(min)术中出血量(mL)术后引流量(mL)引流放置时间(d)并发症[例(%)]耳垂麻木暂时性面瘫涎瘘皮下积液/血块Frey's综合征皮瓣坏死伤口感染术后疼痛评分(分)美观满意度评分(分)肿瘤复发(例)内镜组(n=25)5.3±0.6 78.4±25.6 48.9±10.4 69.5±13.1 3.4±0.4常规组(n=22)9.8±1.5 72.8±20.5 82.8±29.3 50.3±9.7 3.1±0.5 P值<0.001 0.491 0.004 0.024 0.849 0.842 4(16)2(8)2(8)0(0)0(0)1(4)0(0)6.7±1.4 9.2±0.5 0 5(22.7)2(9)2(9)1(4.5)0(0)0(0)0(0)5.2±0.8 6.6±1.5 0 0.039 0.027
2.3 术后免疫反应 根据研究方法设计的采集血液样本的总次数和每个患者在每个时间点均测量9个细胞因子和激素,47例患者共应产生1 692个值。其中有12/1 692(0.7%)的样本数值缺失,缺失主要原因是时间延迟和样品制备不当。两组在四个时间点的细胞因子的平均值和范围如表3所示。

表3 两组患者术后免疫反应及手术应激反应Tab.3 Postoperative immune response and surgical stress M(P25,P75)
术后T1、T2、T3时间点内镜组IL-6、CRP浓度明显高于常规组(P<0.05),而早期(T1、T2)内镜组IL-10浓度高于常规组(P<0.05),T3时间点两组差异无统计学意义(P>0.05)。IL-8,IL-1β和TNF-α两组间在所有时间点差异均无统计学意义(P>0.05)。
2.4 手术应激反应 内镜组皮质醇在T1和T2时明显高于常规组(P<0.05),T3时两组差异无统计学意义(P>0.05)。内镜组与常规组之间ACTH和生长激素水平差异无统计学意义(P>0.05)。
3 讨论
手术创伤会影响术后免疫反应的程度和持续时间,手术应激和免疫损伤可导致全身炎症反应,如发热、疼痛、感染和血栓等并发症,甚至恶性肿瘤的转移[7,10,21]。手术创伤同时也激活几乎所有免疫系统成分[21],激素如促肾上腺皮质激素(ACTH)和皮质醇,细胞因子如IL-1β、IL-2、IL-6、IL-8、IL-12和肿瘤坏死因子-α(TNF-α)等在创伤后炎症反应的激活和维持中起着重要作用[21-22]。目前关于内镜手术术后手术应激反应和免疫反应的研究众多,内镜应用于腹部手术[11,16,18]、口腔鳞癌的选择性颈淋巴清扫术[10]均能有效抑制术后炎症因子的释放,减轻手术创伤和应激,手术效果兼具美观与微创。目前关于良性腮腺肿瘤内镜手术后的免疫反应和手术应激的报道较少。本研究比较了内镜辅助下发际线切口良性腮腺肿瘤切除术与常规开放手术对临床结果、免疫反应和手术应激的影响。
本研究结果提示,内镜组患者因瘢痕更短、更隐蔽,对美容效果的满意度明显高于常规组。头皮发际线入路切除良性腮腺肿瘤具有良好美容效果、较低的面瘫Frey's综合征发生率以及保留腮腺分泌功能等优点[23]。发际线切口被头发和耳廓所隐藏,即使是在有瘢痕增生情况下也几乎看不见。但本研究结果显示内镜组术后引流量更大,疼痛评分高于常规组,术后IL-6、IL-10、CRP和皮质醇浓度也明显高于常规组,这些结果提示内镜下腮腺手术可能创伤更大,引发更强的炎症反应。内镜手术更适用于存在可手术操作天然腔隙的区域。然而,腮腺区域几乎不存在任何天然腔隙,通过发际线入路进行内镜手术的首要步骤是通过头皮入路将皮瓣从腮腺浅表面分离,在腮腺后部和胸锁乳突肌之间进行了剥离,从而形成手术工作空间。此外,在耳后头皮作发际线切口,从切口到肿瘤剥离的距离较长,需通过解剖、切除和牵拉更多的软组织以获得足够的手术空间,可能会对软组织、血管和神经系统产生更多的刺激。较大的手术切口和组织分离可能是内镜组术后疼痛和引流明显增加的原因。在本研究中,内镜组术中出血量小于常规组,这可能与内镜手术切口较短以及超声刀的应用有直接关系。
手术创伤可增强促炎症反应[21]。在手术创伤和免疫损伤下,全身炎症反应被激活,释放促炎细胞因子和抗炎细胞因子。白细胞介素-6(IL-6)由单核细胞、巨噬细胞和内皮细胞在手术创伤和应激条件诱导下释放,是目前被研究最多的具有促炎和抗炎能力的细胞因子[11,16,21]。TNF-α、IL-1β、IL-6和IL-8是参与创伤和手术应激反应的主要促炎细胞因子,IL-10是一种抗炎白细胞介素,可减少促炎介质的合成[22]。CRP是一种非特异性急性期蛋白,由肝脏在创伤和感染后产生[11]。皮质醇、ACTH和生长激素与手术应激相关。本研究结果提示,在内镜手术和开放式手术后皆有促炎细胞因子和抗炎细胞因子释放,但内镜组血清IL-6和CRP浓度在术后所有时间点均较高。血清IL-6和CRP的结果在不同的研究中有所不同。腹腔镜和开放式胰十二指肠切除术中CRP水平相当,而腹腔镜手术后IL-6水平较高[20]。内镜下全直肠系膜切除术[16],结肠癌手术[11],口腔鳞癌选择性颈部淋巴清扫术[10]术后IL-6和CRP的血清浓度低于开放手术,这与我们的结果不一致。IL-6被认为是炎症和术后并发症严重程度的指标[19-21],CRP与组织损伤程度相关[10,24]。此外,在内镜手术后 12 h和24 h检测到较高水平的IL-10,这种差异在术后72 h内逐渐缩小。本研究中血清IL-6、IL-10和CRP水平的比较可能表明,采用发际线切口的内镜辅助下腮腺良性肿瘤切除术可能诱发更多的手术应激反应和炎症反应。
炎症细胞因子和下丘脑-垂体-肾上腺轴之间复杂的相互作用仍然不是很明确,这些系统的同时激活可使机体在手术创伤后恢复内稳态[10,25]。在本研究中,内镜组的皮质醇水平在术后12 h或24 h明显高于开放组,在术后72 h出现与常规组相似的变化。皮质醇和生长激素由垂体对外界刺激的反应而分泌[9],这一结果提示内镜手术可能比常规开放手术术后有更波动的手术应激反应。此外,ACTH通常与大手术后的高皮质醇水平相关,但在本研究中,内镜组和常规组ACTH和生长激素水平没有显著差异。这与VEENHOF[16]等研究结果相似,认为术后护理方式会引起ACTH不同的波动,而非手术术式。
本研究存在一定的局限性,样本量和随访时间有限,可能导致结果存在一定的偏差,在进一步研究应纳入更大的样本量和更长的随访期。
综上所述,内镜辅助下发际线切口良性腮腺肿瘤切除术比开放式手术获得更好的美容效果,但手术创伤更大,引起更剧烈的术后免疫反应和手术应激反应。
