关注突变 巧用交点 促进融合
2023-01-07王文佳
王 明 王文佳
(重庆市育才中学校)
“宏观”“微观”“符号”“图像”是化学的四重表征.各类考题中的图像很多,现实教学中我们无法面面俱到.学生化学思维或解题能力的提高通常遵循图1所示的过程.

图1
提升图像类问题的解题能力也遵循上面的过程.经过高考第一轮复习,学生已经进行了大量必要的练习.为了面对后续考试中层出不穷的新问题,学生还欠缺什么呢? 化学教师又该如何帮助他们呢? 当然是引导学生归纳出一系列问题的思维(解题)模型.此时需要教师找到破解图像的关键点,找到“举一反三”中的“一”,建立简单易行的思维模型,以便学生在考试时迁移运用.在酸碱中和滴定的相关图像中,笔者做了初步尝试,现简单论述如下,希望能够起到抛砖引玉的效果.
1 滴定过程溶液pH 变化
1.1 模型建构
酸碱中和滴定过程中,微观反应剧烈但是宏观现象并不明显,如果不借助仪器无法直接观察pH 的变化情况.为了破解这个难题,我们先进行下面例题的理论计算,然后再做数字化实验证实(没有条件的地方也可以不做演示实验).
例1 常温下向10 mL0.1 mol·L-1的NaOH溶液中,逐滴加入0.1mol·L-1的盐酸溶液.回答下列问题:
(1)当所加盐酸体积为10 mL 时,溶液的pH 为多少?
(2)当加入的盐酸体积为9.98 mL(少加半滴)时,溶液的pH 为多少?
(3)当所加盐酸体积为10.02mL(多加半滴)时,溶液的pH 为多少?
(4)绘制出NaOH 溶液中滴入盐酸溶液的pH 变化示意图.

(4)见图2.
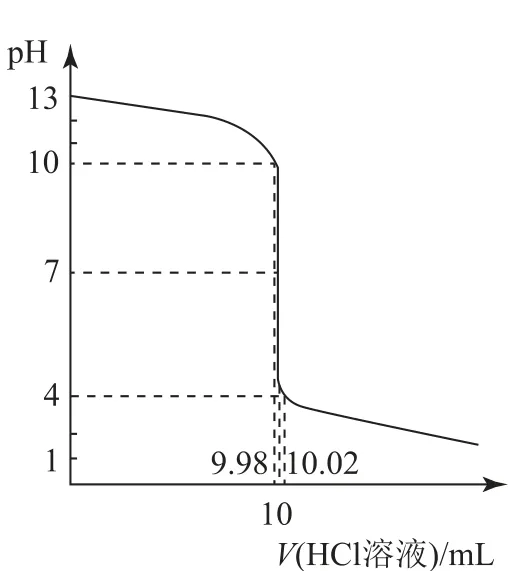
图2
若将题目改为向10mL0.1mol·L-1的盐酸溶液中,逐滴加入0.1 mol·L-1的NaOH 溶液,按照上述的分析过程,绘制出盐酸溶液中滴入NaOH 溶液的pH 变化示意图.


图3
学生经过理论计算,绘制出了pH 变化示意图,最后还通过演示实验,让学生真正地看到了“靠近滴定终点时溶液pH 的突变”.需要注意的是:反应一步完成则有一个突变,两步完成则有两个突变(教学中,可使用数字化仪器以标准盐酸滴定碳酸钠溶液的实验加以证实),依此类推.有上面的知识铺垫后,对此类图像的相关试题,可以建立图4所示思维模型.

图4
1.2 创新应用

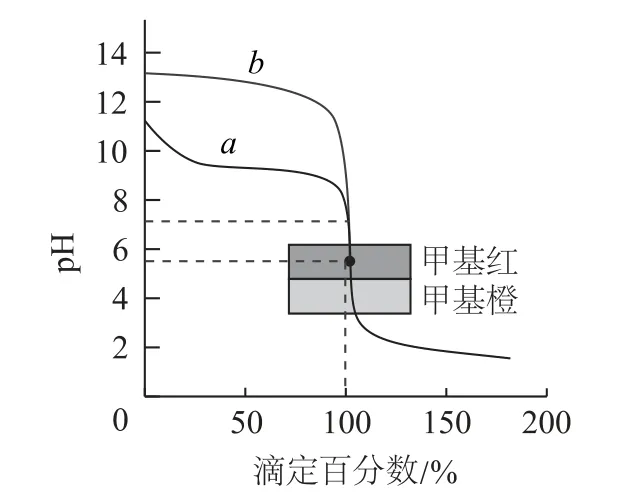
图5
A.曲线a代表标准盐酸溶液滴定氨水的pH变化
B.滴定氨水的过程中可能出现c(NH3·H2O)+c(OH-)=c(H+)
C.从滴定曲线可以判断,使用甲基红作指示剂准确性更好
D.滴定氨水过程中,当横坐标为150%时,溶液中c(Cl-)>c(H+)>c(NH+4)>c(OH-)
分析 盐酸与氨水和氢氧化钠反应均是一步完成,所以曲线a和b都只有一个突变.氨水和NaOH溶液浓度相等,所以起始时氨水溶液的pH 更小,突变范围变窄(偏碱性部分消失),对应曲线a.从图像可以看出,滴定终点即横坐标100对应的位置,此时盐酸和氢氧化钠混合溶液的pH=7,盐酸和氨水混合溶液的pH<7,更靠近甲基红的变色范围,所以用甲基红作指示剂准确性更好.由以上分析可以得出,选项A、C说法正确.当横坐标为100时,溶质全为NH4Cl,此时按照质子守恒(水电离出的氢离子和氢氧根离子总量相等)容易得出c(NH3·H2O)+c(OH-)=c(H+),选项B 说法正确.当横坐标为150时,加入的盐酸体积为30mL,反应后为n(NH4Cl)∶n(HCl)=2∶1,此时NH+4的水解程度很小,容易得出c(NH+4)>c(H+),选项D 说法错误,答案为D.
例3 (2022年1月浙江卷)某同学在2个相同的特制容器中分别加入20mL0.4mol·L-1Na2CO3溶液和40mL0.2mol·L-1NaHCO3溶液,再分别用0.4mol·L-1盐酸滴定,利用pH 计和压力传感器检测,得到如图6所示曲线.下列说法正确的是( ).

图6
A.图中甲、丁线表示向NaHCO3溶液中滴加盐酸,乙、丙线表示向Na2CO3溶液中滴加盐酸
B.当滴加盐酸的体积为V1mL 时(a点、b点),所发生的反应用离子方程式表示为HCO-3+H+=H2O+CO2↑
C.根据pH-V(HCl)图,滴定分析时,c点可用酚酞、d点可用甲基橙作指示剂指示滴定终点
D.Na2CO3和 NaHCO3溶 液 中 均 满 足:c(H2CO3)-c(CO2-3)=c(OH-)-c(H+)
分析 利用图像中的突变,Na2CO3与盐酸的反应 过 程 为 Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+H2O+CO2↑,图像中应有两次pH 的较大变化,故甲、丁代表Na2CO3与盐酸的反应情况;乙、丙代表NaHCO3和盐酸的反应情况,故选项A 错误.a、b点均表示Na2CO3和盐酸的反应情况,从图中的压力曲线能看出,仍然处于第一阶段,反应为CO2-3+H+=HCO-3,故选项B错误.突变点c的pH 为8左右,处于酚酞的变色范围,可以选用酚酞作为指示剂,突变点d的pH 为4左右,处于甲基橙的变色范围,可以选用甲基橙作为指示剂,故选项C正确.利用溶液中的电荷守恒和质量守恒能得出只有NaHCO3溶 液 中 才 有c(H2CO3)-c(CO2-3)=c(OH-)-c(H+),故选项D 错误.综上,本题正确答案为C.
2 分布系数随pH 变化曲线
分析化学中将分布分数(或分布系数)定义为“溶液中某酸碱组分的平衡浓度占其总浓度的分数,以δ表示”.分布分数决定于该酸碱物质的性质和溶液中H+的浓度,而与其总浓度无关.分布分数能定量说明溶液中的各种酸碱组分的分布情况,在分析化学中极其重要.
2.1 模型建构
分布分数的概念在高中化学中并不要求掌握,考题中也通常以信息形式直接提供给考生.从各类试题分析来看,高中阶段只需要掌握分布分数的简单变化趋势和特殊点即可.


图7

由图像知,当pH=7.5时,c(ClO-)=c(HClO),Ka=c(H+)=10-7.5.
解决此题的关键在于“根据变化趋势找到各离子的对应曲线,确定两条曲线的交点,代入表达式求出各级平衡常数”,据此可以总结出图8 所示的思维模型.

图8
一元弱酸HX 有两种相关微粒,即HX 和X-,分布曲线图中通常只有1个交点[δ(HX)=δ(X-)];二元弱酸H2Y 有3种相关微粒,即H2Y、Y-和Y2-,理论上来说应有3 个交点[δ(H2Y)=δ(HY-)、δ(HY-)=δ(Y2-)和δ(H2Y)=δ(Y2-)].
2.2 创新应用


图9
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H2A)
分析 利用前面的思维模型,图中已经标明了各离子的曲线,利用交点(pH=1.2和pH=4.2),代入电离常数表达式可以直接求得


3 图像的融合
对于单独的“滴定过程pH 变化曲线”和“分布分数随pH 变化曲线”类试题,熟练掌握上述思维模型后就变得容易解决.随着研究的不断深入和命题技术的不断发展,几种曲线的融合逐渐增多.
3.1 共用横坐标


图10
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A 溶液的浓度为0.2000mol·L-1
C.HA-的电离常数Ka2=1.0×10-2
D.滴 定 终 点 时,溶 液 中c(Na+)<2c(A2-)+c(HA-)
分析 题给图像的横坐标相同,纵坐标并不一样,①②对应左边的δ,③对应右边的pH.①②为分布系数图像,③为滴定过程pH 变化图像.
H2A 可能有如下3种电离方式.
第1种:H2A=2H++A2-.
第2种:H2A⇌H++HA-、HA-⇌H++A2-.
第3种:H2A=H++HA-、HA-⇌H++A2-.
曲线③只有1个突变,说明反应一步完成;①和②只有1个交点,以上两点都说明H2A 按照第3种方式电离.溶液中只有H+、HA-和A2-,没有H2A分子存在,故选项A 错误.从③的突变得出,反应终点加入NaOH 溶液的体积为40 mL,此时溶液溶质为Na2A,则H2A 的起始浓度为0.1mol·L-1,故选项B错误(H2A 溶液起始pH=1,更进一步印证H2A 是按照第3种方式电离).滴定终点时溶液为Na2A,显碱性,即c(OH-)>c(H+);再综合电荷守恒c(Na+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),容易得出c(Na+)>2c(A2-)+c(HA-),故选项D错误.
利用前面的思维模型,求算Ka2最好找到分布系数中δ(A2-)=δ(HA-)的交点,但交点对应的pH 图像中并没有表述出来(不能对应右边纵坐标的pH).故只能用起始点(氢氧化钠溶液体积为0),即δ(A2-)=0.1、δ(HA-)=0.9,曲线③起始pH=1,代入Ka2表达式


图11
A.As(OH)3的lgKa1为-9.1
B.[As(OH)2T]-的酸性比As(OH)3的强
C.pH =3.1 时,As(OH)3的 浓 度 比[As(OH)2T]-的高
D.pH =7.0 时,溶 液 中 浓 度 最 高 的 物 种 为As(OH)3
分析 题给图像可以拆分成图12所示图像.

图12
本题图像中的纵坐标,类似于分布系数(分布系数与离子本身浓度成正比例关系,因此纵坐标换为离子浓度变化趋势应该与前述的图像大体一致).考题中的图像是将2个图像融合在一起,值得注意的是,图像中只标出了部分离子的浓度随pH 变化的曲线,有些离子(图像中含T 离子浓度最高约为1.6×10-6mol·L-1,与总T 浓度1.0×10-3mol·L-1差距较大)甚至是主要离子浓度,并没有表示出来.
根据反应As(OH)3⇌[As(OH)2O]-+H+,利用图甲中的交点,当pH=9.1时,则有

[As(OH)2T]-的酸性比As(OH)3的强,故选项B说法正确.
从图中可以看出,当pH=3.1时,由于As(OH)3对应的左坐标数量级为10-3,[As(OH)2T]-对应右坐标数量级为10-6,所以此时As(OH)3的浓度比[As(OH)2T]-的高,故选项C说法正确.
含T 离子主要分布图像如图13 所示.当pH=7.0时,处于图13右侧,此时溶液中几乎全是T2-,因此,混合溶液中浓度最高的应是T2-,故选项D 说法错误.

图13
综上,本题应该选D.
3.2 共用纵坐标
例8 (2021年辽宁卷)用0.1000 mol·L-1盐酸滴定20.00 mL Na2A 溶液,溶液中H2A、HA-、A2-的分布分数δ随pH 变化曲线及滴定曲线如图14所示.下列说法正确的是( ).(如A2-分布分数:
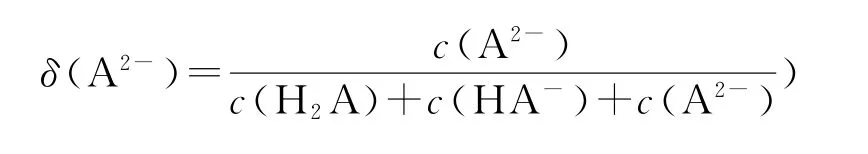

图14
A.H2A 的Ka1为10-10.25
B.c点:c(HA-)>c(A2-)>c(H2A)
C.第一次突变,可选酚酞作指示剂
D.c(Na2A)=0.2000mol·L-1
分析 图像左边为分布系数图像,右边为滴定过程图像,两者共用纵坐标.每种离子的对应关系如图15所示.

图15
b为第一反应终点,反应为Na2A+HCl=NaCl+NaHA,溶液中溶质为NaHA,δ(HA-)达最大值;e为第二反应终点,反应为NaHA+HCl=NaCl+H2A,δ(H2A)达最大值,溶液中几乎全为H2A 分子,求得c(Na2A)=0.1000mol·L-1,所以选项D 错误;c点对应的分布系数可以得出c(A2-)<c(H2A),选项B 错误;利用分布系数计算电离平衡常数关键是要找到对应的交点,a点δ(A2-)=δ(HA-),则

选项A 错误.第一次突变的pH 处于酚酞的变色范围,故可选用酚酞作指示剂,选项C正确.答案为C.
在现今这个数字化、信息化的时代,各种图像甚至各学科的融合正在不断加强.高考作为现阶段最具影响力的考试之一,一定会紧跟时代的脚步——体现融合的大趋势.作为时代的一员,高中教师和学生更应该“顺势而为”!
