构建思维模型 突破解题难点
——例谈涉及电解质图像问题的答题技巧
2023-01-07伟正高级教师
陈 莉 汤 伟正高级教师
(1.江苏省徐州市徐州中学 2.安徽省灵璧县灵璧中学)
涉及电解质的知识点属于中学化学的重点与难点,也是高考的高频考点,近年来所考查的知识点主要涉及微粒浓度的比较,电解质强弱的推断,弱电解质的电离,盐类的水解,pH、Ka、Kb、Ksp的计算,难溶电解质的溶解平衡及其应用等.试题多以图像形式展示,设计新颖灵活,综合性强,难度较大,较好地体现了“宏观辨识与微观探析”“证据推理与模型认知”“变化观念与平衡思想”的化学学科核心素养.本文通过具体实例,将近年来高考涉及的经典图像模型分解说明,通过其模型的构建与应用,得出该类问题的解答方法与技巧.
1 分布分数模式
1.1 构建试题模型
分布分数模式图也称分布系数图,其分布曲线通常以pH 为横坐标、各物种分布系数(即平衡时组分的物质的量占总物质的量或浓度占总浓度的分数)为纵坐标的关系曲线.例如,室温下向某草酸溶液中逐滴加入一定浓度的NaOH 溶液,所得溶液中3种粒子H2C2O4、HC2O-4、C2O2-4的物质的量分数(δ)与pH的关系如图1所示.
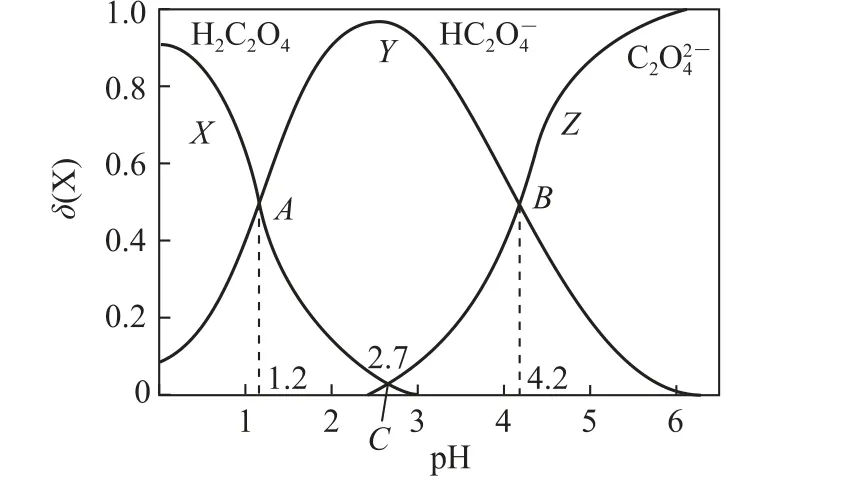
图1
1.2 解答技巧突破


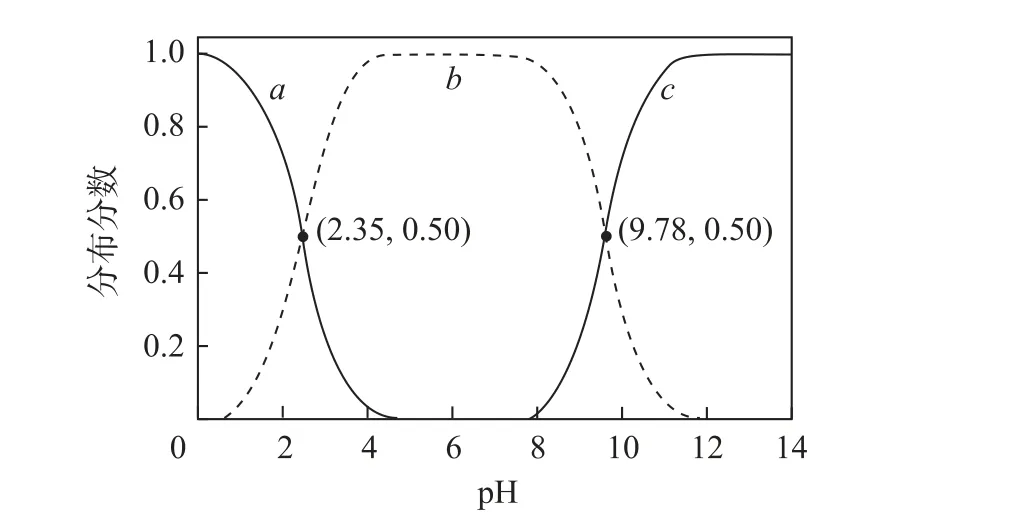
图2
A.甘氨酸具有两性
B.曲线c代表NH2CH2COO
C.NH+3CH2COO-+H2O⇌NH+3CH2COOH+OH-的平衡常数K=10-11.65
D.c2(NH+3CH2COO-)<c(NH+3CH2COOH)·c(NH2CH2COO-)
分析 根据NH2CH2COOH 分子结构特点,该分子中既存在—NH2又存在—COOH,所以甘氨酸具有两性,选项A 说法正确.在酸性较强时—NH2会结合H+,在碱性较强时—COOH 会与OH-反应,故曲线a表示NH+3CH2COOH 的分布分数随溶液pH的变化,曲线b表示NH+3CH2COO-的分布分数随溶液pH 的变化,曲线c表示NH2CH2COO-的分布分数随溶液pH 的变化,选项B 说法正确.根据NH+3CH2COO-+H2O⇌NH+3CH2COOH +OH-的反应特点,可以得出该反应的平衡常数为

2 滴定曲线模式
2.1 构建试题模型
滴定曲线图一般是借助酸碱混合过程中,溶液pH 的变化得出的曲线图,如用0.1 mol·L-1盐酸分别滴定0.1mol·L-1NaOH 溶液与0.1mol·L-1氨水时所呈现的图示如图3 所示;若用0.1 mol·L-1NaOH 溶液滴定相同浓度的盐酸与醋酸,所呈现的图示如图4所示.
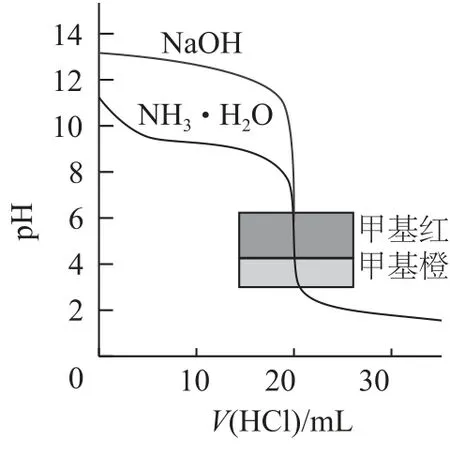
图3

图4
2.2 解答技巧突破
解答该类试题重点从以下几点突破.1)初始点的pH,根据浓度与pH 关系,得出提供的酸或碱的强弱,或根据初始pH 得出原电解质的电离度.2)滴定达到一半时,根据溶质的特点及pH,可以推理出微粒浓度的大小顺序及微粒间的物料守恒关系.3)中性点,该点一般涉及电荷守恒.4)恰好反应点,根据溶质特点推理出微粒关系.5)过量点,根据溶质组成特点,考查3个守恒及微粒浓度大小.
说明:在高考试题设计上,可以借助所学习的酸碱中和滴定曲线,迁移考查氧化还原滴定曲线、沉淀滴定曲线、酸与盐反应滴定曲线等.
例2 (2022年湖南卷)室温时,用0.100mol·L-1的标准AgNO3溶液滴定15.00mL浓度相等的Cl-、Br-和I-混合溶液,通过电位滴定法获得lgc(Ag+)与V(AgNO3)的关系曲线如图5所示(忽略沉淀对离子的吸附作用).若溶液中离子浓度小于1.0×10-5mol·L-1时,认为该离子沉淀完全.
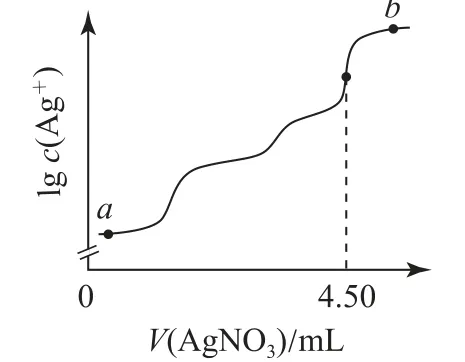
图5
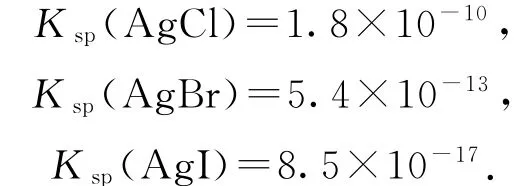
下列说法正确的是( ).
A.a点:有白色沉淀生成
B.原溶液中I-的浓度为0.100mol·L-1
C.当Br-沉淀完全时,已经有部分Cl-沉淀
D.b点:c(Cl-)>c(Br-)>c(I-)>c(Ag+)
分析 向含浓度相等的Cl-、Br-和I-混合溶液中滴加AgNO3溶液,根据3种沉淀的Ksp大小判断离子沉淀的先后顺序为I-、Br-、Cl-.I-先沉淀,AgI是黄色的,所以a点有黄色沉淀AgI生成,选项A 错误.根据滴定图示,当滴入4.50mL AgNO3溶液时,Cl-恰好沉淀完全,此时共消耗AgNO3的物质的量为若Cl-已经开始沉淀,则此时溶液中
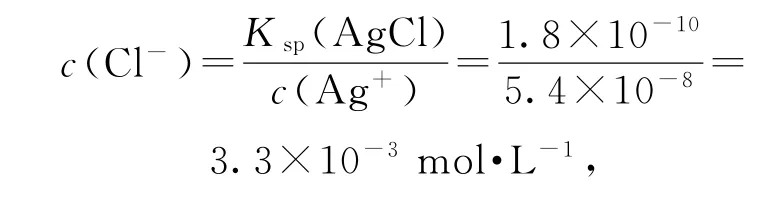

原溶液中的c(Cl-)=c(I-)=0.0100mol·L-1,则已有部 分Cl-沉 淀,选 项C 正 确.b点 加 入 了 过 量 的AgNO3溶液,溶液中的I-、Br-、Cl-全部转化为沉淀,则Ag+浓度最大,根据溶度积可知,b点各离子浓度为c(Ag+)>c(Cl-)>c(Br-)>c(I-),故选项D错误.答案为C.
3 直线函数模式
3.1 构建试题模型
涉及直线的图像,几乎都是构建“y=kx+b”的函数形式.根据水的离子积常数、弱酸或弱碱的电离常数、溶度积常数等表达式,分别取对数,可以形成“y=kx+b”的函数形式,对应的曲线实为一条直线.
3.2 解答技巧突破
1)水的离子积常数衍变成的直线图.根据水的离子积常数,向水中加入酸或碱,分别取对数,可以得出pOHpH 曲线,如图6所示.该直线中,Q点显中性,M点显酸性,N点显碱性,M、N两点水的电离程度相同.
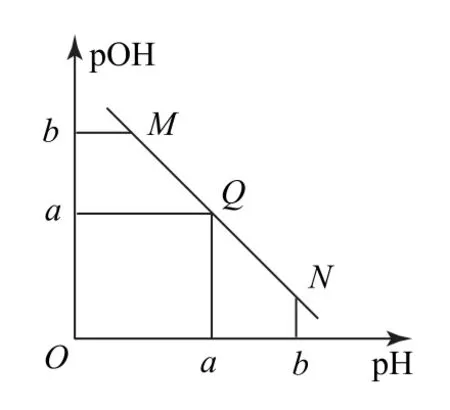
图6
2)弱电解质电离常数衍变出的直线.如室温下将NaOH 溶液滴加到二元弱酸(H2X)溶液中,混合溶液的pH 与离子浓度变化关系如图7所示.
图7


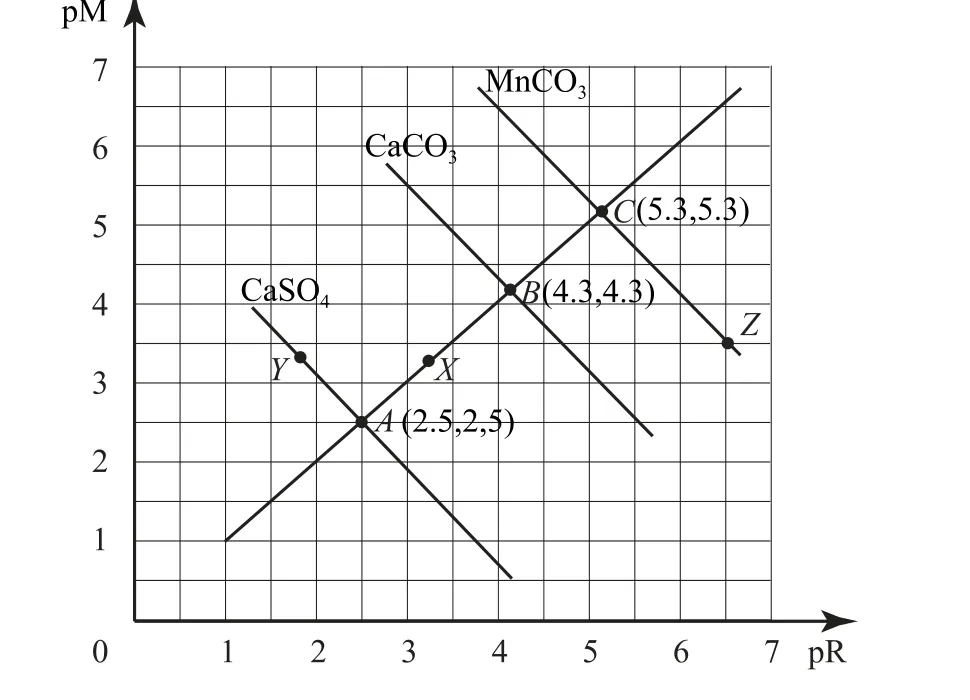
图8
该直线AB上的点:c(M2+)=c(R2-).根据图示还可以得出溶度积:CaSO4>CaCO3>MnCO3.X点:要 析 出CaCO3沉 淀,能 继 续 溶 解CaSO4.Y点:c(SO2-4)>c(Ca2+),二者的浓度积等于10-5.Z点:c(CO2-3)<c(Mn2+),二者的浓度积等于10-10.6.
例3 (2022 年海南卷)某元素M 的氢氧化物M(OH)2(s)在水中的溶解反应为M(OH)2(s)⇌M2+(aq)+2OH-(aq)、M(OH)2(s)+2OH-(aq)⇌M(OH)2-4(aq),25 ℃时,-lgc与pH 的关系如图9所示,c为M2+或M(OH)2-4浓度的值.下列说法错误的是( ).
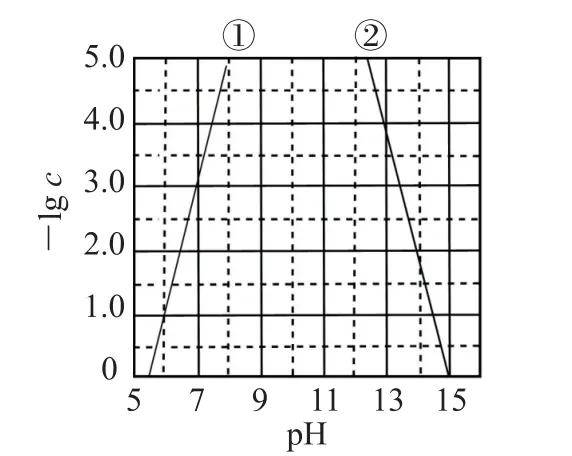
图9
A.曲线①代表-lgc(M2+)与pH 的关系
B.M(OH)2的Ksp约为1×10-10
C.向c(M2+)=0.1 mol·L-1的 溶 液 中 加 入NaOH 溶液至pH =9.0,体系中元素M 主要以M(OH)2(s)存在
D.向c[M(OH)2-4]=0.1 mol·L-1的溶液中加入等体积0.4mol·L-1的HCl后,体系中元素M 主要以M2+存在
分析 由题给反应知,随着pH 增大,c(OH-)增大,则c(M2+)减 小,c[M (OH)2-4]增 大,即-lgc(M2+)增大,-lgc[M(OH)2-4]减小,因此曲线①代 表-lgc(M2+)与pH 的 关 系,曲 线②代 表-lgc[M(OH)2-4]与pH 的关系,选项A 正确.根据图像得出,pH=7.0时,-lgc(M2+)=3.0,则M(OH)2的Ksp=c(M2+)·c2(OH-)=1×10-17,选项B错误.根据图像,pH=9.0时,c(M2+)、c[M(OH)2-4]均极小,则体系中元素M 主要以M(OH)2(s)存在,选项C正确.c[M(OH)2-4]=0.1mol·L-1的溶液中,加入等体积的0.4mol·L-1的HCl后,大家易误认为二者之间首先发生如下反应:M(OH)2-4+4H+=4H2O+M2+,M(OH)2-4转化为M2+,所以误认为选项D 正确.我们仔细观察图像隐含的信息,可以发现,当c[M(OH)2-4]=0.1 mol·L-1时,此时溶液的pH 较大,c(OH-)大约是0.4 mol·L-1的HCl溶液中c(H+)的10倍,故二者等体积混合后溶液pH 仍然较大,根据图像可以得出,混合后体系中元素M 主要以M(OH)2-4存在,选项D 错误.答案为B、D.
4 双曲线函数模式
4.1 构建试题模型
涉及双曲线的图像,几乎都是构建“xy=a”的函数形式,如根据水的离子积常数、溶度积常数等表达式,可以形成“xy=a”的函数形式,对应的双曲线分别如图10、图11所示.
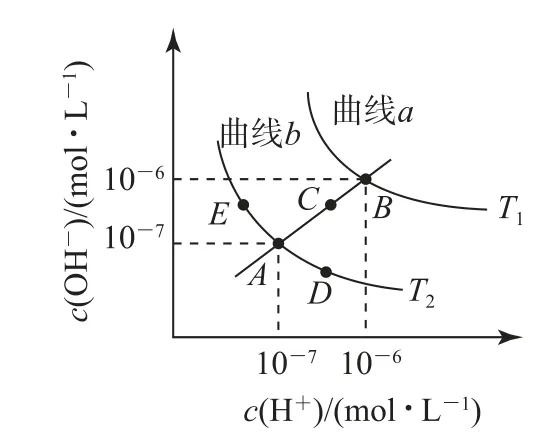
图10
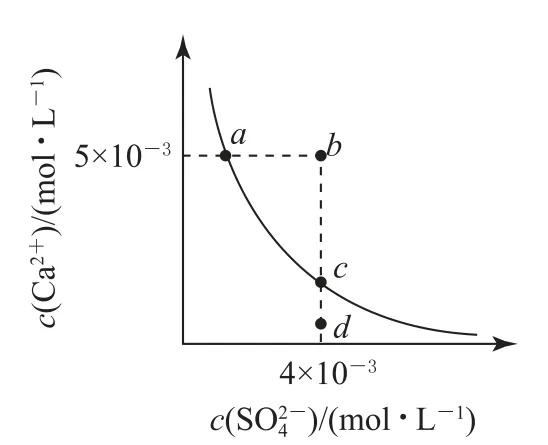
图11
4.2 解答技巧突破
1)针对不同温度下水溶液中c(H+)与c(OH-)的变化曲线(如图10),把握以下几个关键点:A、C、B3点均为中性,温度依次升高,Kw依次增大;AB直线的左上方均为碱性溶液,任意一点c(H+)<c(OH-);D点为酸性溶液,E点为碱性溶液,Kw=1×10-14.
2)针对难溶性物质(以CaSO4为例)溶度积变化曲线(如图11),把握以下几个关键点:a、c点在曲线上,a→c的变化为增大c(SO2-4)(如加入Na2SO4固体),但Ksp不变;b点在曲线的上方,Qc>Ksp,将会有沉淀生成;d点在曲线的下方,Qc<Ksp,则为不饱和溶液,还能继续溶解CaSO4.
例4 (2022年山东卷)工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研究.现有含SrCO3(s)的0.1 mol·L-1、1.0 mol·L-1Na2CO3溶液,含SrSO4(s)的0.1 mol·L-1、1.0 mol·L-1Na2SO4溶 液.在 一 定pH 范 围 内,4 种 溶 液 中lg[c(Sr2+)/mol-1·L-1]随pH 的变化关系如图12所示.下列说法错误的是( ).
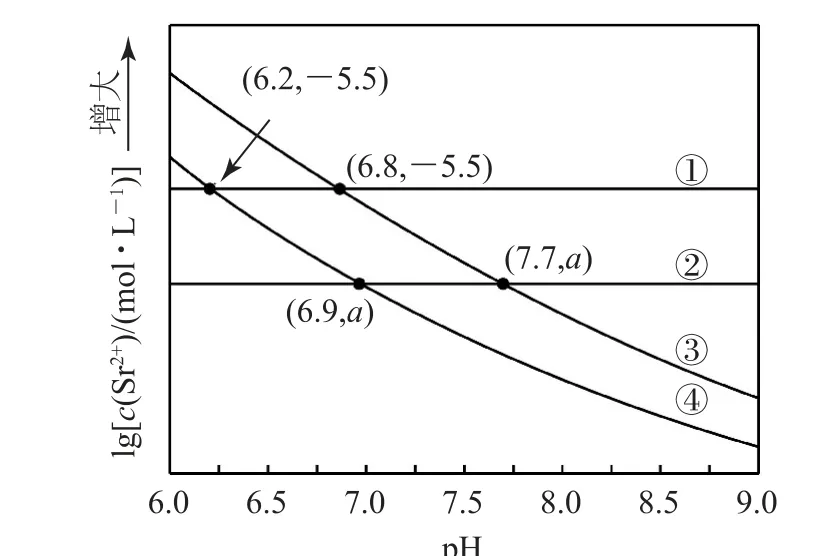
图12


5 多曲线综合模式
5.1 构建试题模型
该类图像常常借助上述多个不同变量间的变化特点,融合多条曲线于一体,如2020年全国高考理综Ⅰ卷第13题(如图13)、2021年辽宁卷第15题(如图14)就是将分布分数图与酸碱中和滴定曲线图融为一体考查的._____________________________
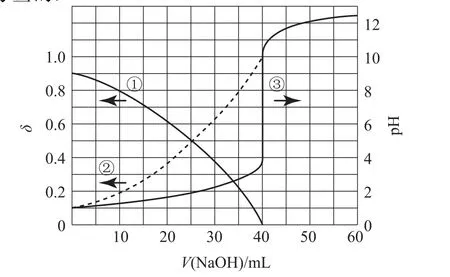
图13
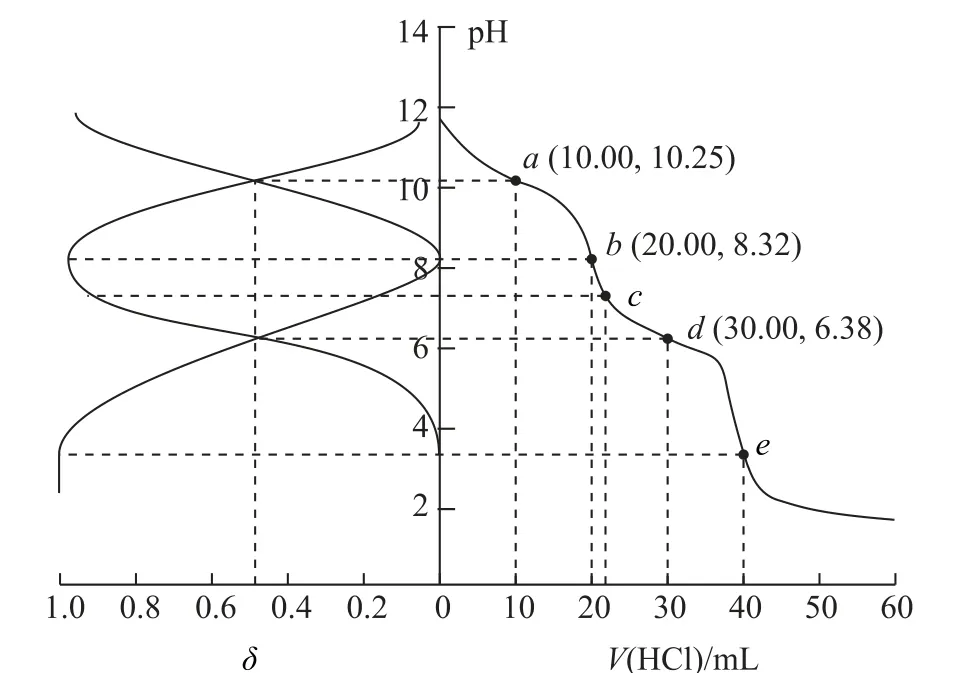
图14
5.2 解答技巧突破
解答该类试题的突破口是借助控制变量思想,抓住某一曲线的变化本质,利用上述谈到的解题方法与关键点推理,再进一步分析另一条曲线的变化规律.
例5 常温下,用0.2 mol·L-1盐酸滴定25.00 mL0.2 mol·L-1的NH3·H2O 溶液,所得溶液的pH、NH+4和NH3·H2O 的物质的量分数与滴加盐酸体积的关系如图15所示.下列叙述错误的是( ).

图15
A.曲线①代表φ(NH3·H2O),曲线②代表φ(NH+4)
B.a点溶液中存在c(NH+4)=c(NH3·H2O)>c(Cl-)
C.NH3·H2O 的电离常数的数量级为10-4
D.若选择甲基橙为指示剂,滴定终点溶液的颜色变化为黄色变为红色
分析 根据分布分数图的特点,可得出曲线①代表φ(NH3·H2O),曲线②代表φ(NH+4),选项A 叙述正确.交点a处,c(NH+4)=c(NH3·H2O),溶液的pH=9.26,显碱性,c(OH-)>c(H+),由电荷守恒可知c(NH+4)>c(Cl-),c(NH+4)=c(NH3·H2O)>c(Cl-),选 项B 叙 述 正 确.a点 时,c(NH+4)=c(NH3·H2O),Kb(NH3·H2O)=c(OH-)=10-4.74,数量级为10-5,选项C 叙述错误.滴定终点溶液显酸性,选择甲基橙为指示剂,滴定终点溶液的颜色由黄色变为红色,选项D 叙述正确.答案为C.
