化工生产流程中的除杂方法
2023-01-07成黎黎
成黎黎
(江苏省南通市海门实验学校)
化工流程题是高考化学必考题之一,结合元素化合物知识,考查化学反应速率、化学平衡、盐的水解、物质的分离与提纯等基本理论.化工生产大多是利用自然界中的矿石生产所需要的产品.天然矿石中含有杂质,生产过程中需要将这些杂质除去,除去杂质的过程成为化工流程题的考查方向.
1 根据化工原料的成分除杂
解答化工流程题,要明确矿石的主要成分和次要成分,需要掌握这些成分所属物质的类别,具有什么性质,能与哪些物质发生化学反应,在化工流程中发生了什么反应,最终到了哪里等知识点.
例1 纳米氧化镁是在磁性、催化方面有许多特异功能的新材料,具有重要价值.工业上以菱镁矿(主要成分为MgCO3,含少量FeCO3、CaCO3和SiO2杂质)为原料制备纳米氧化镁的工艺流程如图1所示.
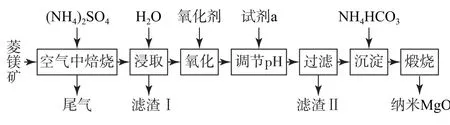
图1
(1)在“焙烧”中,SiO2几乎不发生反应,MgCO3、FeCO3、CaCO3转化为相应的硫酸盐.写出FeCO3转化为NH4Fe(SO4)2的化学方程式:________.
(2)“滤渣Ⅰ”的成分是_________.
(3)已知在该条件下金属离子开始沉淀和完全沉淀时的pH 如表1所示.

表1
上述流程中所用“氧化剂”常为双氧水,这一步不可省掉的理由是_________.
(4)“试剂a”可能是_________;调节pH 的范围是_________.
分析 (1)FeCO3转化为NH4Fe(SO4)2,Fe元素化合价升高,被空气中的氧气氧化,“焙烧”时生成的主要气体有NH3、CO2,则化学方程式为
4FeCO3+O2+8(NH4)2SO4=4NH4Fe(SO4)2+12NH3↑+4CO2↑+6H2O.(2)CaSO4是微溶物,SiO2不溶于水,“滤渣Ⅰ”的成分是CaSO4、SiO2.(3)根据表格数据可知,Fe2+未沉淀完全时,Mg2+已开始沉淀,故上述流程中常用双氧水将Fe2+氧化为Fe3+,这一步不可省掉的理由是:防止Fe2+未完全转化成Fe3+,导致下一步Fe2+和Mg2+可能同时沉淀,后续难以分离产品.(4)试剂a可能是MgO(或MgCO3、Mg(OH)2、Mg2(OH)2CO3等);调节pH 使Fe3+完全转化为Fe(OH)3沉淀时Mg2+未开始沉淀,则调节pH 的范围是2.8≤pH<8.9.
2 根据溶液的pH 除杂
化工流程中通常用调节溶液pH 的方法使杂质离子产生沉淀并除去.
例2 碳酸锶(SrCO3)难溶于水,主要用于电磁材料和金属冶炼.一种由工业碳酸锶(含少量Ba2+、Ca2+、Mg2+、Pb2+等)制备高纯碳酸锶的工艺流程如图2所示.
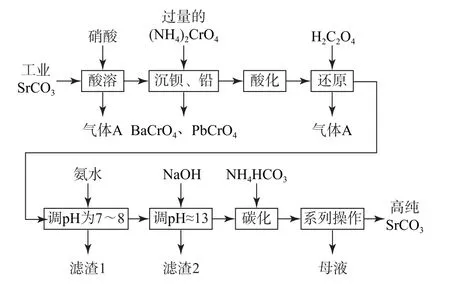
图2
已知:Ⅰ.Cr(OH)3为两性氢氧化物;
Ⅱ.常温下,各物质的溶度积常数如表2所示.
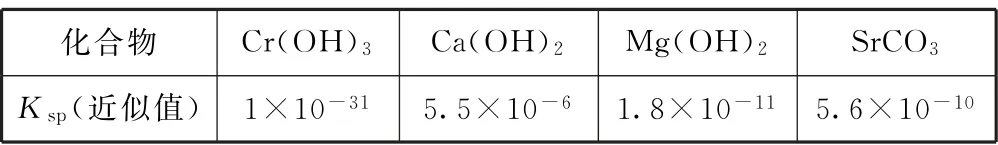
表2
回答下列问题:
(1)“沉钡、铅”时,pH 过低会导致(NH4)2CrO4的利用率降低,原因是_________(用离子方程式解释);“还原”时发生反应的离子方程式为________.
(2)“滤渣1”的主要成分为_________(填化学式).
(3)用氨水和NaOH 分步调节pH,而不是直接调节溶液的pH≈13的原因为_________.
(4)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因是________.
分析 (1)(NH4)2CrO4溶液中存在平衡:2CrO2-4+2H+⇌Cr2O2-7+H2O,pH 过低,H+浓度过大,平衡正向移动,更多的CrO2-4转化为Cr2O2-7,导致(NH4)2CrO4的利用率降低;结合流程和分析来看,“还原”时草酸和Cr2O2-7发生氧化还原反应,离子方 程 式 为8H++Cr2O2-7+3H2C2O4=2Cr3++6CO2↑+7H2O.(2)“滤渣1”的主要成分为Cr(OH)3.(3)Cr(OH)3是两性氢氧化物,pH 过大Cr(OH)3会溶解,故用氨水和NaOH 分步调节pH,而不是直接调节溶液的pH≈13,原因是pH 过高会使Cr(OH)3溶解,导致铬的去除率降低.(4)“调pH≈13”主要是使Mg2+、Ca2+沉淀,“调pH ≈13”后需对溶液进行煮沸并趁热过滤的原因是Ca(OH)2的溶解度随着温度的升高而降低,煮沸并趁热过滤有利于除尽溶液中的Ca2+.
3 根据加入的沉淀剂除杂
解题过程中要理解化工流程题中加入的试剂所起的作用,有的是溶解原料,有的是与原料中的某种成分反应,还有的是沉淀原料中的杂质离子.
例3 CoC2O4是制备金属钴的原料,利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图3所示.已知:
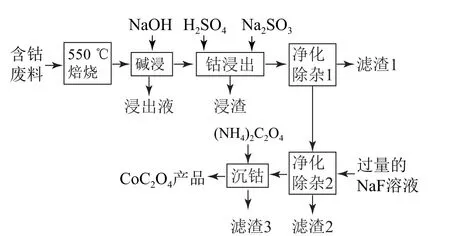
图3
①Ksp(MgF2)=7.42×10-11,Ksp(CaF2)=1.46×10-10;②氧化性:Co2O3>O2>Cl2;
③部分金属离子沉淀的pH 如表3所示(开始沉淀的pH 按离子浓度为1.00mol·L-1计算).
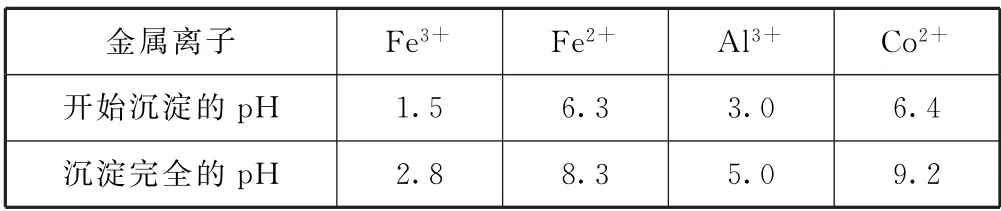
表3_
离子浓度小于1.0×10-5mol·L-1时,认为该离子沉淀完全.
(1)“500 ℃焙烧”的目的是_________.
(2)“净化除杂1”过程中,先在40~50 ℃时加入H2O2,其作用是_________(用离子方程式表示);再升温至80~85 ℃,加入Na2CO3溶液,调pH 至4.5,“滤渣1”的主要成分是________.
(3)“净化除杂2”可将Mg2+、Ca2+沉淀除去,当c(Mg2+)=1.0×10-5mol·L-1时,溶液中的Ca2+是否沉淀完全:_______(填“是”或“否”).
分析 (1)500 ℃焙烧时,碳会变成CO2逸出,有机物会生成CO2和水,则“500 ℃焙烧”的目的是除去碳和有机物.(2)“钴浸出”过程中,Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+,“净化除杂1”过程中,先在40~50 ℃加入H2O2,可将Fe2+氧化成Fe3+,发生的反应为H2O2+2Fe2++2H+=2Fe3++2H2O.再升温至80~85 ℃,加入Na2CO3溶液,CO23-和Fe3+发生双水解反应,Fe3+转化为Fe(OH)3沉淀,则“滤渣1”的主要成分是Fe(OH)3.(3)当c(Mg2+)=1.0×10-5mol·L-1时,Ksp(MgF2)=7.42×10-11,则