冰冻PRP和冻干PRP的抗菌作用研究*
2023-01-06毛平平王淑君罗开云齐清赵广超栾建凤
毛平平 王淑君 罗开云 齐清 赵广超 栾建凤
富血小板血浆(platelet rich plasma,PRP)因含有大量生长因子被广泛应用于美容、植发、整形、临床创面及软组织的修复[1]。随着PRP在急性和慢性感染创面的应用,其抑菌作用也受到了研究者的关注。文献证实,PRP无论在体内还是体外,都具有抗菌性和抗炎性,且抗菌机制特殊不易产生抗菌耐药性[2]。在急性和慢性感染创面的细菌筛查显示,无论是单一还是多种细菌联合感染,最为显著的感染菌是金黄色葡萄球菌、大肠杆菌和铜绿假单胞菌。此外,白色念珠菌不仅是临床感染常见菌也是手术器材污染常见菌[3]。因此本文选取了金黄色葡萄球菌、大肠杆菌、白色念珠菌、铜绿假单胞菌四种临床感染常见微生物进行体外抑菌实验研究。
考虑到新鲜PRP使用前需要一定的制备时间,既不方便紧急状况及边远地区使用,且一次制备后不能多次使用。近年来,针对PRP保存方式的研究也越来越多,常见的有冷冻和冻干两种方式[4]。结合既往文献对新鲜PRP抑菌作用的研究,本研究选用冰冻PRP和冻干PRP,探讨保存方式是否影响PRP的抑菌作用。
资料与方法
1 主要仪器和材料
1.1 仪器:血细胞分离机 (Fresenius Kabi,型号COM.TEC) 、全自动血细胞分析仪(Sysmex,型号XE2100)、电热恒温培养箱(太仓市华利达实验设备有限公司,型号DHO-9082)、麦氏细菌比浊仪(杭州市齐威仪器有限公司,型号WGZ-XT)、冷冻干燥机(上海爱朗仪器有限公司,型号FDU-1200)、漩涡混合器(上海琪特分析仪器有限公司,型号QT-2)、电热恒温水槽(上海森信实验仪器有限公司,型号DK-8D)、无菌接驳机(bms,型号STW6810)-40℃低温冰箱(SanYo,型号MDF-5411)、光学显微镜(Olympus Corporation,型号CX23T)。
1.2 材料:营养肉汤(北京陆桥技术股份有限公司,批号200511)营养琼脂平板(青岛高科技工业园海博生物技术有限公司,批号20220124)、一次性接种环(比克曼生物,批号202108A)、灭菌注射用水(石家庄四药有限公司,批号2110163203)、快速法革兰氏染色液(珠海贝索生物技术有限公司,批号C210801)、生理盐水(济民健康管理股份有限公司,批号R211118A41)。
1.3 实验菌株:金黄色葡萄球菌(ATCC25923)、大肠杆菌(ATCC25922)、白色念珠菌(ATCC14053)、铜绿假单胞菌(ATCC27853),来自东部战区总医院中心实验室。
2 方法
2.1 标本来源:本研究经医院伦理委员会讨论通过(No.2022(KY)-007)。经筛查均符合《献血者健康要求》(GB18467-2011)的12位健康无偿献血者,分别取其机采血小板20 mL。无菌条件下分成2份,每份10 mL,置于-40℃低温冰箱冷冻保存。
2.2 冰冻PRP、冻干PRP的制备:-40℃低温冰箱的冰冻单采血小板即为冰冻PRP,使用前置于37℃水浴复融。将-40℃低温冰箱的一份冰冻单采血小板[5],放入预降温至-46℃的冻干机进行真空干燥,保持真空度为<15 Pa,干燥12 h后取出,即为冻干PRP,室温密封干燥保存4周后,使用前加入该样本冻干前等体积灭菌注射用水充分混匀复水。
2.3 菌株的活化以及增菌:将冻存的4种标准菌株各取1接种环,采用分区划线法接种至普通营养琼脂平板,经37℃恒温培养箱培养24 h,可见单个菌落形成,取2~3个单独菌落加入2 mL无菌生理盐水管中碾磨并使用漩涡混合器混匀,用麦氏细菌比浊仪调成0.5麦氏单位细菌悬液,分别取0.2 mL金黄色葡萄球菌悬液、大肠杆菌悬液、白色念珠菌悬液、铜绿假单胞菌悬液加入2 mL肉汤培养基,每一种细菌制备9支肉汤管备用。
2.4 实验分组及设计
2.4.1 实验分组:分别为生理盐水对照组,冰冻PRP组和冻干PRP组。取金黄色葡萄球菌肉汤培养基3管,对照组加入2 mL生理盐水,冰冻PRP组加入复融后2 mL冰冻PRP,冻干组PRP加入同一献血者2 mL复水的冻干PRP。各试验组设3个样本,9管试管同时置入37℃电热恒温培养箱中孵育。用相同方法处理大肠杆菌肉汤培养基、白色念珠菌肉汤培养基、铜绿假单胞菌肉汤培养基。
2.4.2 观察指标:(1)血细胞分析仪检测每份PRP的血小板、白细胞及红细胞含量。(2)菌落计数:根据各菌种的生长周期设定取样时间,金黄色葡萄球菌为3、6、9、12、24 h取样,大肠杆菌为2、4、6、8、10 h取样,白色念珠菌为6、18、24、30、36 h取样,铜绿假单胞菌为3、6、9、12、18 h取样。每个时间点分别取两次0.1 mL样本,一份样本直接涂于玻片,革兰染色后于光学显微镜下观察细菌形态;另一份用样本加入0.9 mL生理盐水后,做10~107梯度稀释,取0.1 mL稀释后样本涂布接种于普通营养琼脂平板,每次取样使用漩涡混合器混匀30 s,置37.0 ℃电热恒温培养箱培养24 h,记录下各平板上的菌落数,算出同一种菌落稀释后平板上生长的平均菌落数,计量数据以()×106CFU/mL表示。
3 统计学处理 采用SPSS 23.0统计软件分析,计量资料以均数±标准差表示,由于菌落计数不成正态分布, 因此取常用对数转化使之基本符合正态分布。重复测量数据使用广义估计方程处理,同时考虑实验分组(组间)和重复取样的时间点(组内)两个因素,若差异具有显著性,任一时间点组间两两比较或同一组内不同时间点两两比较当满足球形检验时用SNK法作单因素方差分析,不满足球形检验时作多因素方差分析,P<0.05表示差异有统计学意义。采用GraphPad Prism9统计软件作图,实验数据以log均数表示。
结 果
1 PRP中白细胞及血小板含量 机采PRP的血小板浓度为(1 083±91.667)×109/L,白细胞计数为(0.032±0.027)×109/L,未检出红细胞。
2 金黄色葡萄球菌组各时间点冰冻PRP组与冻干PRP组的抑菌活性比较 由模型中自变量的检验结果可知,取样时间、实验分组、取样时间*实验分组的交互项均具有统计学意义(P<0.05)。在观察的24 h内,冰冻PRP组和冻干PRP组相较于对照组均对金黄色葡萄球菌生长有抑制作用,且差异有统计学意义(P<0.05)。其中,3 h、6 h冻干PRP组细菌计数低于冰冻PRP组,差异有统计学意义(P<0.05);9 h冻干PRP组细菌计数低于冰冻PRP组,差异无统计学意义(P>0.05);12 h、24 h冻干PRP组细菌计数高于冰冻PRP组,差异均无统计学意义(P>0.05)(图a)。
3 大肠杆菌菌组各时间点冰冻PRP与冻干PRP的抑菌活性比较 由模型中自变量的检验结果可知,取样时间、实验分组、取样时间*实验分组的交互项均具有统计学意义(P<0.05)。冰冻PRP组与冻干PRP组对大肠杆菌的抑制作用,在2 h、4 h、6 h、8 h与对照组相比,差异有统计学意义(P<0.05),10 h与对照组相比,差异无统计学意义(P>0.05)。其中,2 h冻干PRP组细菌计数低于冰冻PRP组,差异有统计学意义(P<0.05);4 h冻干PRP组细菌计数低于冰冻PRP组,但差异无统计学意义(P>0.05);6 h、8 h、冻干PRP组细菌计数高于冰冻PRP组,差异有统计学意义(P<0.05),10 h冻干PRP组细菌计数高于冰冻PRP组,差异无统计学意义(P>0.05)(图b)。
4 白色念珠菌组各时间点冰冻PRP与冻干PRP的抑菌活性比较 由模型中自变量的检验结果可知,取样时间、实验分组、取样时间*实验分组的交互项均具有统计学意义(P<0.05)。冰冻PRP组与冻干PRP组对白色念珠菌的抑制作用时间出现在24 h,与对照组相比差异有统计学意义(P<0.05),冻干PRP组细菌计数低于冰冻PRP组(P<0.05)。6、18、30、36 h时间点冰冻PRP组、冻干PRP组与对照组相比,细菌计数皆高于对照组对白色念珠菌无抑制作用,差异有统计学意义(P<0.05);6、18、30、36四个时间点,冰冻PRP组和冻干PRP白色念珠菌计数相比,差异无统计学意义(P>0.05)(图c)。
5 铜绿假单胞菌组各时间点冰冻PRP与冻干PRP的抑菌活性比较 由模型中自变量的检验结果可知,取样时间、实验分组、取样时间*实验分组的交互项均具有统计学意义(P<0.05)。冰冻PRP组与冻干PRP组对铜绿假单胞菌未显示出抑菌作用。18 h内冰冻PRP组、冻干PRP组细菌计数皆高于对照组(P<0.05),且冻干PRP组与冰冻PRP组比较差异无统计学意义(P>0.05)(图d)。

图1 不同处理的各菌种随时间增长曲线图
6 冰冻PRP组、冻干PRP组在6~18 h白色念珠菌的数量和质量都高于对照组 在革兰染色涂片中,可以观察到冰冻PRP组、冻干PRP组白色念珠体积大于对照组,数量高于对照组,且出芽生成假菌丝,提示PRP在该时间段内促进白色念珠菌生长(图2)。
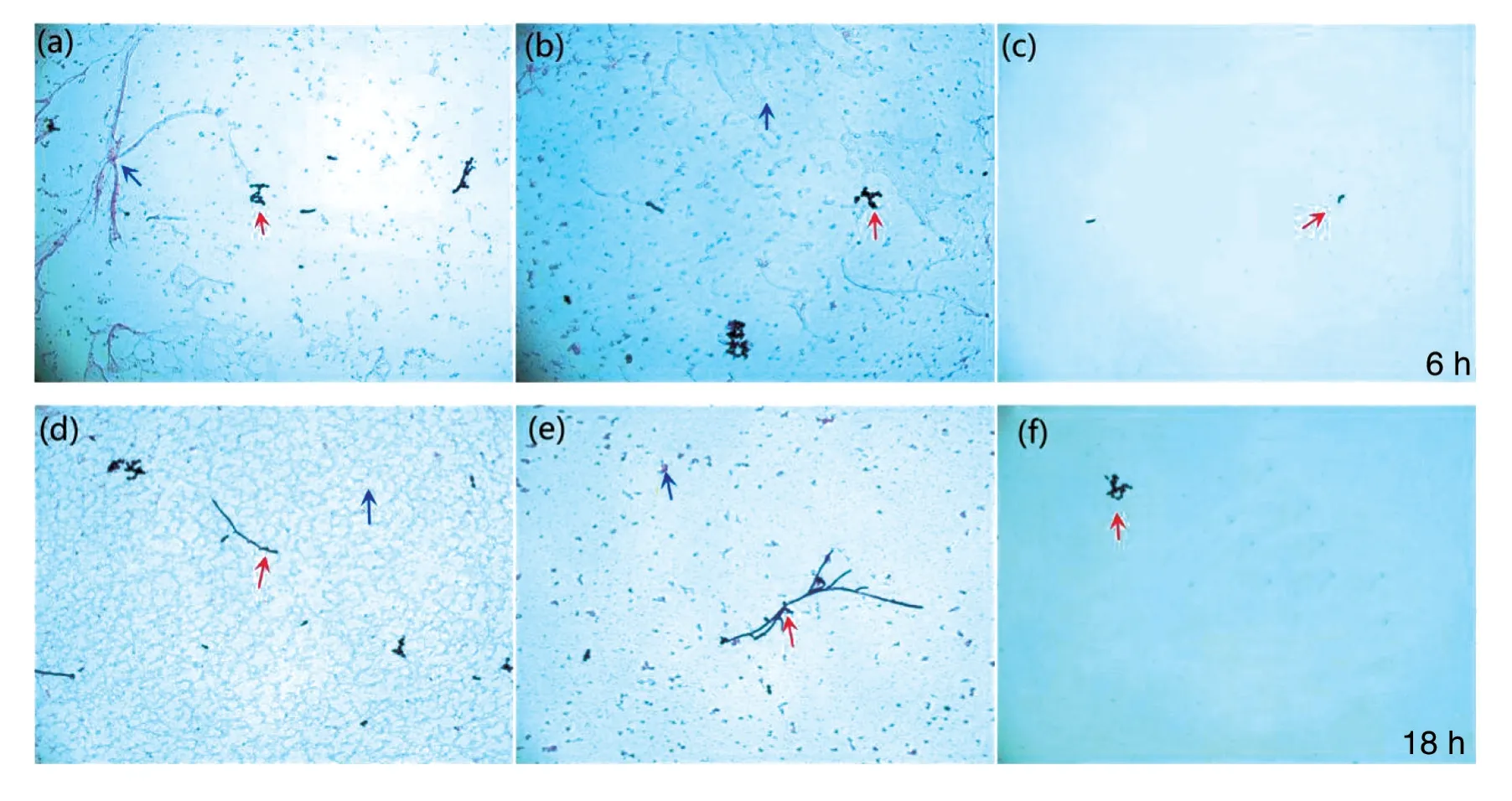
图2 三组6 h与18 h白色念珠菌革兰染色涂片(40倍镜)
讨 论
PRP是通过梯度密度离心法从全血中分离获得的血小板浓缩物,其制备方法主要包括试管手工法、单采血小板法、PRP专用套装法和标准血袋制备法等多种方法。因无统一标准,导致不同制备方法其成品中所含血小板质量及数量差异较大,白细胞混入量、红细胞混入量也有差异[6]。近年来越来越多的文献显示血小板直接和间接地参与抗菌效应,其一,血小板最早参与微生物抗原识别,激活其他免疫细胞参与防御;其二,血小板可通过裂解释放多种抗菌肽,可直接抑制细菌生长;其三,血小板还能介导炎性细胞的趋化及调节免疫细胞。因此血小板的数量及质量将直接影响患者的治疗效果和实验结果[7-8]。单采PRP作为研究对象,不仅血小板平均浓度稳定、含量高达1 080×109/L,而且残留白细胞数(0.032±0.027)×109/L,冰冻之后白细胞失去抗菌特性可最大限度排除白细胞干扰,便于观察血小板自身的抑菌效果,实验质量更高、重复性更好。与新鲜PRP相比,本文选用单采血小板法制备的冰冻PRP和冻干PRP作为研究对象,可排除白细胞干扰。经过冰冻和冻干过程血小板被激活,活化后的血小板会分泌更多的趋化因子源性肽,如CXCL4(PF-4)、CXCL7(PBP)、CCL5[9]等;此外,活化血小板更易裂解,产生更多抗菌肽,如HBD-1、HBD-2、HBD-3、HNP-1等[10];上述趋化因子和抗菌肽可以直接杀死细菌,因此抗菌效果更好[11]。
实验结果显示金黄色葡萄球菌计数曲线图(图a)中冰冻PRP组、冻干PRP组对细菌计数最少值出现在6 h且细菌计数相对3 h时更低,两组生长曲线与对照组趋势均不一致,说明冰冻PRP、冻干PRP释放足量抗菌肽后对金黄色葡萄球菌存在一定的杀菌作用。大肠杆菌、白色念珠菌计数曲线图(图b、c)中冰冻PRP组、冻干PRP组生长曲线与对照组趋势一致,但在某些时间点低于对照组,说明冰冻PRP、冻干PRP对大肠杆菌、白色念珠菌存在抑菌作用。铜绿假单胞菌计数曲线图(图d)中冰冻PRP组、冻干PRP组生长曲线与对照组趋势一致,且全程高于对照组,说明冰冻PRP、冻干PRP对铜绿假单胞菌无抑菌作用。可见冷冻保存和冻干保存的PRP有特定的抗菌谱,对金黄色葡萄球菌、大肠杆菌、白色念珠菌生长有抑制作用,对铜绿假单胞菌不仅无抑制作用反而促进其生长,与文献报道新鲜PRP对上述细菌作用趋势相一致[12-16]。与冰冻PRP的抑菌作用相比,冻干PRP在早期即表现出较强的抑制金黄色葡萄球菌、大肠杆菌的作用。这可能与血小板在冻干过程中虽然细胞膜结构完整,胞内颗粒结构仍保留[17],但因受到挤压使得细胞变形略显肿胀,导致细胞膜通透性改变,加速血小板释放抗菌肽,使得冻干PRP在前数小时内具有明显的抑制细菌生长的作用。随着时间推移冻干PRP的抗菌肽被过度消耗,在抑菌作用的后期出现冰冻PRP抑菌效果强于冻干PRP的现象。
冰冻PRP和冻干PRP对实验中四种菌种生长作用曲线一致。对于金黄色葡萄球菌6 h的细菌计数较3 h少,这表明PRP不仅具有抑菌作用也有杀菌作用,FARGHALI等人[18]证实了这一点,其研究显示持续给予足够剂量PRP比只给一次更有效。对大肠杆菌的抑菌作用可以持续到8 h,随后作用减弱,10 h无抑制作用。MARIANI等人研究显示PRP只在实验的早期(2 h)对大肠杆菌有抑制作用,而BIELECKI等人则观察到较长时间(16~18 h)的抑制作用。这两组实验选用新鲜PRP作为研究对象,作者不能排除因制备方法上的差异导致白细胞的存在以及不同的大肠杆菌浓度对实验结果的影响[19-20]。本研究只在24 h观察到PRP对白色念珠菌生长的抑制作用,而6~18 h冰冻PRP组、冻干PRP组白色念珠菌的数量和质量都高于对照组,这可能与培养基pH值有关,肉汤培养基初始pH值为7.5±0.2,随着白色念珠菌的有氧代谢,培养基pH值下降血小板抗真菌活性增强。YEAMAN等研究表明在pH值=7.2时血小板对真菌抑制作用不明显,而在pH值=5.5时血小板能显著抑制真菌生长[21]。DRAGO等对新鲜PRP的研究指出只有血小板浓度在较高范围,才能观察到PRP对真菌的抑制效果[12]。两组PRP对铜绿假单胞菌未显示出抑菌作用,且细菌计数高于对照组,说明相对于生理盐水,PRP对铜绿假单胞菌的生长有促进作用。
近年来,自体PRP已成为预防或治疗术后急慢性创面感染或骨髓炎的潜在选择。PRP治疗与传统方式相比具有5大优势:(1)PRP治疗能提高慢性伤口的愈合速度以及伤口的完全愈合率[22]。(2)部分药物可增强PRP的抗菌作用,如他汀类药物可提高血小板活化,增强PRP对金黄色葡萄球菌的抗菌作用[23]。(3)PRP发挥抑菌作用的机制有别于抗生素,对MRSA同样具有抑菌作用且病原体不易产生耐药性[24]。(4)在大量微生物定植的慢性伤口,PRP以及激活后的PRP都能穿透抗生素很难穿透的生物膜[25]。(5)PRP可有效预防深度胸骨切口感染。ENGLERT等人指出,与贫血小板血浆相比,在切口闭合前和胸骨连接前使用PRP可有效降低患者感染率[26]。
综上所述,冰冻PRP和冻干PRP不仅具有抑菌、杀菌作用,而且具有特定的抗菌谱和时效性,与文献报道新鲜PRP对相同细菌作用相比,其作用效果更佳,可见冷冻及冻干保存PRP的方式有很好的应用前景。此外,冻干PRP比冰冻PRP更早释放更多的抑菌肽,前者保存条件更方便,有益于战时或紧急情况以及边远地区的使用。
利益冲突所有作者均声明不存在利益冲突。
