血小板添加剂SSP+与血浆保存血小板的对比研究*
2023-01-06卿芸周琼彭楷骆展鹏胡文杰邹海曼毛伟
卿芸 周琼 彭楷 骆展鹏 胡文杰 邹海曼 毛伟
血小板添加剂(platelet additive solution,PAS)储存血小板有许多好处,包括降低血小板输注不良反应的风险,特别是过敏输血反应和输血相关的急性肺损伤(transfusion related acute lung injury,TRALI)[1-2]。此外,还可促进跨越ABO不同血型输注的屏障[3]。对于血液服务机构来说,PAS还可以置换出更多的血浆,并回收运用于其他临床项目[4]。虽然,国内在多年前就开始关注血小板添加剂的研究,但其实目前得到的实验数据并不多[5-8],大多数文章重在探索添加剂的不断优化,但是深入研究经典的PAS更有利于在大多数基层血液服务机构得到推广。此次研究,我们选用了添加剂SSP+(PAS-E),它具有以下2个特点:①选用醋酸盐和磷酸盐,醋酸盐不但能作为血小板代谢的外源性底物,还能以碳酸氢盐的形式维持pH的稳定,磷酸盐则可以提供ATP,维持血小板的高生存力。②钾离子和镁离子的加入可以减少血小板活化,在维持血小板膜的稳定性上起到重要作用[9]。另外,我们注意到新一代添加物主要包括:葡萄糖、钙离子、碳酸氢盐,它们的添加目前都存在争议[10]。笔者参考文献并选择用65%SSP+35%血浆悬浮汇集血小板[11],有文章指出保留少于30%的血浆对血小板形态和基础代谢影响较大[12]。综上,本文选用经典的PAS,建立相对完整且可行的操作方案对其在保存血小板方面的优越性进行研究(与血浆相比较)。我们采用汇集白膜层(buffer coat,BC)的方法制备浓缩血小板,65%SSP+/35%血浆悬浮汇集血小板作为实验室组,100%血浆悬浮汇集血小板作为对照组,在22℃震荡保存血小板的7天时间内,选取d 1,5,7三个时间点,对血小板的形态,功能和代谢水平等体外指标进行检测,报告如下。
材料与方法
1 血液来源 从本站2021年6月2日~6月10日在重庆市街头采集的符合国家《献血者健康检查标准》的无偿献血者全血中,抽取各类血型以6的整数倍选择,共84份(400 mL/份)于室温放置,采集6h内制备浓缩血小板(platelet concentrate,PC)。
2 仪器与试剂 全自动血细胞分析仪X-500i(日本sysmex)大容量冰冻离心机cryofuge 8(美国Thermo),全自动全血成分血离心机 compomat G4(德国 Fresenius Kabi ),无菌导管接驳机TSCD-Ⅱ(日本 Terumo),贮血冰柜(日本 Sanyo),血小板恒温保存箱PC4200h(美国Helmer),Coulter计数仪(美国beckman coulter),7230型分光光度计(上海分析仪器厂),血气仪(德国西门子RP500),流式细胞仪(美国 BD accuri C6 plus),全自动微生物侦测系统 BACT-3D(美国BioMérieux),四联采血袋(山东威高),PFS-PL300型白细胞过滤器(南京双威),血小板贮存袋(美国 Haemonetics),血气测定试剂盒(德国西门子100测试/盒),PECD62p、FITC-CD42b、同型对照PE Mouse IgG1、FITC Mouse IgG1,FITC AnnexcinⅤ apoptosis detection KitⅠ(美国 BD),0.20µm细菌过滤器(美国 Millipore),蒸馏水。
3 产品的制备与贮存 SSP+由本实验室自制,组成成分:柠檬酸三钠10.8 mM, 乙酸钠32.5 mM, 氯化钠69.3 mM, 磷酸钠28.2 mM, 氯化镁1.5 mM, 氯化钾5 mM 溶解至1 000 mL蒸馏水中,调节pH至7.2,用50 mL无菌注射器连接细菌过滤器,最后将过滤后的溶液注入无菌收集袋中,4℃保存。四联袋采集的新鲜全血400 mL,常温保存,4~6 h内重离心,2 283 g,离心15 min。将离心后的全血转入血细胞分离机,将上层血浆分出210 mL至血浆袋,剩余的血浆和白膜层(共约75 mL)转移到空袋,得到的白膜成分袋在(22±2)℃条件下静置过夜。次日将6袋经检验合格的同血型的白膜层通过无菌导管接合机汇集,轻轻混合均匀后轻离心(291 g,12 min)。如果混合浓缩血小板中红细胞残留量较多,则需再次轻离心(145 g,5 min),将最终分离的混合浓缩血小板经滤白处理后, 平均分为两袋(每袋约210 mL),其中一袋血液制剂进行离心(5 313 g,6 min),(135±2) mL的血浆用SSP+替代, 终体积约为210 mL [(73±2) mL血浆和(135±2)mL SSP+]。全部悬浮在血浆中的血小板为对照组,使用35%血浆+65% SSP+悬浮血小板为实验组,最终制得血液制剂14对, 于22℃平行震荡仪内保存。
4 PC中血细胞计数 使用Coulter计数仪测定成对的血液制剂在d 1、5、7的血小板计数,并计算每袋的血小板含量, 同时测定血小板平均体积(mean platelet volume ,MPV)。
5 血小板低渗休克反应(hypotonic shock response,HSR) 使用无菌接驳机留取浓缩血小板样品至2支塑料试管内:其中一支试管经3 000 r/min 离心10 min后的上清液为乏血小板血浆(platelet-poor plasma,PPP),用自身PPP调节另一支试管的血小板浓度至(250~300)×109/L,为富血小板血浆(plateletrich plasma,PRP)。PRP、PPP和蒸馏水均置于37℃保温;PPP与磷酸盐平衡生理盐水(phosphate buffered saline,PBS)以体积2∶1的比例混合后调零,PRP与PBS混合样品15 min时的吸光度值(optical density,OD)为对照OD值,PRP与蒸馏水混合样品15 min时的吸光度值为样品OD值,计算:HSR=[(样品OD值-样品最小OD值)/(对照OD值-样品最小OD值)]×100%。
6 测定代谢产物 保存成对血液制剂的第d 1、5、7,用塑料空针抽样2 mL,立即用血气分析仪检测其pH、pO2(mMHg)、pCO2(mMHg)、葡萄糖(mMol/L)、乳酸(mMol/L)、碳酸氢盐(mMol/L)的含量。
7 血小板活化和凋亡检测 采用流式细胞仪检测CD62p表达量:将PC用PPP调至浓度约200×109/L,设空白管(5 μL稀释后的PC),同型对照管(5 μL稀释后的PC+10 μL PE Mouse IgG1 和5 μL稀释后的PC+10 μL FITC Mouse IgG1) 和待测管(5 μL稀释后的PC+10 μL PE-CD62p+10 μL FITC-CD42b),室温避光、孵育30 min,重悬在500 μL PBS,用流式仪分析。血小板凋亡实验:血小板用1×Bingding buffer重悬为1×107/L,取3 μL稀释后的PC+5 μL FITC AnnexinⅤ到试管中,轻轻混匀,室温避光,孵育15 min,用400 μL 1×Bingding buffer重悬,用流式仪分析。
8 无菌试验 于保存期d 7取本品样本20 mL接种到细菌培养系统中, 培养需氧菌和厌氧菌7 d。
9 统计学分析 数据根据正态性检验结果采用均数±标准差表示。数据分析采用SPSS 25.0(SPSS Inc,Chicago,IL,USA)软件,为了确定组内(血浆组或SSP+组)不同时间点与初始值差异是否有统计学意义,比较两组间(血浆组和SSP+组)在各个不同时间点(1,5,7 d)之间差异是否有统计学意义,采用了重复测量方差分析检验,P<0.05认为差异有统计学意义。用Origin 9.0软件进行作图。
结 果
1 血浆组和血小板添加剂SSP+组血小板部分参数对比 血浆组和血小板添加剂SSP+组在血小板容量,含量和浓度的分组主效应差异无统计学意(P>0.05),两组时间主效应差异有统计学意义(P<0.05),两组各个时间点与第1天相比差异都有统计学意义(P<0.05),分组×时间无显著交互作用(P>0.05)。MPV的分组主效应差异无统计学意义(P>0.05),两组时间主效应差异有统计学意义(P<0.05),两组分别在第7天与第1天相比差异有统计学意义(P<0.05),分组×时间无显著交互作用(P>0.05)。血小板保存期间pO2升高,同时pCO2是下降的。两组在pO2的升高程度相似,但pCO2下降程度在分组主效应上差异有统计学意义(P<0.05),分组×时间有显著交互作用(P<0.05),各个时间点血浆中pCO2都高于血小板添加剂SSP+组,同时血浆中pCO2的初始值也是相对较高的。所有样品在实验的第7天都做了无菌实验,结果显示需氧菌和厌氧菌在培养7 d后均为阴性。
2 血浆组和血小板添加剂SSP+组血小板pH值和部分生化参数比较 血小板添加剂SSP+组的pH值与血浆组相比,分组主效应差异有统计学意义(P<0.05)(表1,图1A),两组的第7天与第1天相比差异均有统计学意义(P<0.05),分组×时间无显著交互作用(P>0.05)。碳酸氢盐的浓度在不同介质中都呈现下降的趋势,血浆组碳酸氢盐的下降速率(0.94 mM/d)显著高于血小板添加剂SSP+组(0.23 mM/d)(表1,图1B)。血浆组血小板消耗葡萄糖速率(0.97 mM/d)高于血小板添加剂SSP+组(0.57 mM/d)(表1,图1C)。相应的,乳酸含量的增加速率是相似的,血浆组和血小板添加剂SSP+组分别为(1.51 mM/d)和(1.01 mM/d)(表1,图1D)。葡萄糖、乳酸和碳酸氢盐的浓度在血浆中的初始含量都高于血小板添加剂SSP+组。
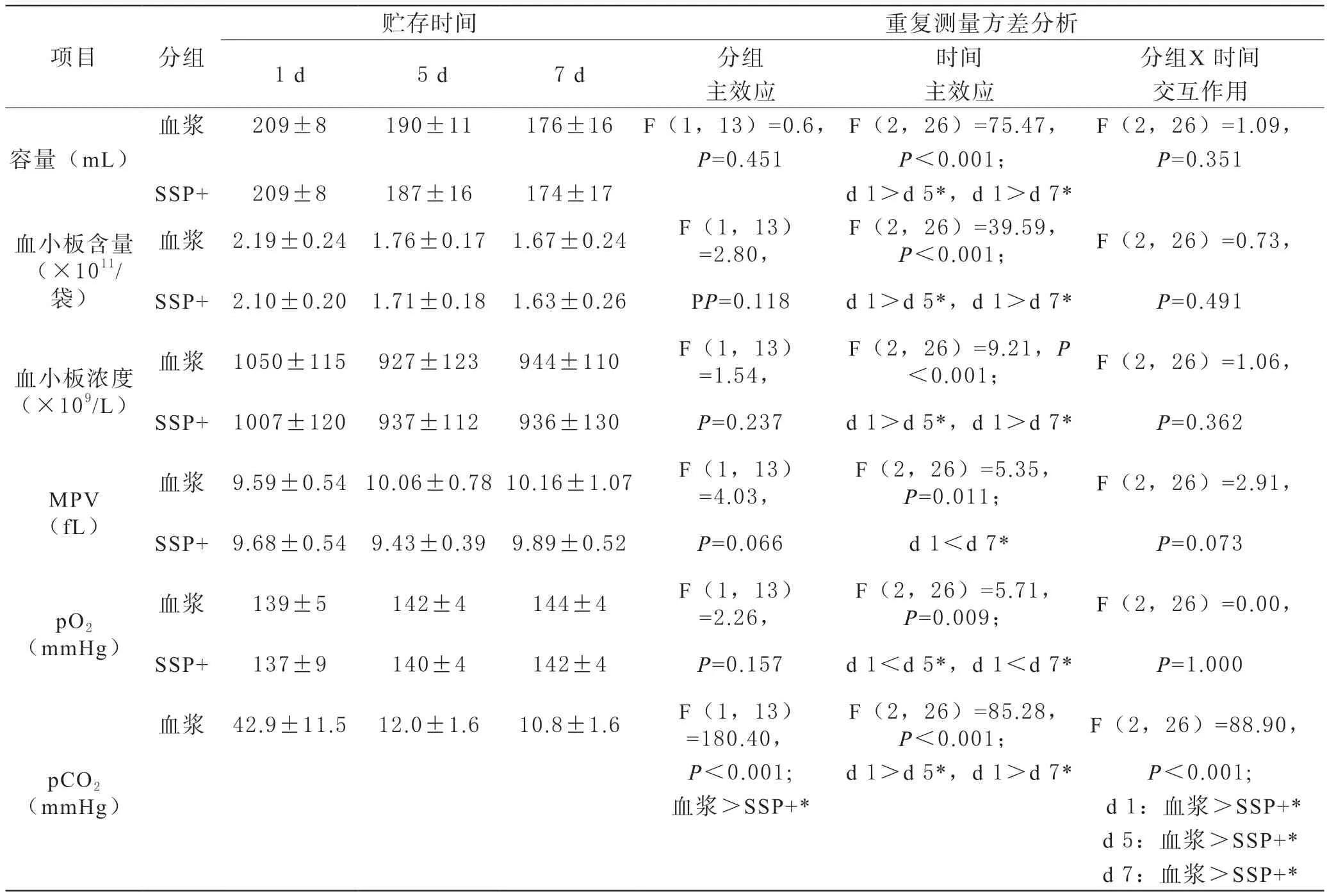
表1 7天保存期间血浆组和血小板添加剂SSP+组血小板参数对比 (n=14)

续表1

图1 血浆组和血小板添加剂SSP+组血小板pH值和部分生化参数比较
3 血浆组和血小板添加剂SSP+组血小板细胞功能和表面表达的比较 血小板保存在不同介质中HRS都呈现下降的趋势, 血小板添加剂SSP+组中HRS与血浆组相比的分组主效应差异有统计学意义(P<0.05),组内各个时间点与第1天相比差异都具有统计学意义(P<0.05),分组×时间无显著交互作用(P>0.05)(表1,图2A)。血小板活化指标CD62p一直上升,分组×时间有显著交互作用(P<0.05),两组在保存的第5天和第7天均显著高于第1天,同时两组在第7天时差异有统计学意义(P<0.05)(表1,图2B)。血小板凋亡指标AnnexinⅤ和CD62p有着相似的升高趋势,两组的分组主效应差异有统计学意义(P<0.05),组内各个时间点与第1天相比差异有统计学意义(P<0.05),但分组×时间无显著交互作用(P>0.05)(表1,图2C)。

图2 血浆组和血小板添加液SSP+组血小板细胞功能和表面表达的比较
讨 论
血小板保存期的质量标准主要有血小板的pH变化,代谢、形变指标以及血小板的活化率。本研究通过建立相对完整且可行的操作方案,比较了经典血小板添加剂SSP+和血浆体外储存汇集血小板的质量。结果表明,在保存的7天时间内,添加剂SSP+在血小板代谢、活化、凋亡方面都比血浆组具有更好的体外指标。
随着保存时间的延长,血小板在不同介质中其浓度,容量和含量在第5天和第7天时间内均有明显的下降,这是不可避免的。在血浆组中血小板MPV出现轻微的升高,而添加剂SSP+组的MPV相对稳定,这可能是因为添加剂SSP+组中的可溶性蛋白含量低于血浆组,蛋白质相互作用改变了血小板的渗透平衡,而添加剂SSP+组这一点较血浆中不明显。pO2和pCO2反映血小板的代谢和存活能力,相对高的pO2和相对低的pCO2利于维持pH值的稳定。在pO2上两组没有差异,由于在血浆中pCO2的起始值较高,没有可比性。
在其他类似的研究中,血浆组和添加剂SSP+组的pH值都在存储初期增加,随后在后期下降的趋势[13-14],但在我们的研究中,这一模式仅适用于添加剂SSP+组。就pH值的波动情况来说,添加剂SSP+组的pH值相对稳定,这可能是因为添加剂SSP+组具有较低的糖酵解速率,乳酸的产生速率保持在其缓冲能力范围内。H+通过与HCO3-缓冲维持介质的pH值,SSP+中HCO3-的消耗量明显较少,也可以从侧面说明其pH值较稳定。血小板通过无氧呼吸消耗葡萄糖会产生两个等量的乳酸,根据葡萄糖消耗和乳酸产生的速率,大致符合(图1C,1D)。添加剂SSP+组配方中不含葡萄糖,但在保存的7天时间内还没有出现葡萄糖消耗完全的情况。血浆组中葡萄糖消耗率(0.97 mM/天)接近添加剂SSP+组葡萄糖消耗率(0.57 mM/天)的2倍。血浆中血小板较高的葡萄糖消耗率表明其需要较高的能量(如:血小板的主动运输或信号转导)。在添加剂SSP+组中血小板较低的葡萄糖消耗率表明其能量需求是较低的。
HSR(低渗性休克反应水平)表示压力下血小板的能量储备和完整性[15]。添加剂SSP+组和血浆组中都呈现下降的趋势,在7天保存时间内添加剂SSP+组表现更好,这是SSP+中添加的磷酸盐,钾离子和镁离子带来的优势[16]。血小板活化通常与代谢率增加有关, 随着葡萄糖的消耗、乳酸的产生和释放的α颗粒可增加血小板的P-选择素(CD62P)释放到细胞表面,CD62P是血小板在储存过程中被激活的标志之一[13]。添加剂SSP+组在第1天时表达略高于血浆组,这可能和在制作加入添加剂的混合浓缩血小板时需要更加频繁的操作相关,我们发现血浆组中CD62P的表达在保存5天以后有一个明显的上升,这一现象在添加剂SSP+组中没有出现,这可能和血小板的失活直接相关。血小板的凋亡与血小板的活化关系密切,所以有相似的趋势,在7天保存时间内添加剂SSP+组表现更好。
目前,我国临床应用的血小板主要是单采血小板,手工混合浓缩血小板在临床应用中所占的比例很小。浓缩血小板从全血分离而来,可通过献血的方式获得。所以它与单采血小板相比,来源更为多样化,更有利于缓解我国血液资源紧张的现状。在此基础上,两种血小板制剂都可以添加PAS,单采血小板PAS的添加由成分血单采机自动完成,浓缩血小板由手工完成。前者污染机会更少并节约人工成本,后者主要是节约血液资源。两种添加PAS的血小板制剂在国外均有运用并效果良好,尤其是添加PAS的混合浓缩血小板在临床应用中占有更大比例[17-18]。我国目前没有使用PAS作为血小板的悬浮介质,也没有相应的标准。国内对于血小板添加剂的研究虽然开展得比较早,但实际得到的实验数据有限,在不同程度上存在标本量过小,一些重要的血小板检测指标缺失,阴性对照缺失等问题,因此降低了实验数据的可信度。本文通过对经典的PAS的研究,提高实验设计的合理性,完善相关检测指标,从而建立起相对完整且可行的操作方案,希望为广大输血同行提供参考,为有关部门制定关于特殊技术保存血小板制品的标准提供可靠的实验数据支持。
利益冲突所有作者均声明不存在利益冲突
