固相萃取/超高效液相色谱-串联质谱法测定儿童化妆品中新康唑等4种抗生素
2023-01-05聂明霞梁文耀李鑫宇文嘉林夏泽敏谭建华
汪 毅,聂明霞,贾 芳,梁文耀,李鑫宇,文嘉林,夏泽敏,谭建华
(广州质量监督检测研究院,国家化妆品质量检验检测中心,广东 广州 511447)
近年来,关于儿童化妆品中激素、抗生素等药物非法添加的报道频出,儿童化妆品的质量安全问题已成为大众的关注焦点。相关研究表明,不规范使用抗生素类药物容易造成过敏性皮炎、肝功能损伤等不良影响,并使人体产生耐药性[1-3],其中儿童是抗生素滥用中的最大受害者[4-6]。笔者在使用高分辨质谱筛查化妆品中禁用物质的日常工作中发现,市场上一些儿童化妆品(主要是婴幼儿护肤膏)存在新康唑等抗生素非法添加情况。新康唑等并不在此前的一些化妆品相关规范和标准[7]规定的抗生素检验方法范围内,虽然目前一些药物或土壤中此类化合物的测定方法已有文献报道[8-9],但化妆品与这些基质差异较大,已有方法无法直接应用于化妆品中相关化合物的测定。因此亟需建立高灵敏、快速且能同时分析新康唑等多种组分的测定方法[10],为相关监管工作提供技术支撑。
液相色谱-质谱联用技术是抗生素分析检测的有效技术手段[11-13],但由于许多样品在分析过程中存在基质抑制现象,因此需要进一步净化。新康唑、硫康唑、抑霉唑、噻康唑是咪唑类衍生物[14],脂溶性较强,且此类化合物咪唑环上的吡啶N碱性较强,因此本文使用强阳离子交换SPE小柱去除杂质,消除基质抑制,使目标物获得了良好回收率。本文建立的化妆品中新康唑等4种禁用物质[7]的超高效液相色谱-串联质谱检测方法,将有效填补抗生素检验方法的缺口,对保障消费者特别是儿童群体的权益和健康具有重大意义。
1 实验部分
1.1 仪器与试剂
岛津液相色谱仪-SCIEX AB 5500+三重四极杆质谱仪(日本岛津与美国SCIEX公司);BSA224SCW电子天平(德国赛多利斯公司);MS3 basic涡旋振荡器(德国IKA公司);KQ-250DV型数控超声波清洗仪(昆山市超声仪器有限公司);Milli-Q纯水系统(美国Millipore公司);固相萃取系统(上海安谱科学仪器有限公司);强阳离子交换小柱(200 mg,3 mL,上海安谱科学仪器有限公司)。
抑霉唑(纯度99.2%,CAS:35554-44-0,美国Dr.Ehrenstorfer公司);新康唑(纯度98.0%,CAS:67914-69-6)、噻康唑(纯度99.1%,CAS:65899-73-2)(美国CATO公司);硫康唑(纯度95.0%,CAS:61318-90-9,美国Aladdin公司);甲醇、乙腈(色谱纯,德国Merck公司);甲酸(分析纯,上海安谱科学仪器有限公司);实验用水(18.2 MΩ·cm)由Milli-Q纯水系统制备。
1.2 标准溶液的配制
分别精密称取4种对照品10 mg,使用乙腈溶解,配制成质量浓度1 mg/mL的标准储备溶液,4℃保存。分别取适量标准储备溶液用70%乙腈稀释,配制成10 mg/L的标准中间液。取适量标准中间液,用70%乙腈稀释成0.1、0.2、0.5、2、5、10、20、50、100 μg/L的系列标准混合溶液。
1.3 样品前处理
称取样品0.2 g(精确至0.001 g)于10 mL具塞比色管中,加入2 mL 70%乙腈水溶液(甲酸调至pH 3.0),涡旋30 s使样品分散,再定容至刻度,涡旋30 s后,超声提取15 min。取样液6 mL于10 mL塑料离心管中,6 500 r/min离心10 min。
取强阳离子交换固相萃取小柱,分别用5 mL甲醇和10 mL超纯水活化,取离心上清液4 mL加入固相萃取柱,使其自然流下,用4 mL 2%甲酸水淋洗柱床后,再用4 mL含10%异丙醇的乙腈溶液淋洗柱床,洗耳球挤干后用4 mL含10%异丙醇的乙腈溶液(含2%氨水)洗脱目标物,收集流出液,过0.22 μm滤膜后待测。
1.4 仪器分析条件
色谱条件:Waters ACQUITY BEH C18柱(2.1 mm×100 mm,2.5 μm);流动相:A相:0.1%甲酸水,B相:乙腈;流速:0.3 mL/min;进样量:3 μL;柱温:40℃;梯度洗脱程序:0~7 min,20%~50%B;7~9 min,50%B;9~9.1 min,50%~90%B;9.1~12 min,90%B。
质谱条件:离子源为电喷雾离子源(ESI源);监测模式为正离子多反应监测(MRM);离子化电压4 500 V;气帘气压力137.8 kPa;喷雾气压力344.7 kPa;碰撞气压力62.1 kPa;离子源温度450℃;监测离子对、碰撞电压(CE)和去簇电压(DP)等参数见表1。

表1 4种抗生素的质谱参数Table 1 Mass spectrometric parameters of 4 antibiotics
2 结果与讨论
2.1 方法建立
2.1.1 色谱柱的选择4种抗生素的logP值在3.58~5.66之间,在C18色谱柱上均有较好的保留,因此考察了Waters ACQUITY HSS C18(2.1 mm×100 mm,1.8 μm)、Waters ACQUITY BEH C18(2.1 mm×100 mm,2.5 μm)、Agilent Poroshell 120 SB C18(2.1 mm×100 mm,2.7 μm)、Phenomenex Kintext C18(3 mm×100 mm,2.6 μm)几种不同品牌规格的C18色谱柱对化合物的分析效果。结果显示各化合物在不同的C18色谱柱上均能得到有效分离,且在Waters ACQUITY BEH C18柱上的峰形更加尖锐对称,因此用该柱进行后续分析。
2.1.2 流动相的选择比较了水-乙腈、水-甲醇两种流动相体系对4种抗生素的色谱分离效果。结果显示,水-乙腈体系的洗脱能力更强,峰形更加尖锐。比较了10 mmol/L乙酸铵和0.1%甲酸两种不同流动相添加剂对色谱峰的影响,发现流动相中添加0.1%的甲酸时,能通过降低pH值使化合物离子化,有效提高化合物的响应强度。因此,确定0.1%甲酸水-乙腈作为流动相。
2.1.3 质谱条件的优化在MS Only模式下,将200 μg/L的混合标准溶液通过针泵注入质谱。调整质谱条件和扫描模式,获取化合物的母离子和子离子信息。在负离子模式下,4种化合物均无信号,而在正离子模式下能获得信号强度较高的母离子。这是因为咪唑环上的吡啶N碱性较强,极易结合H+带正电,因此使用正离子模式进行分析。通过优化碰撞能、去簇电压和离子源温度等参数,获得强度较高且稳定的化合物响应。
设置400、450、500、550℃4个离子源温度,在正离子模式下对混合标准溶液进行分析,温度升至450℃后,新康唑的信号强度有所降低,其他3种化合物响应强度几乎无变化。因此,离子源温度设置为450℃。
2.2 前处理方法优化
2.2.1 提取溶剂的选择乙腈水溶液对化妆品具有较好的分散、提取效果,通常用于化妆品中各类激素等物质的测定[2,8]。本文以乙腈水溶液为提取溶剂,并比较了不同乙腈含量(10%、20%、30%、40%、50%、70%、90%)对4种抗生素的提取效果。如图1所示,随着乙腈含量从10%升高到90%,新康唑、硫康唑和噻康唑的回收率逐渐升高后降低:乙腈含量大于30%后化合物的回收率超过70%,当乙腈含量达到90%后,部分目标物的回收率低于20%;抑霉唑在各含量提取溶剂中的回收率均低于70%,达不到分析要求。可能原因是目标化合物脂溶性较强,使用高含量有机溶剂提取时,存在大量的防腐剂、表面活性剂等共提物,影响了目标物的离子化效率,产生严重的基质效应。为此,本研究进一步对基质效应进行确认。选取一阴性膏霜样品0.2 g,使用10 mL 70%乙腈水超声提取15 min,离心后取上清液加入一定体积的混合标准溶液(各目标物最终质量浓度为10 μg/L),将相同浓度的溶剂混合标准溶液和基质标准溶液上机分析。以基质标液中化合物响应值/溶剂标液中化合物响应值计算基质效应。实验结果显示,新康唑、硫康唑、抑霉唑、噻康唑的基质效应分别为0.52、0.51、0.95、0.64,即化合物受到不同程度的基质抑制。因此需要进一步对70%乙腈水提取的样品进行净化处理以获得符合分析要求的回收率。

图1 4种抗生素在不同含量乙腈中的提取回收率Fig.1 Extraction recoveries of 4 antibiotics in different proportions of acetonitrile
2.2.2 固相萃取小柱的选择HLB固相萃取小柱的基质是含有亲脂性二乙烯苯的大孔共聚物,在pH 1.0~14.0范围内非常稳定,对非极性至中等极性的酸性、中性、碱性化合物均有较好的回收率,适用范围广。考虑到目标化合物的脂溶性和弱碱性,使用HLB小柱对样品进行净化,将净化后的样液上机分析。结果显示,新康唑的回收率低于50%,可能是因为HLB小柱不能将目标物与杂质分离,未能有效消除基质效应。同时,由于HLB小柱对目标物的反相保留太强,导致部分目标物难以从柱上完全洗脱,影响回收率,因此HLB小柱不适合用于4种抗生素的净化。
SCX小柱的官能团为苯磺酸,提取目标物时磺酸基团显示阳离子交换性质,而苯环显示非极性吸附性质。新康唑、硫康唑、抑霉唑、噻康唑为弱碱性化合物,pKa值分别为6.88、6.55、6.53和6.66,当溶液的pH值小于4.0时,化合物能够完全离子化,与苯磺酸根结合,在柱上保留,用中性溶剂淋洗小柱即能去除中性和酸性共提物,达到净化作用。因此使用SCX小柱净化样品。将净化后的样液上机测试,结果如图2所示。经SCX小柱净化后,目标化合物的回收率较未净化样品显著提高,新康唑的回收率更是从54.1%上升至96.3%。SCX小柱能有效净化样品,使化合物回收率满足方法需求,因此选择SCX小柱做进一步方法优化。
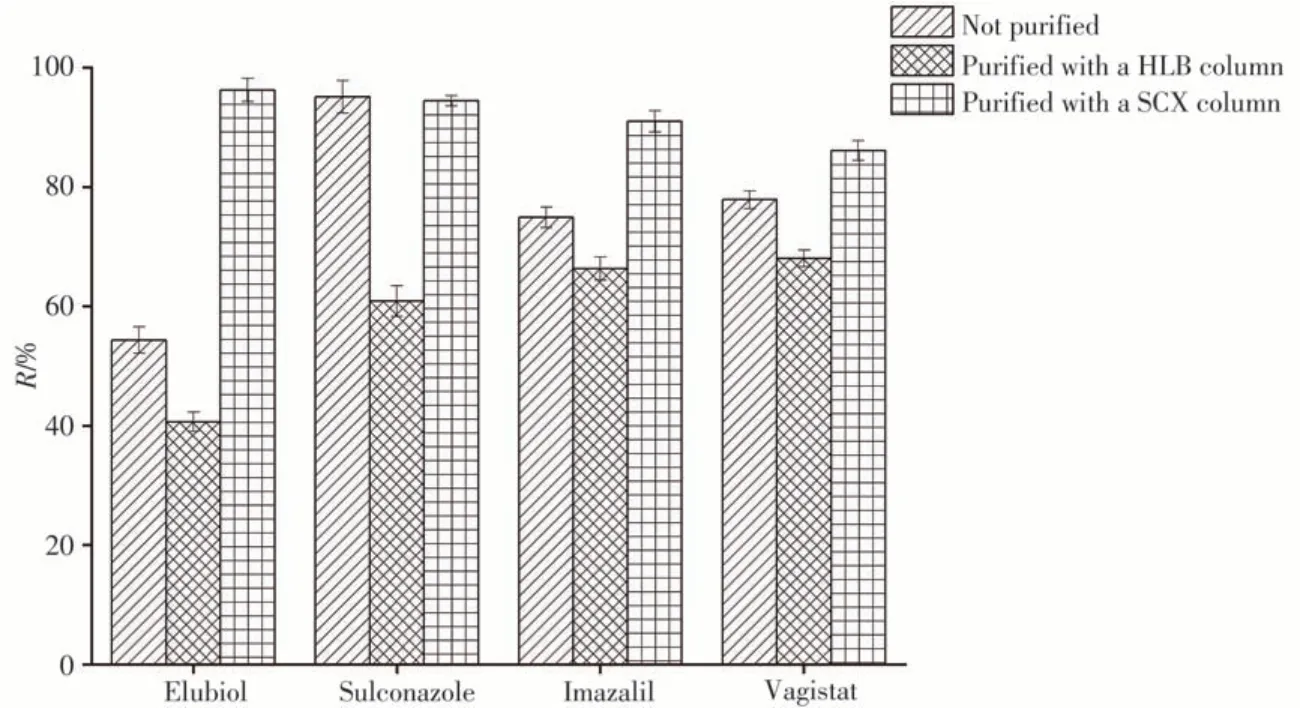
图2 4种抗生素使用不同固相萃取小柱净化后的提取回收率Fig.2 Extraction recoveries of 4 antibiotics purified with different solid phase extraction cartridges
2.2.3 洗脱溶剂的选择采用4 mL含2%氨水的乙腈溶液对淋洗后的柱床进行洗脱,收集洗脱液上机测试。结果显示新康唑、抑霉唑和噻康唑的回收率良好,硫康唑的回收率为75%,相对较低。继续对柱床洗脱,第5 mL的洗脱溶液中仍有硫康唑检出。可能是由于SXC小柱有阳离子交换和非极性吸附双重作用,使得logP值较高的硫康唑难以洗脱,因此应选择极性更低的洗脱溶液。使用4 mL含10%异丙醇的乙腈(2%氨水)溶液洗脱目标物,收集洗脱液上机测试,发现硫康唑的回收率提高至80%以上,因此选择该溶剂为洗脱溶剂。
2.3 线性关系、检出限及定量下限
配制系列混合标准溶液进行测定,以目标物的峰面积(Y)对相应的质量浓度(X,μg/L)进行线性回归,得到各化合物的标准曲线方程。结果表明4种抗生素在其质量浓度范围内线性良好,相关系数(r)均为0.999。以3倍信噪比计算方法检出限(LOD),以10倍信噪比计算方法定量下限(LOQ),得到4种抗生素的LOD和LOQ分别为0.005~0.250 μg/g和0.010~0.500 μg/g(表2)。结果表明,4种抗生素的线性关系良好,方法的检出限和定量下限均可满足化妆品的检测需要。

表2 4种抗生素的线性关系、检出限和定量下限Table 2 Linear relationships,LODs and LOQs of 4 antibiotics
2.4 回收率及相对标准偏差
选取3种典型化妆品(水、乳液、膏霜)作为加标基质,分别按照1倍、2倍和10倍定量下限进行低、中、高3个浓度水平的加标回收实验,按照本方法进行前处理和测定,每个浓度水平平行测定6次,计算得到4种抗生素的平均回收率为89.3%~113%,相对标准偏差(RSD)为0.90%~7.2%(表3),满足准确度和精密度要求。
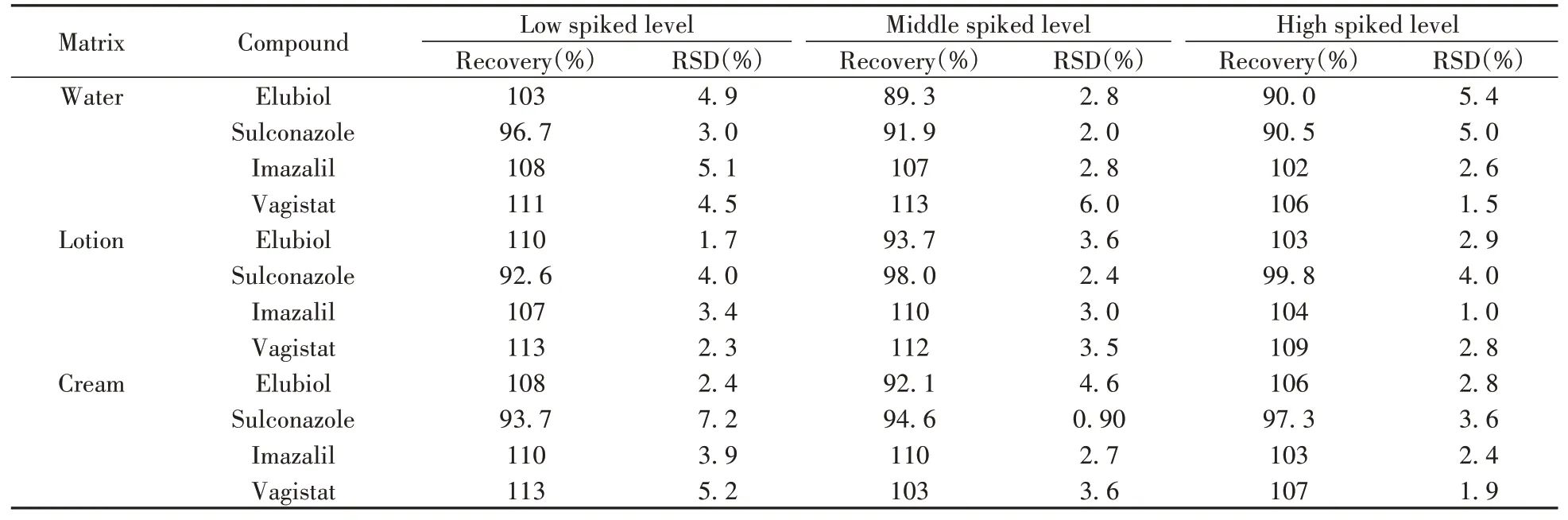
表3 4种抗生素的回收率和相对标准偏差(n=6)Table 3 Recoveries and RSDs of 4 antibiotics(n=6)
2.5 实际样品测定
对市面上销售的100多个批次的水、乳、膏霜使用上述方法进行测定,结果在4个批次产品中检测出新康唑,含量范围为0.24~1.25×104mg/kg,主要为儿童护臀霜产品。图3为阳性样品谱图。

图3 新康唑阳性样品的提取离子色谱图Fig.3 Extraction ion chromatogram of an elubiol positive sample
3 结论
通过优化前处理条件和仪器方法建立了测定儿童化妆品中新康唑等4种抗生素的固相萃取/超高效液相色谱-串联质谱法,基于该类化合物咪唑环上吡啶N有较强碱性的特点,用强阳离子交换SPE小柱去除共提物,获得了较好回收率。该方法高效、准确、特异性好,能够为化妆品相关质量监管提供有效的技术支持。目前,虽然新康唑在儿童化妆品中存在非法添加事实,但缺少相关检出情况的报告及检验方法,还处于监管盲区。在此呼吁相关监管部门扩大儿童化妆品中抗生素的监测范围,防止不法分子利用监管漏洞非法牟利,危害儿童健康。
