磁性侧流层析技术在食品污染物快速检测中的研究进展
2023-01-05翟文磊韩晨瑞韦迪哲肖志勇
翟文磊,韩晨瑞,4,韦迪哲,肖志勇,孔 聪,王 蒙*
(1.北京市农林科学院质量标准与检测技术研究所,北京 100097;2.北京市农产品质量安全中心,北京 100029;3.中国水产科学研究院东海水产研究所,上海 200090;4.中国农业大学食品科学与营养工程学院,北京 100083)
侧流层析法(Lateral flow assay,LFA)是一种基于层析原理建立的快速检测技术。以条状纤维为固相,借助毛细管作用使样品在试纸条上移动,样品中的目标物与试纸条上一定区域的生物活性材料(抗原/抗体/核酸适配体等)特异性结合,依据信号的变化实现定性、定量检测[1]。试纸条一般由样品垫、结合垫、层析膜、吸水垫和辅助结构组成,层析膜上固定两条或多条不同的生物活性材料构成检测线(T线)和质控线(C线)。LFA克服了传统检测技术步骤繁琐、耗时长、成本高、依赖大型仪器等问题,具有操作简单、快速实时、成本低等优点,适用于对特定目标物的现场快速筛查[2]。
磁性纳米材料经化学修饰后具有良好的水分散性和稳定性,已被广泛应用于多种物质的磁分离浓缩和检测[3]。将具有强磁性和单分散性的磁性纳米材料与LFA试纸条相结合,能显著提高检测方法的灵敏度、稳定性和重复性。近年来,磁性侧流层析法(Magnetic lateral flow assay,MLFA)的开发逐渐成为LFA领域的研究热点之一,在食品安全领域具有广阔的应用前景[4]。图1是在Web of Science数据库上以“Magnetic lateral flow assay”为主题词的检索结果,可以看出,该方向论文的发表量呈逐年递增的趋势,表明相关研究已受到越来越多的关注。本文重点介绍近五年MLFA技术在食品安全领域的应用研究进展,根据检测对象种类,分别从食源性致病微生物和小分子危害物质残留的检测两个方面进行总结,并从技术原理、检测性能、材料特点等方面展开讨论,为相关领域的科研单位、市场监管部门和生产企业提供参考。

图1 Web of Science数据库上以“magnetic lateral flow assay”为主题词检索相关文献按出版时间的统计结果,统计时间截止至2022年6月Fig.1 The data of new publications of MLFA in each year obtained by searching terms“magnetic lateral flow assay”in Web of Science database,the date was until June,2022
1 磁性纳米材料
1.1 Fe3O4免疫磁珠
磁性纳米颗粒(Magnetic nanoparticles,MNPs)是尺寸为纳米级别的磁性材料,以Fe3O4纳米颗粒为代表。经表面功能化修饰后的MNPs在外磁场作用下可实现快速分离和富集,高效简便,适用于样品检测中的前处理[5-6]。
目前研究大多采用碳化二亚胺(EDC-NHS)接枝法将抗体修饰在MNPs表面,得到免疫磁珠用于目标物的快速分离与富集[7]。结合了待测物的免疫磁珠经试纸条层析后,根据试纸条上T线和C线的颜色对比进行定性检测。通过建立目标物浓度与T线和C线上光密度或磁信号强度的关系,实现定量检测。
1.2 多功能磁性纳米复合物
单一的Fe3O4免疫磁珠虽然应用广泛,但信号输出方式单一。通过将MNPs与贵金属、量子点等纳米材料进行复合,可制备出兼具磁分离富集和信号输出双功能的纳米探针,更好地满足MLFA应用的需求。
将MNPs与金纳米颗粒(AuNPs)结合的金磁纳米复合物,既部分保留其超顺磁性,又能增强其稳定性、电导率、光学性能和表面生物相容性。应用于试纸条中的金磁纳米颗粒通常为“金包磁”核壳结构[8],通过自组装或种子生长法将AuNPs包裹在MNPs表面,再修饰抗体得到功能化金磁纳米颗粒。利用AuNPs的光学特性,通过比较试纸条T线和C线上的颜色变化可实现可视化检测。此外,还可利用AuNPs本身的表面增强拉曼散射(SERS)活性,在其上修饰探针分子进行SERS检测,提高灵敏度。另一方面,近期也有少量研究通过构建“磁包金”核壳结构[9],获得兼具超顺磁性和等离子体活性的复合纳米材料用于血清等复杂生物样品中特定物质的MLFA分析。
另一类可与MNPs复合的纳米材料是量子点(QDs),通过静电组装等方法在MNPs上包裹QDs,得到磁性和荧光双功能纳米球[10-11]。利用该材料可在MLFA试纸条上实现荧光定量分析,且标记不同发射波长的QDs可实现对数个目标物的同步检测,在多靶标检测中具备优势[12]。值得注意的是,除了AuNPs和QDs,近期也有将纳米酶等材料与MNPs复合用于MLFA的研究报道[13],利用特有的类酶催化活性可实现更灵敏的分析,也为MLFA的发展提供了更多样化的检测模式。
2 MLFA用于食源性病原菌检测
食源性病原菌是影响食品安全的重要风险因子之一,常见的食源性病原菌包括大肠杆菌O157∶H7(E.coliO157∶H7)、肠炎沙门氏菌(S.enteritidis)、伤寒沙门氏菌(S.typhi)、单增李斯特菌(L.monocytogenes)、霍乱弧菌(V.cholerae)、致病性副溶血性弧菌(V.parahaemolyticus)等[14]。这些细菌一般具有多抗原位点,MLFA中一般采取双抗体夹心法,即结合垫或预处理时加入经标记的待测物的单抗1,T线固定识别待测物不同抗原位点的单抗2或多抗,C线固定抗种属特异性的二抗,利用T线和C线特定信号强度的变化实现定量检测。
2.1 E.coli O157∶H7
E.coliO157∶H7是肠出血性大肠杆菌的代表菌株,是引起出血性结肠炎的主要致病菌,很少量菌数的E.coliO157∶H7即可引发感染[15]。由于其严重危害,针对食品中E.coliO157∶H7的检测显得尤为重要。传统的检测方法包括增菌培养、LFA、酶联免疫分析、聚合酶链反应(PCR)等[16]。由于在样品前处理和检测灵敏度上的优势,MLFA近几年也被用于E.coliO157∶H7的快速检测。
Dou等[13]提出了一种非标记和双信号输出的病原菌检测方法。如图2A所示,通过制备聚多巴胺包裹的磁珠,并在其表面修饰铂纳米酶,得到Fe3O4@PDA@Pt复合纳米材料。通过聚多巴胺与细菌细胞壁的粘附作用,该纳米材料可附着在细菌表面(见图2B)。当被标记的细菌通过试纸条上修饰了抗体的T线时,待测细菌被抗体特异性捕获,通过纳米材料在T线上的聚集变色实现可视化分析。此外,复合纳米材料表面的铂纳米酶具有类似过氧化物酶的催化活性,可催化显色反应,进一步提高检测灵敏度(见图2C)。该方法在目测和显色模式下对E.coliO157∶H7的检出限(LOD)分别为102和10 CFU/mL,实现了饮用水和鸡肉样品的快速灵敏检测。
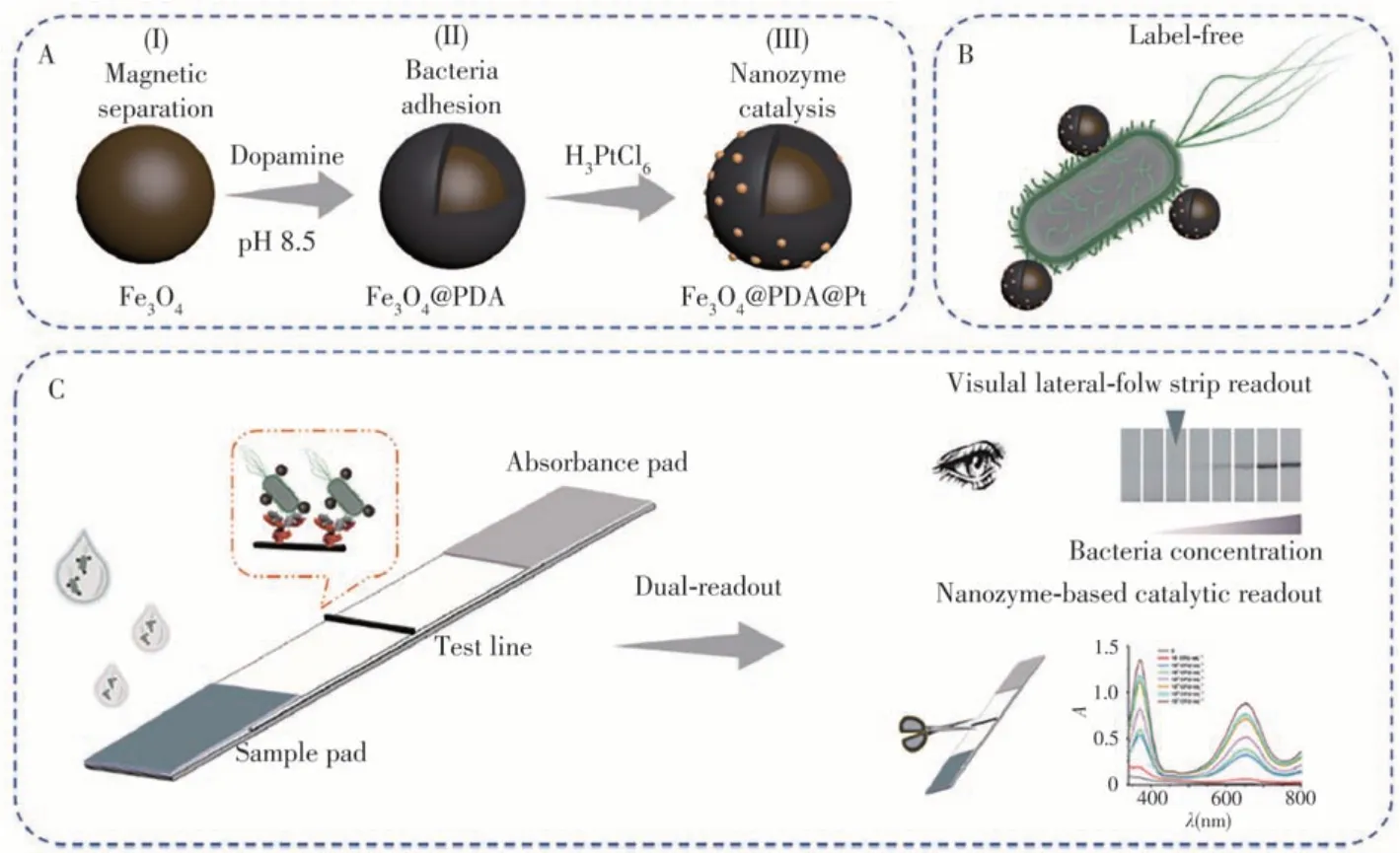
图2 多功能Fe3O4@PDA@Pt纳米复合物的制备(A);基于纳米复合物和E.coli O157∶H7互作的非标记策略(B);利用多功能纳米复合物和侧流免疫层析试纸条实现E.coli O157∶H7双模式检测的原理示意图(C)[13]Fig.2 Preparation process of the Fe3O4@PDA@Pt nanocomposite(A);label-free strategy based on the interaction of nanocomposite and E.coli O157∶H7(B);schematic illustration of the multifunctional nanocomposite mediated dual-readout LFA strip for E.coli O157∶H7 detection(C)[13]
Huang等[17]开发了基于免疫磁珠的MLFA方法用于E.coliO157∶H7的检测。首先制备了抗体修饰的Fe3O4@SiO2@QDs核壳结构荧光磁珠,该材料在待测溶液中可选择性结合E.coliO157∶H7,经外加磁场富集后,在免疫层析试纸条上进行检测。Ilhan等[18]利用免疫磁珠对待测溶液中的E.coliO157∶H7进行富集和纯化,同时制备抗体修饰的SERS探针并预先包埋在试纸条的结合垫上,当纯化后的样品溶液经过时,E.coliO157∶H7被SERS探针标记,根据T线和C线上SERS信号的强度实现定量检测。
2.2 沙门氏菌
近几年,因沙门氏菌感染引发的食物中毒事件时有发生。该病原菌不仅能感染禽畜导致发病死亡,造成严重的经济损失,且人食用被污染的禽畜产品后,会导致急性肠胃炎等病症[19]。为有效防范因其造成的食品安全事件,相关部门开展了大量沙门氏菌快检方法的研究。
Hu等[20]报道了一种基于MLFA的病原菌快速灵敏检测方法,实现了可视化、荧光和磁信号三种不同模式的信号输出。如图3所示,首先,利用抗体标记的Fe3O4@QDs磁珠对伤寒沙门氏菌进行分离和富集,然后滴加在样品垫上,通过免疫层析试纸条进行分析。磁分离的引入提高了该方法的抗干扰能力和灵敏度,通过可视化和磁信号两种模式,对该病原菌的检测灵敏度分别为1.88×104和3.75×103CFU/mL。此外,通过荧光和磁信号两种模式,可在1.88×104~1.88×107CFU/mL范围内实现定量检测。以自来水、牛奶、胎牛血清和全血作为基质,证实了该方法可满足复杂基质中伤寒沙门氏菌的快检需求。
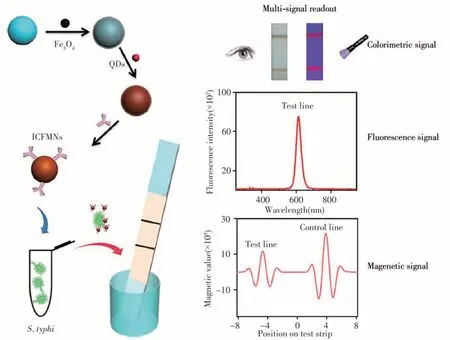
图3 基于比色-荧光-磁性多功能纳米球和侧流免疫层析法的伤寒沙门氏菌多模式检测原理示意图[20]Fig.3 Illustration of multi-signal readout detection of S.typhi by colorimetric-fluorescent-magnetic nanospheres based LFA[20]
Wang等[21]提出了一种非标记的侧流免疫层析法用于肠炎沙门氏菌的现场检测。以类石墨相氮化碳(g-C3N4)为原料,经煅烧和蚀刻得到表面带正电荷的富含氮的碳点。该碳点可通过静电作用吸附在病原菌上,通过在T线上包埋特异性抗体,可将被标记的肠炎沙门氏菌捕获,导致T线颜色逐渐加深,实现了对低至102CFU/mL目标病原菌的可视化检测,且在不同的蔬菜沙拉和果汁加标样品中均得到较好的回收率。此外,该课题组还开发了一种双识别策略的MLFA技术,用于肠炎沙门氏菌的快速检测[22]。分别选用抗生素和抗体作为目标病原菌的识别元件,首先制备了氨苄西林包裹的磁珠,该材料对细菌有很好的结合、分离和富集能力。在此基础上,将T线上的抗体作为特异性识别元件,从待测溶液中选择性捕获肠炎沙门氏菌,可达到102~103CFU/mL的可视化检测灵敏度。相比于传统的双抗体夹心法,该方法具有低成本、易制备、灵敏高效的优势。
以上工作均基于免疫层析技术的原理开发。相比于抗体,核酸适配体具有筛选成本低、制备简单、易进行化学修饰等优点,此外,通过引入核酸传感中的信号放大策略,能显著提高检测灵敏度。因此,以核酸适配体作为识别元件应用于LFA受到越来越多的关注[23-24]。例如,Gao等[25]近期报道了一种基于适配体和磁分离的MLFA方法,实现了对伤寒沙门氏菌的灵敏检测。如图4A所示,修饰了适配体的磁珠与目标细菌结合后,释放出单链DNA1,该核酸片段被修饰了互补DNA2的AuNPs捕获,利用核酸侧流层析试纸条检测捕获探针,可实现定量分析。此外,利用核酸杂交引起的AuNPs交联,可将AuNPs聚集引起的颜色变化进一步放大,提高可视化检测的灵敏度(见图4B、C)。通过该方法对培养基中伤寒沙门氏菌的LOD低至8.6 CFU/mL,在牛奶实际样品中也可达到4.1×102CFU/mL,可作为一种潜在的技术手段用于牛奶中伤寒沙门氏菌的灵敏检测。

图4 通过AuNPs聚集体信号增强和磁富集实现高灵敏检测伤寒沙门氏菌的侧流层析示意图(A);当样品中分别含(左)和不含(右)伤寒沙门氏菌时,AuNPs聚集体与T线的结合状态(B);未经AuNPs聚集体信号增强的传统检测模式(C)[25]Fig.4 Schematic illustration for the detection of S.typhi using AuNPs aggregates enhanced LFA(A),multifold AuNPs on T line in the presence(left)and absence(right)of S.typhi(B),and single-dose AuNPs on T line in the unenhanced LFA(C)[25]
2.3 其他食源性病原菌
除E.coliO157∶H7和肠炎沙门氏菌以外,还有单增李斯特菌[26]、霍乱弧菌[27]等多种食源性病原菌可引发传染性疾病,危害人类健康。针对这些病原菌的分析方法开发也是MLFA研究关注的热点。例如,Li等[28]将免疫磁珠与核酸侧流层析试纸条相结合,实现对单增李斯特菌的可视化检测。首先利用生物素修饰的抗体识别目标细菌,然后加入亲和素修饰的磁珠,利用生物素与亲和素之间的特异性相互作用与细菌结合,再通过磁分离进行富集。所得产物先用叠氮溴化丙锭处理,以避免死细菌引起的假阳性,最后经DNA提取和PCR扩增,通过核酸侧流层析试纸条对扩增产物进行检测,可在6 h内完成,对生菜样品中单增李斯特菌的LOD为3.5×104CFU/g。
在另一项研究中,Fang等[29]针对食源性霍乱弧菌开发了快速灵敏的侧流层析试纸条检测方法。以霍乱弧菌ctxA基因为靶标设计引物,并修饰生物素和荧光素。利用重组酶介导的扩增技术对靶标基因进行快速扩增,所得产物分别与荧光素抗体和亲和素修饰的磁珠结合,形成的复合物被试纸条T线上的二抗捕获,通过检测磁信号强度实现对目标细菌的检测。在50 min内对虾仁中霍乱弧菌可视化和磁信号的LOD分别达到100 CFU/mL和46 CFU/mL,有望应用于食品中该致病菌的快速灵敏检测。
除霍乱弧菌外,副溶血性弧菌是另一种在海鲜产品中较为常见的食源性病原菌。Ying等[30]开发了一种基于核酸适配体的MLFA检测方法,以适配体为识别元件,通过生物素-亲和素结合磁珠进行富集,利用杂交链式反应放大信号,通过核酸侧流层析试纸条进行可视化检测。该方法不依赖PCR仪和检测设备,可在67 min内完成对副溶血性弧菌的特异性检测。
以上研究表明,MLFA试纸条在多种食源性病原菌的快速检测中具有很好的应用前景。此类方法结合了免疫磁珠快速分离和富集的特点,以及LFA技术操作简便、结果可视化等优势,特别适用于食品生产加工企业和市场监管部门的现场监测和抽检。从识别原理来看,目前针对食源性病原菌的MLFA主要以抗体作为识别元件,也有少量研究利用核酸适配体对目标物的识别作用实现特异性检测。而信号输出方式较为多样化,包括可视化、荧光、磁信号、SERS、纳米酶催化显色等,且双信号和多信号输出模式的策略在近几年被越来越多的报道,为提升灵敏度和定量能力提供了新的思路。表1列出了部分MLFA用于食源性病原菌检测的信号输出模式、检出限及线性范围。

表1 MLFA用于食源性病原菌检测的信号输出模式、检出限及线性范围Table 1 MLFA detection of various foodborne pathogens with different signal readouts,LODs and linear ranges
3 MLFA用于食品中小分子污染物检测
除食源性病原菌外,有毒有害的小分子污染物也是食品安全中重点关注的对象[31],包括真菌毒素[32]、农兽药[33]、非法添加剂[34]等。这些小分子作为简单半抗原,不具有免疫原性,与抗体的结合价为单价,难以通过类似病原菌的双抗体夹心法进行检测。因而,针对小分子靶标的LFA一般采用竞争法的检测原理。在结合垫上固定或预处理时加入带有标记物的能识别待测分子的单抗/多抗,T线上固定待测分子的完全抗原,C线上为抗种属特异性IgG的二抗。当样品中不含待测分子时,带标记的抗体与T线上的抗原结合,可在T线处观察到强信号;当含有待测分子时,其与T线上的抗原竞争结合抗体,T线信号强度随之减弱,因此可以根据信号强度的变化与待测物浓度的关系实现对待测分子的定量检测。
3.1 真菌毒素
真菌毒素是真菌侵染农作物产生的有毒次级代谢小分子化合物。常见的真菌毒素包括黄曲霉毒素B1(AFB1)和赭曲霉毒素A(OTA)等,具有致癌、致畸、致突变效应,严重威胁人类健康[35]。目前市场上主流的真菌毒素快检产品多基于免疫层析技术开发。通过与磁性纳米材料相结合,可从相对复杂的样品基质中分离和富集目标毒素[36],进一步提高检测方法的灵敏度和抗干扰能力。
Guo等[37]将QDs和MNPs包裹在核壳结构的聚合物微球中,制备出抗体标记的磁性和荧光双功能纳米材料,从酱油中纯化和富集AFB1后直接用于免疫层析试纸条的分析,对酱油及其提取物中AFB1的LOD分别为51、3 pg/mL,远低于传统的荧光免疫层析试纸条产品。此外,该课题组还利用同样方法制备了OTA抗体标记的核壳结构金磁纳米复合物[38](见图5A),并作为预处理材料对葡萄汁样品中的OTA进行磁分离富集,重悬后滴加在试纸条上,通过纳米复合物与T线上半抗原的竞争结合,读取光密度值进行检测(见图5B)。与HPLC-MS标准方法进行比对,验证了实际样品中OTA灵敏快速检测的可靠性。
AFB1作为毒性最强的真菌毒素而受到食品和饲料安全领域的重点关注,牲畜在食用了被污染的饲料后,AFB1在其体内被转化成AFM1,有可能进入到乳制品中,进一步危害人类健康[39]。Liu等[40]针对牛奶中AFM1的快检需求开发了MLFA试纸条,通过对免疫磁珠上抗体载量和磁珠尺寸的优化,在无需额外预处理的条件下对牛奶中AFM1含量的判定值为0.02 μg/L,符合欧盟规定的奶制品中AFM1残留的最大限量要求。在使用同样抗体的前提下,该方法的灵敏度比传统的胶体金免疫层析试纸条提高近50倍。
除AFB1、OTA等霉菌毒素外,以玉米赤霉烯酮(ZEN)和伏马毒素B1(FB1)为代表的镰刀菌毒素也是污染农作物的常见真菌毒素。Hua等[41]报道了一种用于谷物中ZEN残留快检的磁性免疫层析技术,利用免疫磁珠先对样品中的ZEN进行富集,再通过基于竞争法的免疫层析试纸条实现可视化检测,并在智能手机上实现定量结果的直接读取。所开发的试纸条对玉米和小麦中ZEN的判定值为2.5 μg/kg,产品可稳定保存6个月。
以上研究表明MLFA技术可用于农产品和食品中真菌毒素的快速检测。然而,这些方法均针对单一目标物开发。近期,Zheng等[42]报道了可同步测定AFB1、OTA和FB1 3种真菌毒素的MLFA技术。通过分别制备不同抗体修饰的磁性QDs纳米珠,得到集靶标捕获和检测双功能于一体的免疫探针。分别在试纸条的三条T线上修饰AFB1、OTA和FB1的半抗原,根据免疫竞争原理可以实现3种毒素的荧光分析,并在大米、花生、玉米和果汁基质中进行验证,实现了多种毒素的同步快速检测,显著提高了检测效率。
3.2 兽药残留
随着人们生活水平的提高,对乳制品和肉制品的需求量也在不断上升。抗生素等兽药在养殖业中过量使用,导致兽药残留超标的问题时有发生[43-44]。此外,瘦肉精等禁用药物在牲畜养殖过程中的非法使用屡禁不止,给相关行业的日常监管带来了严峻考验[45]。
针对瘦肉精的快检技术需求,Huang等[46]将免疫磁分离和荧光免疫层析技术相结合,开发了可用于猪尿液中克仑特罗的快速检测新方法,相比于传统的胶体金免疫层析试纸条,灵敏度提高了4倍,实际样品中的LOD为0.22 ng/mL,加标回收率为79.1%~108.9%。此外,Wu等[47]通过乙烯基聚合反应将MNPs包裹在表面含磺酸基团的聚合物纳米球中,该材料对克仑特罗和其他10种β-肾上腺素受体激动剂均有很高的吸附率,可在30 s内从0.5 g猪肉中提取出克仑特罗,与胶体金免疫层析技术相结合,对猪肉中克仑特罗残留的LOD为0.1 ng/g。以上方法和材料开发为更有效监测瘦肉精在养殖业中的非法使用提供了新的技术手段。
除瘦肉精等违禁药物外,抗生素类兽药在乳制品中的残留问题也日渐突出。针对这一问题,Liu等[48]构建了氟喹诺酮的免疫磁珠,并结合免疫层析试纸条实现了牛奶中10种氟喹诺酮类抗生素的检测,检出限为2~20 ng/mL。在另一项研究中,Yan等[49]建立了一种牛奶中呋喃唑酮的磁性免疫层析快速检测方法,将MNPs分别标记单抗和羊抗鼠IgG二抗,通过形成带有网络结构复合物,只需要标记少量单抗即可达到较好的显色效果,从而达到信号放大的目的[29]。
相比于病原菌,针对食品中真菌毒素、兽药等小分子污染物的MLFA技术研究较少。然而,与传统的胶体金免疫层析法相比,通过引入免疫磁珠,可显著提高分析方法的灵敏度[50],并能满足酱油、果汁、牛奶、肉类等复杂基质中微量化合物残留的检测需求,因而在对复杂样品的现场快检应用中具备一定优势。表2列出了部分MLFA用于食品中小分子污染物检测的信号输出模式、检出限及线性范围。

表2 MLFA用于食品中小分子污染物检测的信号输出模式、检出限及线性范围Table 2 MLFA detection of small molecule contaminants in food with different signal readouts,LODs and linear ranges
4 总结与展望
LFA试纸条作为一种简单快速的分析载体,在食品安全的多个方面均有广泛成熟的应用。然而,社会的快速发展给食品安全领域不断带来新的挑战,也对快检技术提出了更高的要求。如何在现有基础上,进一步提高LFA检测的性能,拓展其应用范围,已成为重点关注的问题之一。近年来,将磁性纳米材料和LFA试纸条相结合的研究受到越来越多的关注。已报道的MLFA检测技术可分为两大类,一是利用免疫磁珠分离富集目标物后再通过试纸条进行检测;二是制备多功能磁性纳米材料,使其既可用于样品前处理,同时又能作为标签用于信号输出。
目前MLFA技术已被成功应用于食品中致病菌、真菌毒素和农兽药残留等有毒有害物质的快速检测,结果表明该技术能够满足复杂基质中目标物的分离富集与灵敏检测,展现出一定的商品化前景。现阶段该方向的研究热点主要集中在新型磁性纳米材料的制备,以及针对新目标物的检测方法开发。然而,为实现MLFA技术的大规模应用仍需解决一些关键问题。首先需要提高磁性纳米材料的稳定性,由于多功能纳米材料结构复杂,用于MLFA检测时信号的稳定性尚不理想,因此制备性质稳定、重现性好的磁性纳米材料仍然是现阶段的研究重点。其次,目前大多数MLFA均使用抗体作为识别元件,而采用适配体代替抗体在灵敏度和检测成本等方面具有一定优势[51],值得在后续研究中进一步关注。此外,相比于传统的LFA,该技术如何在灵敏度、准确性、成本和易操作性上取得最佳平衡,也是需要进一步思考和探索的问题。例如,以智能手机作为检测工具,可以充分发挥试纸条快速、低成本、易操作的优势,在实际应用中取得更好的效果。同时,针对传统LFA难以应对的复杂样品开发检测方案,可以发挥磁性纳米材料在样品前处理上的优势,从而与LFA形成有机互补。最后,试纸条的信号读取方式可以更加多样化,例如利用SERS技术,既可提高灵敏度,又能实现多个目标物的同步检测[52]。可以预期,随着相关研究的不断深入,MLFA技术在未来的食品安全快检中势必发挥更重要的作用。
