基于PbTiO3表面原位纳米酶的生物传感平台用于NF-κB p50检测
2023-01-05陈彦如王光丽
陈彦如,张 岚,王光丽
(江南大学 化学与材料工程学院,江苏 无锡 214122)
NF-κB p50是一种关键的多效转录因子,在基因表达中起着重要作用。NF-κB p50的研究对白血病、乳腺癌、肺癌等相关癌症具有重要意义[1]。近年来,针对NF-κB p50的检测方法主要包括电化学法[2]、荧光法[3]和比色法[4]。其中,比色法操作简便,易于可视化检测、成本较低且无需昂贵复杂的仪器。因此,开发灵敏度较高、选择性好的比色分析方法具有重要意义。
纳米酶作为当前研究的热点,具有合成简便、稳定性高、成本低和催化活性可调等优点[5-6]。目前,比色分析中采用的纳米酶不容易直接与生物反应结合构建巧妙的生物传感平台。虽然原位形成的纳米酶为构建生物传感器提供了新视角,但其形成仍受限于碱性磷酸酶介导的酶促反应并局限于免疫分析或酶分析[7]。因此,探索新型原位形成的纳米酶与其他多样化的生物反应相结合以构建新型生物传感体系具有重要意义。
本文构建了一种将K4Fe(CN)6配位到PbTiO3表面获得原位纳米酶的新策略,且PbTiO3表面原位形成的纳米酶活性可通过脱氧核糖核苷5′-单磷酸(dNMP)进行调节。基于这一发现,以NF-κB p50为目标物,开发了一种无标记、无固定且高灵敏的生物传感平台。当NF-κB p50不存在时,在核酸外切酶Exo III的作用下,dNMP不断产生并结合在PbTiO3表面,阻碍了K4Fe(CN)6在PbTiO3表面原位形成纳米酶。NF-κB p50存在时,dNMP难以产生,使得K4Fe(CN)6顺利结合到PbTiO3表面,催化底物TMB氧化,以此实现NF-κB p50的定量检测。本研究开发的一种原位形成纳米酶新方法具有灵敏度高、选择性好和操作简便等优点。
1 实验部分
1.1 仪器与试剂
JEM-2100plus型透射电子显微镜(日本日立株式会社);D8型X射线衍射仪(德国布鲁克AXS有限公司);Nicolet FT-IR 6700型红外光谱仪(美国赛默飞公司);UV-3600型紫外可见近红外分光光度计(日本岛津公司);InVia型共焦拉曼光谱仪(英国雷尼绍贸易有限公司);FS5型荧光分光光度计(英国爱丁堡仪器公司);SpectraMax M5型酶标仪(美国分子仪器公司);DYY-8C型凝胶电泳仪(北京六一生物科技有限公司)。
Pb(NO3)2、钛酸四正丁酯、Tween 20、K4Fe(CN)6、叔丁醇、3,3′,5,5′-四甲基联苯胺、KI、NaHCO3、对苯二甲酸、过硫酸铵和30%H2O2(分析纯,国药集团化学试剂有限公司);辣根过氧化物酶(HRP,≥250 U/mg)、超氧化物歧化酶(SOD,≥2 500 U/mg)购自Sigma-Aldrich公司;30%丙烯酰胺/双丙烯酰胺(29∶1)溶液、4S Gel Red、N,N,N′,N′-四甲基乙二胺、牛血清白蛋白(BSA)、甲胎蛋白(AFP)、癌胚抗原(CEA)、前列腺特异性抗原(PSA)、人血清白蛋白(HSA)购自上海生工生物工程股份有限公司;NF-κB p50、NF-κB p65购自南京百斯凯科技有限公司。
实验所用HPLC纯化的DNA购于上海生工生物工程有限公司,所用序列如下:
单链DNA 1(P1):5′-TCA GGA AAG TCC C-3′;
单链DNA 2(P2):5′-GGG ACT TTC CTG AGA CTT AGC-3′(加粗序列表示NF-κB p50蛋白的识别序列);
发夹DNA探针:5′-GCT AAG TCT CAG GAA AG T CCC GAC TTA GCA TCG-3′。
1.2 PbTiO3的制备
PbTiO3的合成根据文献稍作修改[8]:0.331 2 g Pb(NO3)2溶解于50 mL去离子水中,向该溶液中加入1.82 mL Tween 20,并在室温下不断搅拌。将0.35 mL Ti(C4H9O)4加至上述溶液,所得混合液在60℃剧烈搅拌30 min,收集的沉淀物在600℃下煅烧120 min。
1.3 NF-κB p50的比色测定
将2.0 μmol/L单 链DNA(P1和P2)在10 mmol/L pH 7.5的Tris-HCl缓冲 液(含10 mmol/L MgCl2,100 mmol/L NaCl)中混合并于95℃下加热5 min,冷却至室温。将20 μL P1/P2与10 μL不同浓度的NF-κB p50蛋白在30 μL蛋白结合缓冲液(10 mmol/L Tris-HCl,包含100 mmol/L KCl、2 mmol/L MgCl2、0.25 mmol/L DTT,pH 7.5)中混合,室温下孵育30 min,使NF-κB p50蛋白与其识别双链DNA序列结合。随后,向上述混合液中加入20 μL 1.0 U/μL ExoⅢ和20 μL 1 μmol/L发夹DNA探针,37℃下孵育1 h。
随后,向上述混合液中加入20 μL 1.0 mg/mL PbTiO3悬浮液,反应2 min后,依次加入20 μL 0.05 mmol/L K4Fe(CN)6、20 μL 5.0 mmol/L TMB、20 μL 5.0 mmol/L H2O2和NaAc-HAc缓 冲 液(0.2 mol/L,pH 4.5),使反应混合物的最终体积为200 μL。充分混合后,35℃反应20 min,测定oxTMB在652 nm处的吸光度。
1.4 凝胶电泳
采用非变性聚丙烯酰胺(15%)凝胶电泳研究不同情况下的体系产物。将7.5 μL反应产物和2.5 μL 6×样品缓冲液混合后加入聚丙烯酰胺凝胶泳道中,在1×TBE缓冲液(89 mmol/L的Tris-硼酸,pH 8.0)中进行凝胶电泳。先在80 V下电泳1 h,然后在110 V下继续电泳1 h。最后,采用3×4S GelRed核酸染料在黑暗中染色30 min,Gel Doc XR+成像系统拍照。
1.5 HeLa细胞提取物中NF-κB p50的检测
为评估所提出的比色分析的实用性,收集HeLa细胞提取物作为真实样品。HeLa细胞按照文献进行细胞培养[9],使用细胞核提取试剂盒(Active Motif,Carlsbad,CA)提取细胞溶液产物用于测定。向细胞核提取液中加入不同浓度的标准NF-κB p50溶液进行实验,操作步骤同“1.3”。
2 结果与讨论
2.1 PbTiO3及PbTiO3/K4Fe(CN)6复合物的表征
采用透射电子显微镜(TEM)对合成的PbTiO3进行表征,可观察到PbTiO3为约30~45 nm的纳米片(图1A)。PbTiO3的X射线衍射图(XRD)显示PbTiO3的衍射峰归属于四方相的PbTiO3(JCPDS No.06-0452)(图1B),表明已成功合成PbTiO3纳米材料。

图1 PbTiO3的TEM图(A)及XRD图(B)Fig.1 TEM image(A)and XRD pattern(B)of PbTiO3
分别考察不同物质氧化TMB后的吸收光谱(见图2)。结果显示,只有当PbTiO3、K4Fe(CN)6和H2O2同时存在时,TMB才能被催化为蓝色的oxTMB,此时的吸收光谱最强,推测PbTiO3与K4Fe(CN)6反应形成的PbTiO3/K4Fe(CN)6复合物具有类过氧化物酶活性,能在H2O2存在下催化氧化TMB。根据报道可知[10],K4Fe(CN)6中C≡≡N基团可与TiO2纳米颗粒表面暴露的Ti(IV)结合。考察了PbTiO3、K4Fe(CN)6以及K4Fe(CN)6/PbTiO3的吸收光谱图。如图3A所示,乳白色PbTiO3悬浮液在加入无色K4Fe(CN)6溶液后呈黄色,络合后的吸收波长明显红移,证明PbTiO3与K4Fe(CN)6成功结合。从FT-IR光谱(图3B)可以看出,经过K4Fe(CN)6处理的PbTiO3样品中出现一个属于—C≡≡N的伸缩振动吸收峰(2 023 cm-1)[11],该峰与纯K4Fe(CN)6中的—C≡≡N位置接近,表明K4Fe(CN)6成功络合在PbTiO3表面。如图3C所示,配位后PbTiO3样品的拉曼光谱也观察到属于—C≡≡N的特征峰(2 063、2 095 cm-1)[11],同样表明PbTiO3与K4Fe(CN)6已成功结合。

图2 不同反应体系的吸收光谱Fig.2 Absorption spectra of different reaction systems

图3 不同样品的吸收光谱(A)、FT-IR光谱(B)及拉曼光谱(C)Fig.3 Absorption spectra(A),FT-IR spectra(B)and Raman spectra(C)for different samples
2.2 PbTiO3表面原位过氧化物模拟酶活性及催化机理探究
与天然酶和其他过氧化物纳米酶相似,PbTiO3/K4Fe(CN)6的催化活性与反应溶液pH值、反应温度及反应时间等参数密切相关。如图4A所示,纳米酶在pH 4.5时显示活性最佳,与HRP(pH 5.5时活性最佳)相比,纳米酶能在更酸性的条件下保持相对较高的催化活性。从图4B可以观察到,纳米酶和HRP分别在35℃和40℃时表现出最佳催化活性,且纳米酶在较高的温度下仍能保持较好的活性。反应20 min左右,纳米酶显示出最佳催化活性(图4C)。在上述最优反应条件下,探究了纳米酶的稳态动力学参数,并通过公式V=Vmax·[S]/(Km+[S])进行计算(V为初始速度,Vmax为最大反应速度,[S]为底物浓度,Km为Michaelis-Menten常数)[12]。图5A、B分别为不同浓度TMB、H2O2为底物时催化体系的吸光度随反应时间的变化。通过A、B图,得到反应速率与底物TMB或H2O2浓度的关系图(图5C、D),其插图为反应速率的倒数与底物浓度的倒数的关系图。以TMB和H2O2为底物时,计算所得的Km分别为0.199 mmol/L和0.131 mmol/L。与HRP相 比,PbTiO3/K4Fe(CN)6的Km明 显 小 于HRP(TMB:0.434 mmol/L,H2O2:3.7 mmol/L[13]),说明PbTiO3/K4Fe(CN)6纳米酶对TMB具有更高的亲和力,并且在催化反应达到最佳活性时所需要的H2O2浓度更少。
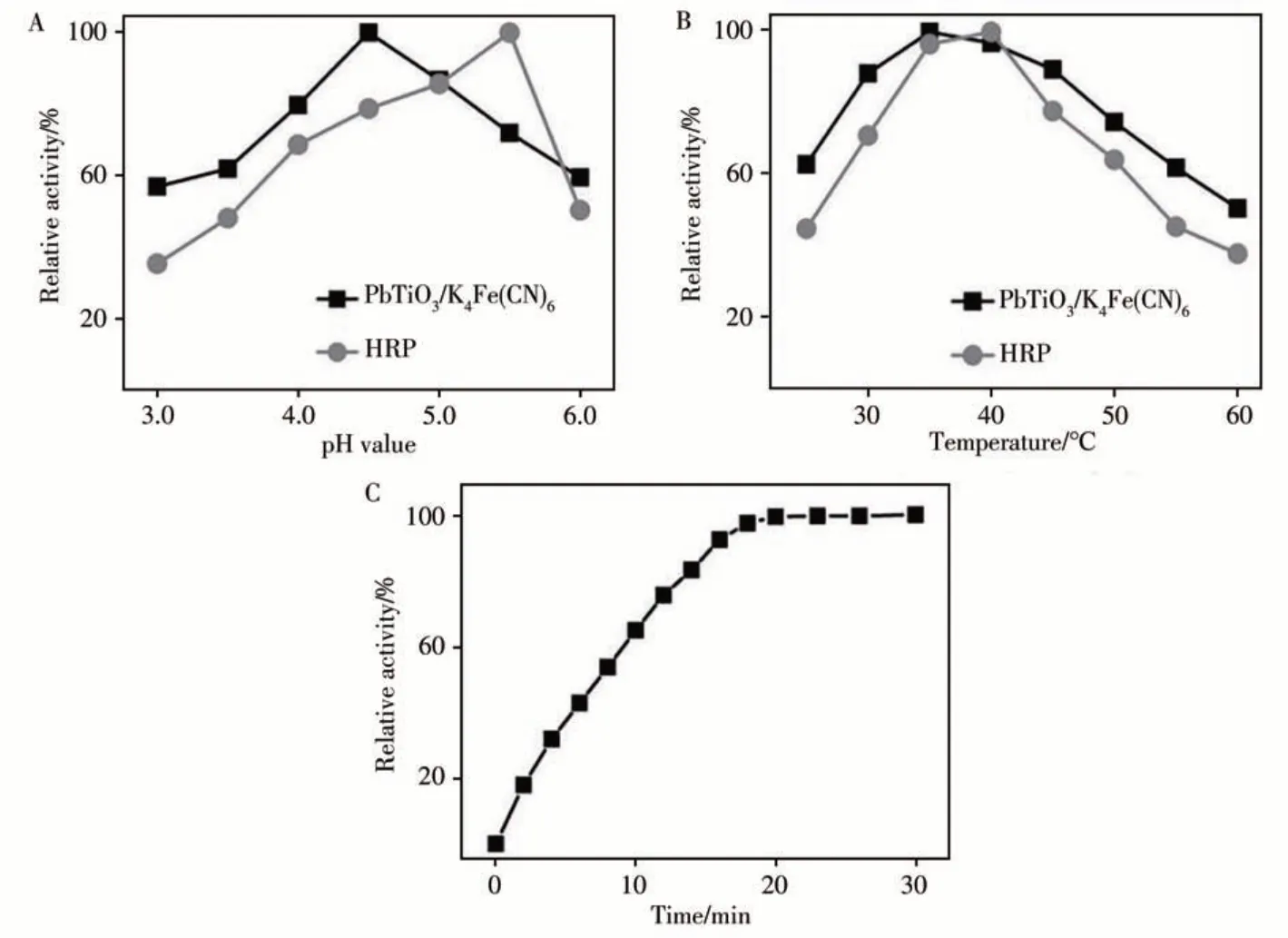
图4 PbTiO3/K4Fe(CN)6和HRP在不同pH反应溶液(A)和不同反应温度下的相对催化活性(B),以及PbTiO3/K4Fe(CN)6在不同反应时间下的相对催化活性(C)Fig.4 Relative catalytic activities of PbTiO3/K4Fe(CN)6 and HRP in reaction solution with different pH values(A)and reaction temperatures(B),relative catalytic activities of PbTiO3/K4Fe(CN)6 at different reaction times(C)
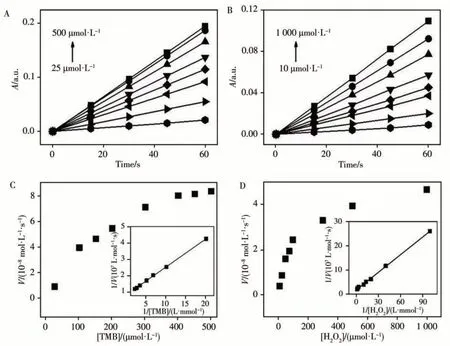
图5 PbTiO3/K4Fe(CN)6在500 μmol/L H2O2和不同浓度TMB(A)、500 μmol/L TMB和不同浓度H2O(2B)存在下的吸光度;以TMB(C)、H2O(2D)为底物时PbTiO3/K4Fe(CN)6的稳态动力学分析Fig.5 Absorbance of PbTiO3/K4Fe(CN)6 in the presence of 500 μmol/L H2O2 and different concentrations of TMB(A),500 μmol/L TMB and different concentrations of H2O(2B).Steady-state kinetic assay of the PbTiO3/K4Fe(CN)6 for the catalytic reaction with TMB(C),H2O(2D)as substrate inset:the Lineweaver-Burk plots of the double reciprocal of the Michaelis-Menten equation
为了探究催化反应过程中的活性中间体,进一步向催化体系中加入叔丁醇和NaHCO3(•OH的清除剂[14])。结果显示,催化体系的活性无明显变化(图6A),说明•OH不是催化反应的主要活性物质。进一步采用对苯二甲酸(TA)作为荧光探针[15]检测•OH的产生(图6B),结果显示,TA本身或其与其它物质的混合物并无荧光产生(曲线a、b),TA与H2O2反应会在425 nm处产生微弱的荧光(曲线c),而TA在催化体系中的荧光(曲线d)比曲线c的荧光强度低,表明催化体系中未产生•OH。当存在O·-2的清除剂超氧化物歧化酶(SOD)[16]时,纳米酶的催化活性明显受到SOD的影响,表明在催化氧化TMB过程中,O·-2作为活性中间体催化氧化TMB。

图6 不同清除剂对PbTiO3/K4Fe(CN)6相对活性的影响(A),以及不同反应体系的荧光光谱(B)Fig.6 Effects of different scavengers on the relative activity of PbTiO3/K4Fe(CN)6(A),fluorescence spectra of different reaction systems(B)
2.3 NF-κB p50蛋白检测原理及可行性证明
据报道,dNMP中的磷酸根可与PbTiO3表面的Ti紧密结合[17]。基于这一反应,设计了NF-κB P50蛋白的检测体系,检测原理如图7所示:两个反向互补的单链DNA(命名为P1和P2),杂交后得到具有NFκB p50特异性识别序列的双链DNA(命名为P1/P2)。当NF-κB P50不存在时,P1/P2中的P1被ExoⅢ水解并产生dNMP,释放的P2与随后加入的发夹DNA继续杂交并不断被ExoⅢ水解,同时被释放的发夹DNA不断与剩余的P2杂交以启动下一轮的水解,释放的大量dNMP吸附在PbTiO3表面并阻止纳米酶的形成。当存在NF-κB P50时,P1/P2在结合NF-κB P50后无法被ExoⅢ水解[18],反应体系中无法产生dNMP,使得K4Fe(CN)6顺利与PbTiO3结合,催化TMB由无色变为蓝色,基于此可实现对NF-κB P50的检测。

图7 ExoⅢ辅助的信号放大反应比色检测NF-κB p50的示意图Fig.7 Schematic illustration of colorimetric determination of NF-κB p50 by ExoⅢassisted signal amplification
如图8A和B所示,当不存在NF-κB p50时,P1/P2不影响整个体系的模拟酶活性(曲线a,b),添加ExoⅢ后,P1/P2被水解,产生的dNMP抑制纳米酶的形成,导致吸光度显著降低(曲线d)。引入发夹DNA(Hairpin)后,产生更多dNMP,导致吸光度进一步降低(曲线e)。而存在NF-κB p50时,无法通过ExoⅢ水解产生dNMP,使K4Fe(CN)6能顺利结合到PbTiO3表面形成纳米酶,导致吸光度恢复(曲线c)。采用凝胶电泳进一步验证该策略的可行性(图8C)。相对于泳道1~3中单独的P1、P2或P1/P2,泳道4中的条带归因于DNA双链P1/P2被ExoⅢ水解后的产物P2。将P1/P2、ExoⅢ和发夹DNA混合后(泳道6),由释放的P2与发夹DNA形成的双链DNA不断被ExoⅢ水解,同时释放出发夹DNA用于下一轮水解反应,其位置与泳道5中单独的发夹DNA的条带相近。而NF-κB p50的加入阻止了ExoⅢ的水解,因此在泳道7中产生一条迁移缓慢的条带,上述结果证明该策略是可行的。
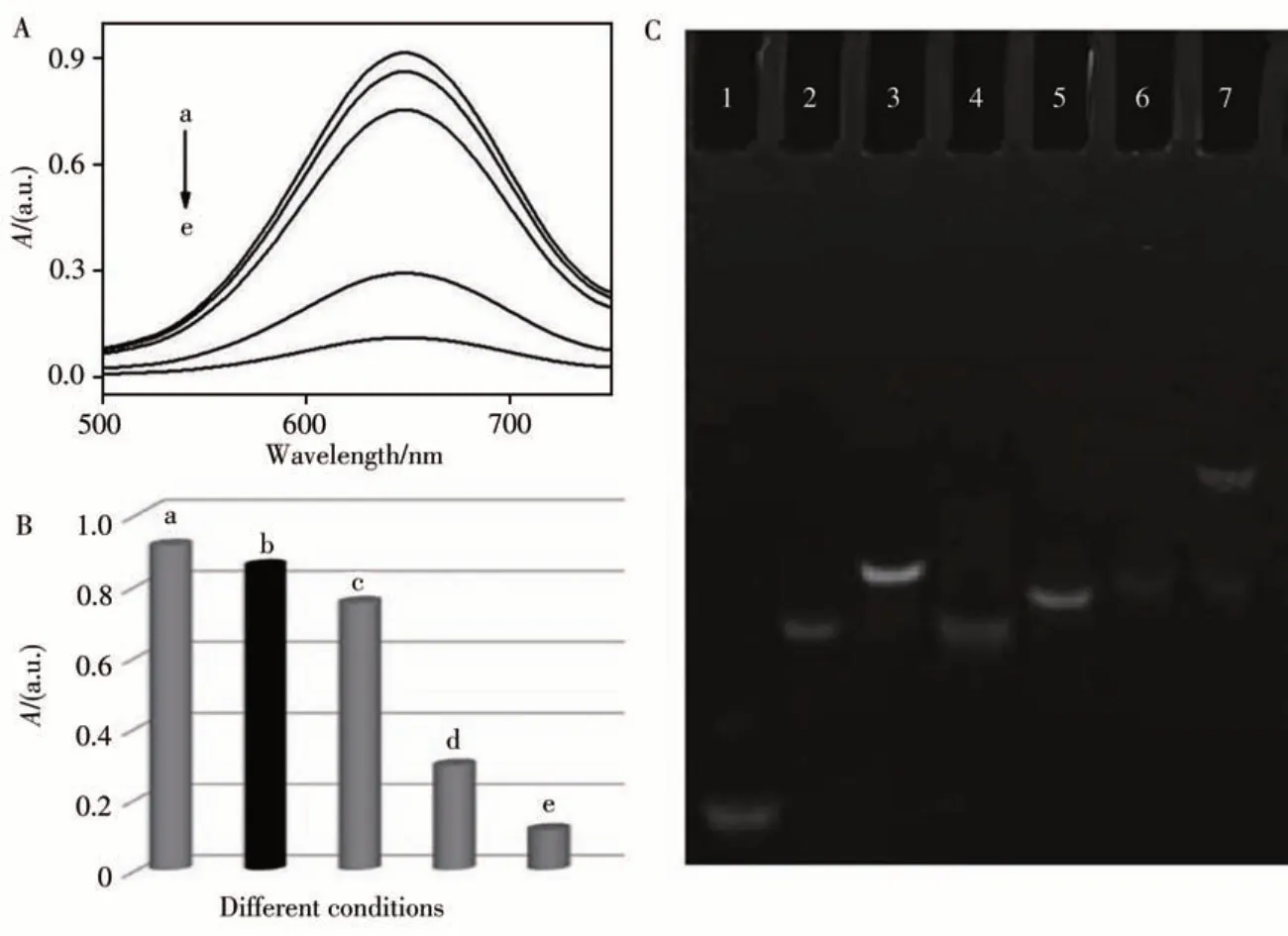
图8 紫外-可见吸收光谱(A)和oxTMB在不同溶液中的相应直方图(B),不同条件下的凝胶电泳图(C)Fig.8 UV-Vis absorption spectrum(A)and the corresponding histograms(B)of the oxTMB in different solutions(C)Polyacrylamide gel electrophoresis image under different conditions
2.4 NF-κB p50的比色测定
考察了加入不同浓度(0、0.003、0.05、0.1、0.3、0.5、1、5、10 nmol/L)的NF-κB p50对体系在最大吸收峰(652 nm)处吸光度的影响。结果显示,随NF-κB p50浓度的增加,氧化TMB在652 nm处的吸收强度逐渐增加(见图9A)。这是由于越来越多的NF-κB p50蛋白嵌入P1/P2,阻止了ExoⅢ对P1/P2的水解,使得反应体系中dNMP的产生较少,随后K4Fe(CN)6顺利与PbTiO3结合,形成的过氧化物模拟酶催化TMB由无色变为蓝色。根据图9B、C,NF-κB p50蛋白的线性范围为3.0 pmol/L~10 nmol/L,检出限(LOD,S/N=3)为1.2 pmol/L。与其他已报道的检测方法相比(表1),该方法由于设计了信号循环放大策略,使得检测灵敏度提高,具有较宽的检测范围和较低的检出限。此外,与其他不同NF-κB p50的检测方法相比,这种基于纳米酶的比色生物传感平台操作更简便且无需DNA修饰/固定等复杂步骤。

表1 不同NF-κB p50蛋白检测方法的比较Table 1 Comparison of different methods for the detection of NF-κB p50
为了验证该方法的选择性,选取一些可能存在的干扰物,如5.0 nmol/L的牛血清白蛋白(BSA)、甲胎蛋白(AFP)、癌胚抗原(CEA)、前列腺特异性抗原(PSA)、人血清白蛋白(HSA)和NF-κB p65,并对比其与0.5 nmol/L NF-κB p50的信号响应情况。结果如图9D所示,只有NF-κB p50能引起oxTMB在652 nm处的吸光度增强,说明该方法对NF-κB p50检测具有较好的选择性。

图9 不同浓度NF-κB p50的吸收光谱(A),NF-κB p50蛋白检测的线性关系图(B、C),及检测方法的选择性(D)Fig.9 The absorption spectra of NF-κB p50 at different concentrations of NF-κB p50,the linear calibration plots for NF-κB p50 detection(B,C),and the selectivity of the method(D)
采用标准加入法,将HeLa细胞提取液稀释10倍进行回收率考察(见表2)。结果显示,NF-κB p50的回收率为99.1%~102%,相对标准偏差(RSD)不大于5.3%,表明该方法对HeLa细胞提取液样品中NF-κB p50的检测可行。

表2 HeLa细胞提取液中NF-κB p50的测定(n=3)Table 2 Determination of NF-κB p50 in HeLa cell extracts(n=3)
3 结论
本文通过将K4Fe(CN)6结合到PbTiO3表面原位形成纳米酶。以NF-κB p50为目标物,通过引入发夹DNA并借助ExoⅢ辅助的水解过程控制dNMP产生,进而调控PbTiO3表面原位形成的纳米酶活性,开发了一种基于纳米酶的无标记、无固定和信号放大的生物传感器,用于灵敏检测NF-κB p50。本方法不仅提供了一种原位形成纳米酶的新策略,还易与能产生dNMP的生物反应相结合,具有灵敏度高、选择性好、操作简便的优点。
