急性髓系白血病转换为急性淋巴细胞白血病1例并文献复习
2023-01-05尹玲玲吴文健
尹玲玲, 吴文健, 朱 锋
(徐州医科大学附属医院 a.血液科; b.病案统计科, 江苏 徐州 221002)
白血病是一类造血干祖细胞的恶性克隆性疾病,以白血病细胞增殖失控,抑制正常造血为特征。尽管化疗联合造血干细胞移植可显著改善患者预后,但仍有相当一部分患者经历复发。通常情况下,复发的白血病患者骨髓中原始细胞的表型和初诊时一样。然而,部分白血病患者复发时发生系别的转换,即初诊时为一种类型(髓系或淋系)的急性白血病,复发时转换为与之相反的另外一种类型。在复发性白血病中,系别转换罕见,发生率为6%~9%,以急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)转换为急性髓系白血病(acute myeloid leukemia, AML)多见,且大多数系别转换发生在儿童[1-2]。系别转换常见的染色体异常包括11q23的易位、7号染色体单体、8号染色体三体。由AML到ALL的系别转换临床较为罕见[3-4]。本文报道1例由AML-M5b转换为B-ALL的患儿的诊疗过程,并进行相关的文献复习,旨在提高临床医生对系别转换白血病的认识。
1 临床资料
患儿,女,4岁。因“发热伴腹痛5天”于2015年8月9日入院。患儿5 d前无明显诱因出现发热,体温最高达39 ℃,无腹痛,无咳嗽、咳痰,就诊于当地医院予以退热处理,后体温降至正常。后患儿再次出现发热,伴阵发性腹痛,腹痛不剧,以右下腹为主,无呕吐、腹胀。既往无手术、外伤、药物过敏史。查体:轻度贫血貌,右下腹压痛,无反跳痛,余未见明显异常。辅助检查:腹部电子计算机断层扫描(computer tomography,CT):升结肠浸润性病变,淋巴瘤或白血病浸润可能;副脾。血常规(2015年8月10日):白细胞(WBC)计数7.5×109/L,血红蛋白(HGB)88 g/L,血小板(PLT )计数31×109/L。骨髓细胞学(2015年8月11日):增生活跃,原始单核细胞占9.5%,幼稚单核细胞占31.5%。过氧化物酶(peroxidase, POX)染色(2015年8月11日):弱阳性。糖原染色(periodic acid schiff, PAS)(2015年8月11日):阴性。流式细胞学分析(2015年8月18日):异常细胞群约占有核细胞的95.3%,表达HLA-DR,CD13,CD14,CD33,CD38,CD64,部分细胞表达 CD4,CD11b,CD15,CD56,MPO,少数细胞表达CD34(图1)。染色体核型分析(2015年8月27日):46,XX。白血病融合基因筛查(2015年8月14日):阴性。根据FAB分型标准诊断为AML-M5b。
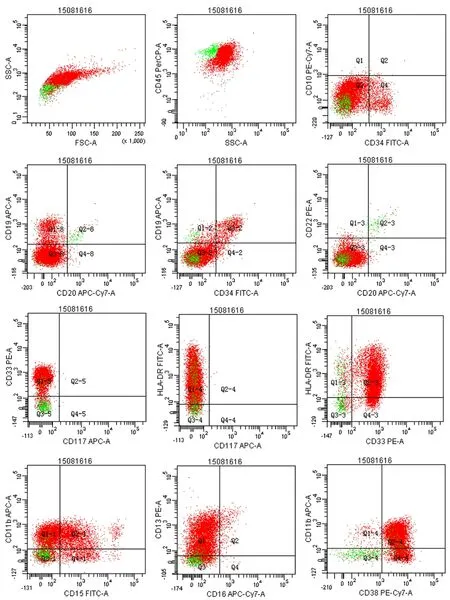
图1 患儿初诊时免疫分型图
入院后应用柔红霉素联合阿糖胞苷(DA)方案化疗,并予以甲氨蝶呤、阿糖胞苷、地塞米松3种药物联合鞘内注射预防中枢神经系统白血病。化疗后复查骨髓细胞学(2015年8月23日)提示缓解。腹部CT(2015年8月21日)提示升结肠病灶范围减小。随后予以9个疗程巩固化疗。期间每月复查一次骨髓细胞学及微小残留病(minimal residual disease, MRD)提示原发病维持缓解。疾病确诊后第11个月,患者MRD(2016年7月13日)提示原始细胞约占有核细胞的42.23%,表达CD34,CD38,部分表达HLA-DR,CD19。考虑为白血病已复发,予以大剂量阿糖胞苷联合依托泊苷化疗,后复查骨髓细胞学(2016年8月13日)提示幼稚单核细胞占12%,再次给予伊达比星联合阿糖胞苷(IA)方案化疗。然而,应用IA方案化疗后1个月,复查骨髓细胞学(2016年9月23日):增生明显活跃,淋巴细胞明显增多,原始淋巴细胞占18%,幼稚淋巴细胞占68%;该细胞中等大小,胞质量少、蓝色,核形偶见扭曲折叠,核染色质较粗,核仁不明显;片中易见涂抹细胞。POX染色(2016年9月23日):阴性。PAS染色(2016年9月23日):阳性。流式细胞学分析(2016年9月27日):原始细胞约占有核细胞的89%,主要表达HLA-DR, CD10,CD19, CD34,CD38,CD58,CD123,TdT(图2)。染色体核型分析(2016年10月4日):45, XX, -17[6]/46, XX[2]。患儿转换为B-ALL。
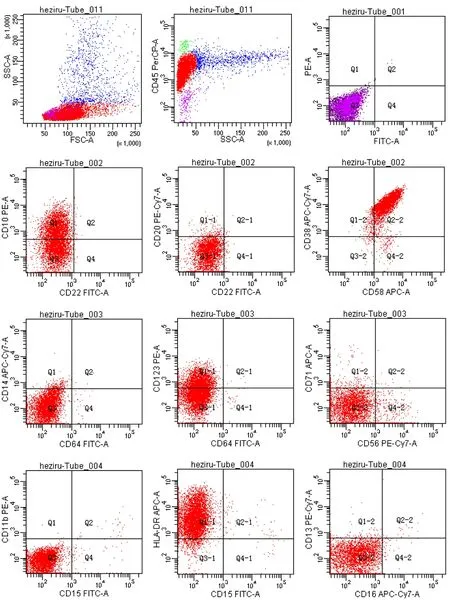
图2 患儿转化为B-ALL的免疫分型图
给予患儿长春瑞滨、柔红霉素、氢化泼尼松(VDP)方案预处理后,输入自体抗CD19-嵌合抗原受体T细胞(chimeric antigen receptor expressing T cells, CAR-T)1×106/kg。输入CAR-T后第10天患儿出现反复高热,体温最高达39.8 ℃,血浆中炎症因子白介素-6(IL-6)、C-反应蛋白(CRP)较前明显升高(图3),考虑CAR-T治疗后细胞因子释放综合征,同时不能排除感染可能,予以解热镇痛药对症处理及抗感染治疗,1周后体温得到控制。于输入CAR-T后第14天及第28天复查骨髓细胞学均未见原始及幼稚淋巴细胞。后每月复查1次骨髓细胞学,提示原发病维持缓解。然而,半年后,患儿骨髓细胞学(2017年5月25日)示原始淋巴细胞占60%,提示原发病复发,予以环磷酰胺、地塞米松、长春瑞滨、表柔比星(Hyper CVAD-A)化疗,后再次输入自体CAR-T 1×106/kg。患儿未达缓解,后因疾病进展死亡。

图3 输入CAR-T后患儿血浆炎症因子(IL-6、CRP)水平
2 讨 论
急性白血病系别转换的发病机制尚不明确,目前有以下3种假说:(1)初诊时为混合谱系白血病,化疗抑制了诊断时占主要优势的白血病克隆,使得另一种不同表型的亚克隆大量扩增,从而表现为另一类型的白血病[5]。(2)初诊时的白血病干细胞具有髓系、淋系祖细胞特征,具有向髓系和淋系双向分化的潜能,类似于慢性髓系白血病发生急变后,既可以急变为AML,也可以急变为ALL[6]。(3)类似于正常的造血干细胞,白血病细胞也具有可塑性及可逆性,在造血微环境中众多转录因子或细胞因子的调控下,干细胞的命运可能发生转变[7]。
白血病发生系别转换后,应选择和转换后表型相关的治疗,但大多数患者治疗效果欠佳,提示系别转换的白血病恶性程度较高[8]。本例患儿初诊时为AML-M5b,复发为B-ALL,采用CAR-T治疗后得到了缓解。CAR-T治疗作为一种特殊的细胞免疫治疗方法,在复发/难治性(relapsed/refractory,R/R)血液系统恶性肿瘤的治疗中取得了富有前景的疗效[9]。研究发现,人源化CD19-CAR-T输注使2例初诊B-ALL患者得到了完全缓解(complete remission, CR),打破了CAR-T治疗用于R/R血液肿瘤的局限性[10]。然而,本例患儿在CAR-T治疗缓解后不久再次复发,予以化疗及二次输注CAR-T,但因治疗无效而死亡。Jacoby等[11]研究发现,在靶向抗原CD19的CAR-T免疫压力的持续存在下,转录因子Pax5和Ebf1的缺失使系别发生转换,从而导致CAR-T治疗耐药性的发生。进一步证明了白血病干细胞具有可塑性,受到造血微环境的影响可能发生系别的转换。研究表明,系别转换在单克隆抗体或CAR-T等免疫治疗中可能更常见[12-15]。研究发现,靶向CD19的免疫治疗后的白血病系别转换可能和核基因的重排或表观遗传学的改变有关[16-17]。有研究报道,B-ALL患者应用博纳吐单抗治疗后转变为AML,而中断博纳吐单抗后,再次转化为B-ALL,提示细胞因子释放与白血病的免疫治疗发生表型改变相关[17]。众所周知,托珠单抗(IL-6R信号通路阻断剂)可以有效治疗博纳吐单抗或CAR-T治疗后引发的致命性细胞因子释放综合征,而IL-6具有促进人白血病细胞株向髓系表型转换的能力,有学者推断,炎症细胞因子(主要是IL-6)可能导致淋系克隆向髓系分化。这可能部分解释了免疫治疗后发生系别转换的原因。此外,Balducci等[18]也报道了1例经CD19免疫治疗后由B-ALL转变为AML的患者[18]。本例患儿二次复发后,骨髓细胞学仍提示为原始淋巴细胞明显增高,但缺乏白血病免疫分型的结果(因家属拒绝再次做免疫分型), 是否存在CD19等靶向分子的缺失或伴有髓系抗原的表达,不得而知。有研究报道了1例初诊时诊断为T-ALL,复发后转变为AML,经治疗缓解后再次复发为T-ALL的患者,再次证实白血病干细胞的可塑性[19]。
本病例提示,急性白血病复发后发生系别转换,预后较差[20-21],治疗需要根据复发后表型作相应的调整,若AML转换为B-ALL,表达CD19,CAR-T治疗可使其再次获得CR,但易二次复发。临床上,对于复发性白血病,需要完善白血病免疫分型,基因突变检测,肿瘤染色体等细胞遗传性及分子生物学等方面的检查,以便更好地指导治疗及评估预后。
