MDM4 rs4245739基因多态性与乳腺癌易感性的meta分析
2023-01-05李佳阳伍红瑜陈保林程晓明吕俊远
姜 焱,李佳阳,伍红瑜,陈保林,程晓明,吕俊远
(1. 遵义医科大学附属医院 a. 普通外科; b. 乳腺甲状腺外科; c. 药物临床试验机构, 贵州 遵义 563099; 2. 遵义医科大学 基础药理学教育部重点实验室暨民族药教育部国际联合研究实验室,贵州 遵义563000)
乳腺癌是女性最常见的恶性肿瘤之一,约占女性恶性肿瘤的23%,也是导致女性癌症相关性死亡的主要原因,全球每年有超过60万人死于乳腺癌[1]。乳腺癌的发生发展通常是由遗传易感性和环境暴露之间复杂的相互作用而引起的[2-3]。越来越多的研究表明,遗传因素在癌症的发病机制中发挥重要作用,且目前有许多基因已被鉴定为癌症易感基因[4]。
鼠双微体4(mouse double minute 4,MDM4)基因位于染色体1q32,该基因编码一种核蛋白,在N端含有肿瘤抑制基因p53的结合域,其可通过结合转录激活域抑制p53,进而参与乳腺癌的发生发展[5]。单核苷酸多态性(single nucleotide polymorphism, SNP)可影响基因和蛋白水平的稳定性[6],rs424539是MDM4基因目前研究较多的SNP位点,许多研究已表明MDM4rs4245739的基因多态性可影响MDM4的表达进而影响乳腺癌发生发展进程。Liu等[7]的研究发现MDM4rs4245739的基因多态性可降低乳腺癌发生的易感性;而相反地,Hashemi等[8]的研究表明乳腺癌易感性与MDM4rs4245739的基因多态性无关;而Wang等[9]通过meta分析发现,MDM4rs4245739的基因多态性与亚洲人乳腺癌易感性呈负相关,但该meta分析纳入研究不全,未将Montserrat 等[10]的研究纳入。因此,本研究通过meta分析现有研究,旨在探讨MDM4rs4245739的基因多态性与乳腺癌易感性的相关性。
1 资料与方法
1.1检索策略 我们在PubMed、EMBASE、Cochrane Library、中国知识基础设施数据库和万方电子数据库中检索相关文献。以下所有的关键词均在各个数据库中检索:“乳腺癌”、“乳腺肿瘤”、“breast cancer”、“breast tumor”、“breast malignance”、“鼠双微体4”、“MDM4”、“HDMX”、“MDMX”、“MRP1”、“单核苷酸多态性”、“基因多态性”、“基因亚型”、“基因突变”、“基因变异”、“single nucleotide polymorphism”、“SNP”、“gene polymorphism”、“gene subtype”、“gene mutation”、“gene variation”。此外,还对合格文献的参考文献和相似文献列表进行了审查,以确保检索到所有可能合格的文献。
1.2纳入标准 (1)病例-对照研究; (2)关于MDM4基因多态性与乳腺癌易感性的相关性研究;(3)可获取全文; (4)有足够的基因型分布数据,可用于计算OR和95%CI;(5)健康对照者人群的基因型分布必须符合Hardy-Weinberg平衡(Hardy-Weinberg equilibrium,HWE) 。
1.3排除标准 (1)无健康对照者的研究;(2)无详细乳腺癌患者数、健康对照者数和一些其他重要信息;(3)排除综述和数据重复文献。
1.4数据提取和质量评估 对所有符合条件的纳入文献,提取了以下数据:作者、发表年份、地区、种族、样本量以及病例和健康对照者的基因型频率。两位作者独立提取数据,并基于修正的纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)评估纳入文献的质量[11]。NOS是一种半定量的评分表,总分从0分(最低质量)到9分(最高质量),评分为5~9分表示高质量。两名独立的作者对这些研究进行了独立的评分,如果对同一篇文章的评分结果不同,则通过讨论解决评分的分歧。
1.5统计学方法 使用Stata 15.1软件(Stata Corporation, University Station, Texas, USA)对所有相关数据进行统计分析。利用卡方检验,计算每个病例和健康对照者的等位基因和基因型频率,以评估HWE值。通过OR和95% CI估计在等位基因模型(C vs A)、显性基因模型(AC+CC vs AA)、隐性基因模型(AC+AA vs CC)、杂合子基因模型(AC vs AA)、纯合基因模型(CC vs AA)下的MDM4rs4245739基因多态性与乳腺癌易感性之间的关联强度。异质性检验采用Q检验,用I2进行量化,当P>0.05或I2<50%时表示异质性较小,则采用固定效应模型。相反,则选择随机效应模型[12]。当发现有统计学上的异质性时,进行亚组分析和meta回归分析,探讨研究中可能的异质性来源。我们还通过逐一排除法进行了敏感性分析,以确定每个研究对总体异质性的影响,以评估总体结果的稳定性。采用Begg's漏斗图和Egger's线性回归来评估可能的发表偏倚[13]。P<0.05表示差异有统计学意义。
2 结 果
2.1纳入研究的特征 经过初步检索,总共确定了289篇文献。通过剔除重复、筛选标题和摘要后排除272篇文献。其中保留了17项研究进行全文阅读和审查,另有12篇研究因下列原因被排除:系统性综述文章4篇[9, 14-16];关于非rs4245739位点基因多态性的研究2篇[17-18];无健康对照者6篇[19-24]。最后,有5篇文献符合纳入标准被纳入本meta分析,涉及9 814名乳腺癌患者和45 202名健康对照者[7, 8, 10, 25-26],见图1。在健康对照者的基因型分布中,所有研究都与HWE一致。所有纳入研究的特征见表1。
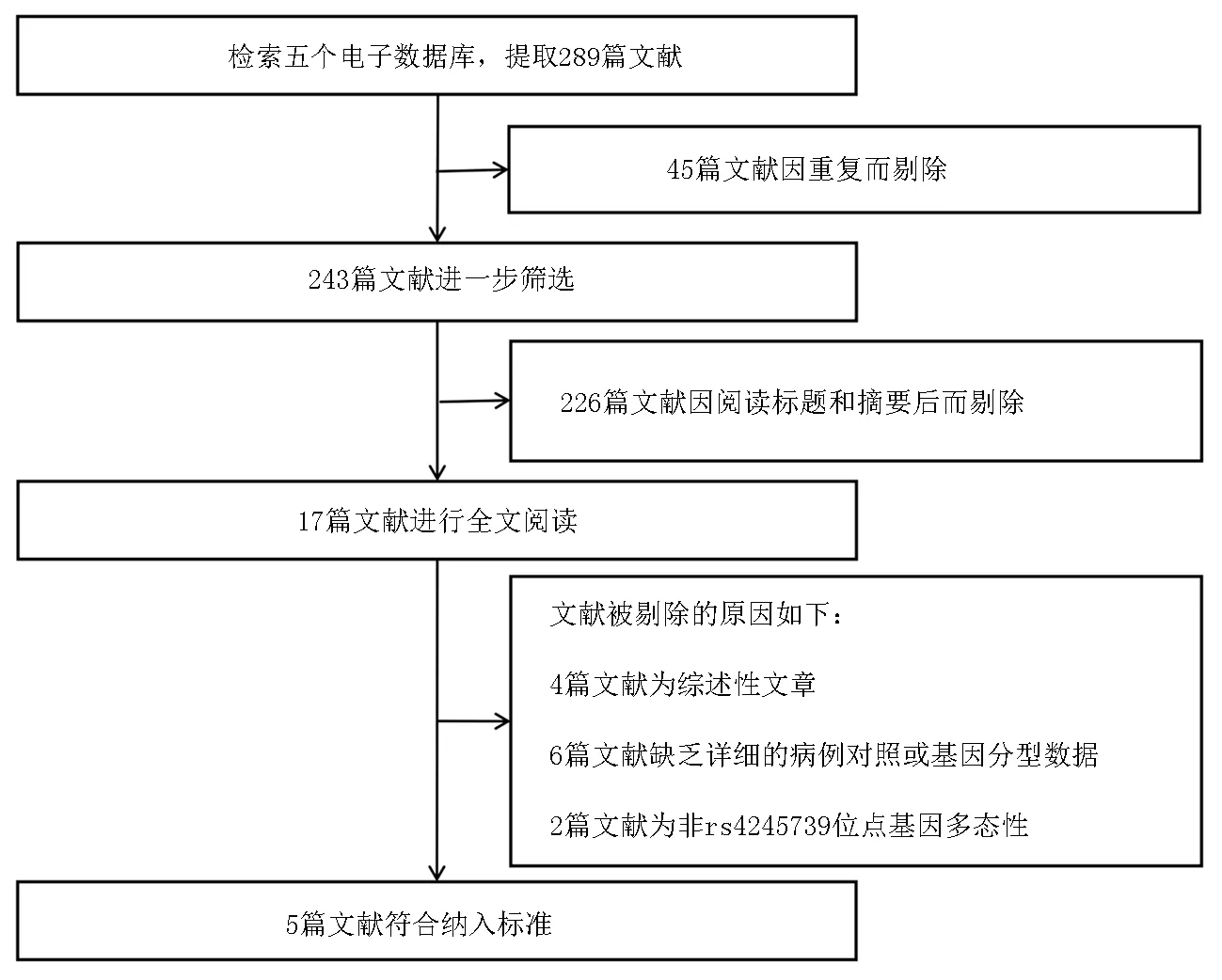
图1 文献筛选流程图
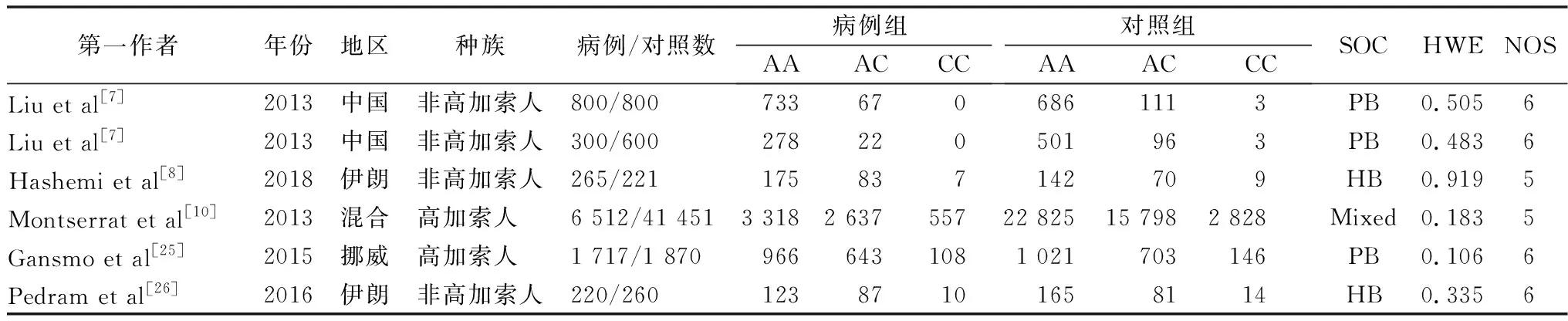
表1 纳入文献的基本特征
2.2Meta分析结果 本研究共纳入5篇病例-对照文献(含6项研究)来汇总数据分析MDM4rs4245739多态性与乳腺癌风险相关性。结果显示,MDM4rs4245739基因多态性与乳腺癌易感性在任何遗传模型中都没有发现显著的相关性:等位基因模型 (C vs A:OR=0.84, 95%CI: 0.67-1.05,P=0.118),显性基因模型 (AC+CC vs AA:OR=0.86, 95%CI: 0.67-1.11,P=0.245),隐性基因模型(AC+AA vs CC:OR=0.90, 95%CI: 0.61-1.32,P=0.585),杂合子基因模型 (AC vs AA:OR=0.88, 95%CI: 0.69-1.12,P=0.305),纯合子基因模型(CC vs AA:OR=0.90, 95%CI: 0.59-1.39,P=0.649),见图2~6。
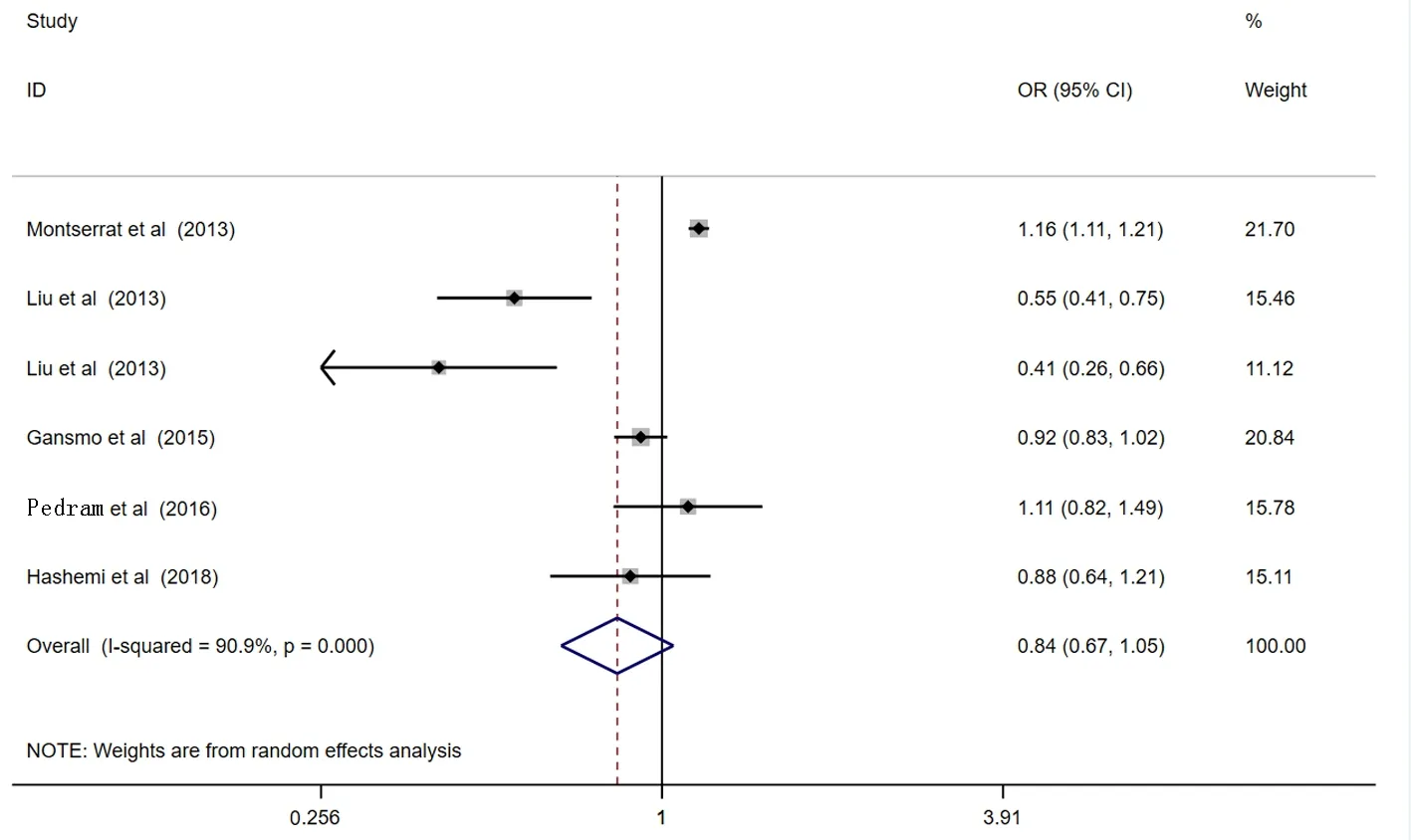
图2 等位基因模型(C vs A)的森林图

图3 显性基因模型(AC+CC vs AA)的森林图

图4 隐性基因模型(AC+AA vs CC)的森林图

图5 杂合子基因模型(AC vs AA)的森林图

图6 纯合子基因模型(CC vs AA)的森林图
2.3异质性检验 异质性检验结果显示MDM4rs4245739 的5种基因模型间均存在显著差异性:等位基因模型 (C vs A:I2=90.9%,P=0.000),显性基因模型 (AC+CC vs AA:I2=90.0%,P=0.000),隐性基因模型 (AC+AA vs CC:I2=70.0%,P=0.005),杂合子基因模型 (AC vs AA:I2=87.6%,P=0.000),纯合子基因模型 (CC vs AA:I2=75.2%,P=0.001)。因此,采用随机效应模型来分析数据。为了阐明异质性的来源,我们进行了亚组和meta回归分析。亚组分析和meta回归结果显示,健康对照者的地区分布和来源可能是导致异质性的主要来源,见图2~6,表2~3。

表2 亚组分析结果

表3 Meta回归结果
2.4敏感性分析 敏感性分析采用逐一排除法来评估每篇文献对meta分析总体结果的影响。结果表明,在排除Montserrat等[10]研究后结果发生了改变,提示研究结果会受到该研究的影响,见图7。

图7 5种基因模型的敏感性分析 a. C vs A; b. AC+CC vs AA; c. AC+AA vs CC; d. AC vs AA; e. CC vs AA
2.5发表偏倚 采用Begg’s漏斗图和Egger’s线性回归检验来评估发表偏倚。漏斗图存在不对称性,提示发表偏倚可能。为此我们进一步使用Egger’s线性回归检验评估发表偏倚风险,结果提示:等位基因模型(C vs A: PBegg’s=0.260, PEgger’s=0.044),显性基因模型(AC+CC vs AA: PBegg’s=0.452, PEgger’s=0.100),隐性基因模型(AC+AA vs CC: PBegg’s=0.707, PEgger’s=0. 069),杂合子基因模型(AC vs AA: PBegg’s=0.452, PEgger’s=0.143) 和纯合子基因模型(CC vs AA: PBegg’s=0.707, PEgger’s=0.090),见图8。

图8 5种基因模型发表偏倚检验的Begg's漏斗图 a. C vs A; b. AC+CC vs AA; c. AC+AA vs CC; d. AC vs AA; e CC vs AA
2.6GEPIA数据库分析结果 本数据库包含1 085例乳腺癌组织和291例正常乳腺组织样本,分析结果显示MDM4的表达水平与正常对照者差异无统计学意义,与乳腺癌的肿瘤分期和预后无关,见图9。
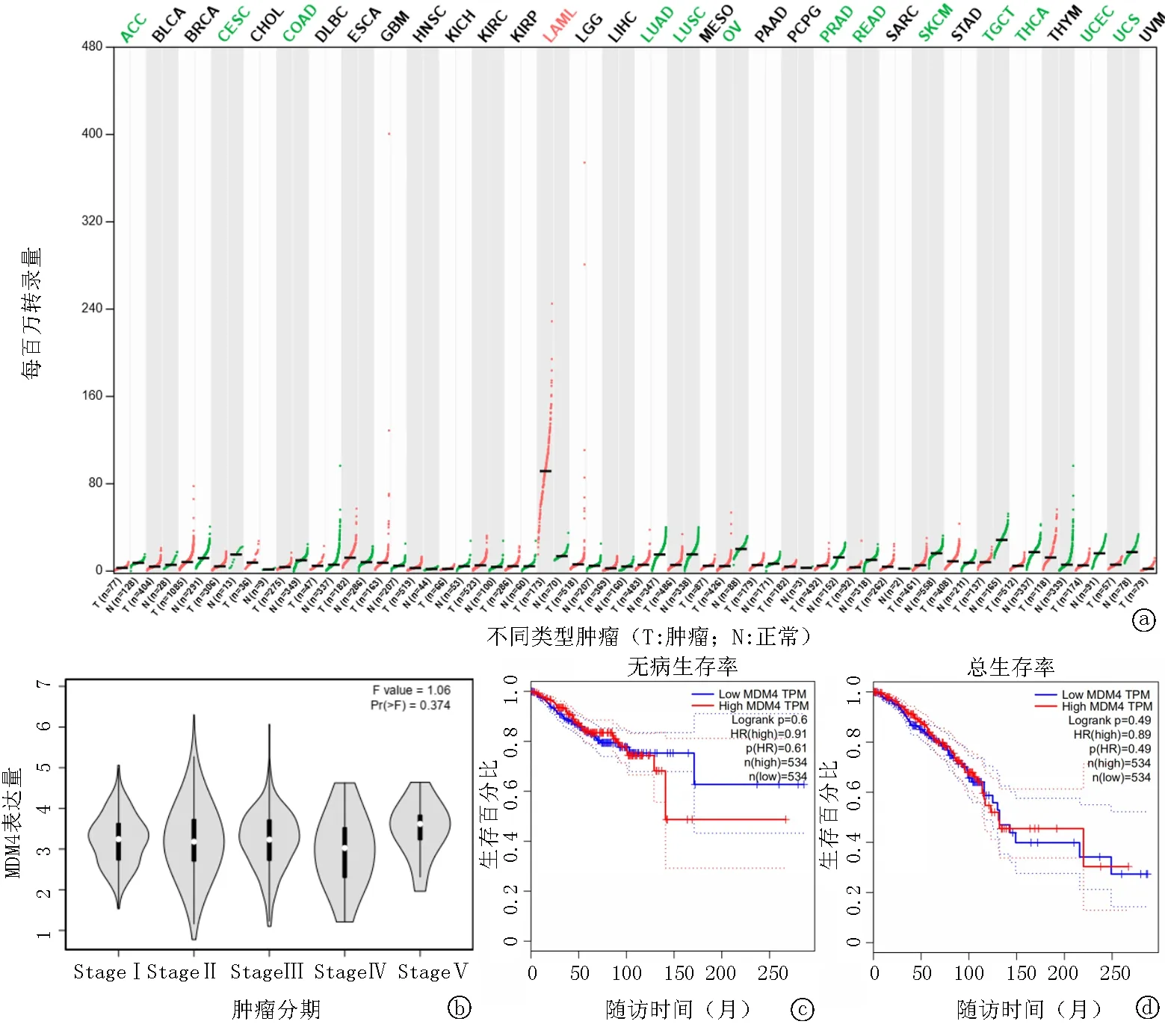
图9 GEPIA数据库分析图 a. MDM4在不同类型肿瘤中的表达情况; b. MDM4在乳腺癌不同临床分期中的表达情况; c. 乳腺癌患者MDM4表达与无病生存率的关系; d 乳腺癌患者MDM4表达与总生存率的关系
3 讨 论
尽管分子生物研究提示MDM4可以通过调控p53参与肿瘤的发生发展[5],但通过GEPIA数据库的大样本分析发现,与正常乳腺组织相比乳腺癌组织中MDM4的表达量无显著变化,提示在乳腺癌发生发展过程中缺乏推动MDM4表达量变化进而参与乳腺癌的因素。进一步从生物学机制而言,SNP是通过影响基因、蛋白的表达而发挥生物学作用[6],而meta分析发现MDM4rs4245739与乳腺癌无关,由此提示MDM4rs4245739这一SNP位点可能对MDM4表达无显著影响。此外,从统计学分析角度看,我们在纳入的文献中观察到显著的异质性,异质性是指纳入研究结果之间的差异程度。强异质性会导致meta分析的汇总数据的评估效度降低。为了进一步探讨纳入研究中异质性的可能来源和其他影响异质性的积极因素,我们根据种族、地区、样本量、基因分型检测方法和健康对照者的来源进行了亚组分析和meta回归分析。结果表明,健康对照者的地区分布和来源可能是异质性的主要来源。值得注意的是,这一结论是纳入Montserrat等[10]的研究而得出的。考虑到这篇文章是异质性的来源,为此我们删除了该文献[10]并重新合并,在移除该研究后确实改变了结论,即MDM4rs4245739等位基因模型、隐性基因模型、纯合子基因模型均提示其基因多态性与乳腺癌易感性之间呈负相关,这与Wang等[9]的结论一致;但在移除该研究[10]后,在显性基因模型和杂合子基因模型中,MDM4rs4245739基因多态性仍与乳腺癌易感性无关。为此,我们试图通过敏感性分析来探索混杂因素,结果发现Montserrat等[10]的研究对meta分析结论有影响,这可能与其样本量大有关。而Begg’s漏斗图和Egger’s线性回归提示存在发表偏倚可能,由于纳入研究数量少,有可能影响上述方法对发表偏倚的检验效能。
当然该meta分析也存在一些局限性:第一,分析的样本量较少,有限的样本量往往伴随着选择的偏差。第二,在整体的meta分析和亚组分析中都观察到异质性,这表明潜在的因素可能会导致研究之间的异质性,我们利用随机效应模型最小化了这一问题的可能性。第三,MDM4rs4245739位于一个约230kb的连锁不平衡区,该区也包含tRNALys转录本和癌基因PIK3C2B[10],MDM4基因多态性的基因-基因相互作用对乳腺癌发生发展的影响未能阐明。第四,不同分子亚型乳腺癌具有不同的生物学、临床和分子特征[27],但由于纳入研究数据有限,无法按照分子分型进行亚组分析。
综上所述,MDM4rs4245739基因多态性与乳腺癌易感性无相关性。考虑到上述局限性,未来需要按照乳腺癌分子分型进行大规模的病例对照研究,以进一步明确两者之间的关系。
