酿酒葡萄‘赤霞珠’VvbHLH93基因的克隆及分析
2023-01-04徐学蕾鞠延仑王婉妮吴今人房玉林
徐学蕾,鞠延仑,王婉妮,吴今人,房玉林,2*
(1 西北农林科技大学 葡萄酒学院,陕西杨陵 712100;2 西北农林科技大学,合阳葡萄试验示范站,陕西合阳 715307)
葡萄(VitisviniferaL.)是世界上具有重要经济价值的果树,然而,植物生长的自然环境是由一系列复杂的生物胁迫和非生物胁迫构成,其中干旱、高温、低温、高盐等非生物胁迫轻则影响植物的生长发育,重则导致植物的死亡,最终影响作物的质量和产量[1-2]。为避免和减轻这些逆境胁迫对植物造成的影响,植物可以在分子、细胞和生理水平上进行应答[3]。因此,通过分子生物学技术改良植物品质,对提高葡萄产量和质量具有重要的意义。
bHLH是广泛存在于动物、植物及真菌中的一大类呈碱性且有螺旋-环-螺旋(basic-Helix-Loop-Helix,bHLH)结构的转录因子[4],总共含有约50~60个氨基酸[5-6]。其中,碱性氨基酸区域位于bHLH结构域的N端,含有约15个氨基酸,包括约6个碱性残基,其主要功能是识别并特异性结合靶基因启动子中的DNA序列[7-8]。螺旋环螺旋区域位于bHLH结构域的C端,包含约40~50个氨基酸,包括两个由疏水环连接的疏水残基组成的两性α螺旋,其主要功能是进行结构域二聚化以促进蛋白质和蛋白质相互作用并允许形成同源二聚体或异源二聚体复合物以调节下游靶基因的表达[9]。
目前,bHLH93的研究集中在拟南芥、苹果和甜菜等作物中。Sharma[10]研究发现,AtbHLH93在体内和体外与开花抑制剂MAF5启动子元件结合,从而调控拟南芥的开花时间,并在控制拟南芥生长形态方面发挥着重要的作用;An等[11]研究表明,苹果中AtbHLH93的同源基因MdbHLH93受MdBT2蛋白的泛素化修饰,加速ABA调节的叶片衰老,并直接激活衰老结构基因MdSAG18的转录而负调节叶片的衰老;Wang等[12]在甜菜的研究中发现,BvbHLH93可以通过提高抗氧化活性和减少活性氧(ROS)的产生调节盐胁迫耐受性。
bHLH家族是与植物抗逆性相关的转录因子家族的第二大家族,在有效应对植物生物胁迫及非生物胁迫,提升作物产量方面起着重要的作用[13-14]。葡萄作为世界上种植最广泛的水果作物之一,具有重要的经济价值[15]。尽管bHLH93在植物生长发育中具有重要作用,但在葡萄中尚未见相关研究报道。因此,本研究在克隆葡萄VvbHLH93基因的基础上进行了生物信息学分析,并结合该基因在葡萄不同组织及果实不同生长发育时期的表达模式分析,以期为深入研究bHLH家族基因的功能提供理论基础。
1 材料和方法
1.1 实验材料
实验材料为酿酒葡萄‘赤霞珠’(VitisviniferaL. cv. Cabernet Sauvignon),采自西北农林科技大学葡萄酒学院酿酒葡萄示范基地。试验于2021年6~9月采集不同时期果实;于7月份采集根、茎、叶、芽及果皮,用于不同组织及葡萄不同生长发育时期的荧光定量分析。所收集材料先使用锡箔纸包好,经液氮速冻后,于-80 ℃冰箱保存。
1.2 方 法
1.2.1 基因克隆葡萄样品的RNA提取采用RNAprep Pure多糖多酚植物总RNA提取试剂盒(天根生化科技有限公司,北京),使用核酸蛋白仪和电泳分析进行质量检测,选择HiScript Ⅱ Reverse Transcriptase反转录试剂盒(南京诺唯赞生物科技股份有限公司,南京)对检测合格的RNA进行反转录成cDNA。采用Primer Premier 5.0软件设计引物(表1),并进行PCR扩增,1%琼脂糖凝胶检测PCR产物,然后利用胶回收试剂盒(北京天漠科技开发有限公司,北京)回收基因的片段,并利用核酸蛋白仪检测回收产物的纯度和浓度。引物序列见表1。
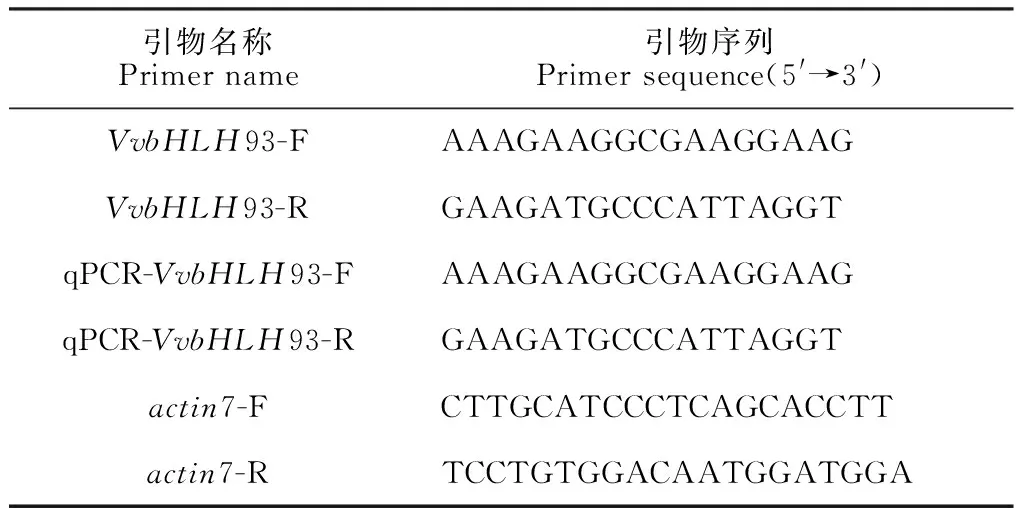
表1 VvbHLH93克隆及表达分析所使用的引物及序列
1.2.2 基因生物信息学分析使用NCBI中ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)对测序获得的cDNA基因进行开放阅读框预测;利用在线ProtParam软件(https://web.expasy. org/protparam/)对氨基酸序列的基本理化性质进行预测和分析;蛋白质的跨膜结构利用TMHMM工具(http://www.cbs.dtu.dk/services/TMHMM/)进行分析;信号肽利用SignalP 4.1(http://www.cbs. dtu. dk/services/SignalP-4.1/)进行分析;利用在线NetPhos 3.1(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)进行磷酸化位点的预测;疏水性区域预测利用ProtScale(https://web.expasy.org/ cgi-bin/protscale/protscale.pl)进行;蛋白质二级结构利用SCOPMA工具(https://npsa-prabi.ibcp.fr/ cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)进行预测;利用SWISS-MODEL在线软件预测VvbHLH93蛋白三级结构;利用DNAMAN软件对其编码的氨基酸序列进行比对;构建系统进化树利用MEGA 6.06软件中邻接法法进行;使用PlantCARE(http://bioinformatics.psb.ugent. be/webtools/plantcare/html/)分析启动子上的顺式作用元素。
1.2.3 基因表达分析分别提取‘赤霞珠’的根、茎、叶、芽及果皮的RNA,各取1 μg为模板,使用HiScript Ⅱ Reverse Transcriptase反转录试剂盒反转录合成cDNA第一链,于-20 ℃长期保存。以葡萄actin7为内参基因并设计引物(表1),用RT-qPCR法分析bHLH93在不同组织和果实不同发育时期的表达量。将cDNA稀释10倍,参考SYBR qPCR Master Mix(南京诺唯赞生物科技股份有限公司,南京)试剂盒的反应体系进行加样。用BIO-RAD Cycler IQ6荧光定量PCR仪检测基因表达量,重复测定3次。采用2-ΔΔCT法和相关软件进行数据处理与分析。
1.3 数据处理与分析利用Excel 2016和Origin 2021软件进行数据处理与分析,采用DPS 6.55软件进行显著性差异分析。
2 结果与分析
2.1 VvbHLH93基因克隆及编码蛋白的理化特性
采用PCR扩增基因产物检测得到一条单一明亮的条带(图1)。经测序并NCBI blast比对,克隆得到的基因编码核酸序列全长1 319 bp,最大开放阅读框939 bp,共编码312个氨基酸(图2)。ProtParam在线预测分析显示,VvbHLH93分子量为35.18 kD,理论等电点为4.68,表明为酸性蛋白;蛋白质不稳定性指数56.22,表现为不稳定蛋白;通过亲/疏水性预测发现,属于亲水性蛋白;未发现跨膜结构,无信号肽,不属于分泌蛋白。二级结构预测发现,在VvbHLH93氨基酸组成中,以无规则卷曲(random coil)为主,占50.96%,其次为α-螺旋(α-helix),占38.78%,第三位的是β-螺旋(β-helix),占2.24%。采用SWISS-MODEL在线软件预测VvbHLH93蛋白三级结构显示,该蛋白主要由无规则卷曲、α-螺旋和β-螺旋组成,与二级结构预测结果一致。NetPhos-3.1预测分析发现,VvbHLH93蛋白具有多个磷酸化位点。其中,丝氨酸磷酸化位点最多,有14个;其次为苏氨酸磷酸化位点,有10个;而酪氨酸磷酸化位点只有3个。

图1 VvbHLH93的cDNA扩增Fig.1 Amplification of VvbHLH93 cDNA

图2 VvbHLH93编码氨基酸预测序列Fig.2 Deduced amino acid sequence of VvbHLH93
2.2 VvbHLH93进化树及氨基酸序列同源分析
为了解VvbHLH93与同源序列之间的进化关系,基于Clustal W对同源序列进行序列多重比对,在此基础上利用MEGA 6.06构建系统发育树。结果(图3)表明,VvbHLH93与荷花亲缘关系较近,聚为一个亚类,在进化上与苹果、拟南芥亲缘关系较远。
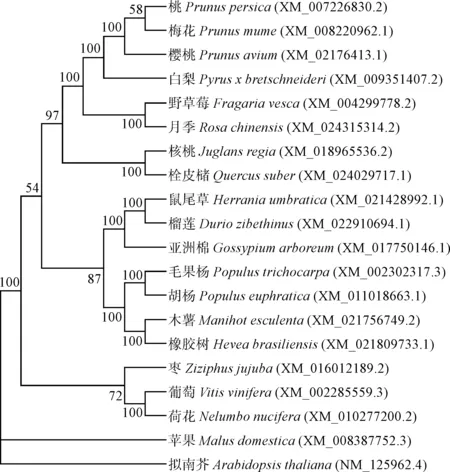
图3 VvbHLH93与其他物种bHLH93蛋白的系统进化树分析Fig.3 Phylogenetic tree analysis of VvbHLH93 and bHLH93 in various species
将VvbHLH93氨基酸序列和拟南芥、苹果、白梨、核桃等17种植物bHLH93氨基酸序列进行同源分析。结果(图4)表明,VvbHLH93与这些植物bHLH93氨基酸序列都拥有保守的bHLH域。经氨基酸序列比对分析,VvbHLH93和其他植物相似性由高到低排列分别为:荷花69.43%,哥伦比亚锦葵62.30%,栓皮槠62.30%,核桃62.21%,白梨61.93%,苹果61.76%,可可61.64%,梅花60.98%,樱桃60.67%,桃60.67%,草莓60.37%,月季59.76%,黄麻59.12%,毛果杨58.39%,胡杨58.07%,异色山黄麻56.80%,拟南芥55%。

红色方框标记bHLH结合保守基序图4 VvbHLH93与其他物种bHLH93蛋白序列比对分析Red box marks bHLH binding conserved motifFig.4 Protein sequence alignment analysis of VvbHLH93 and bHLH93 in various species
2.3 VvbHLH93启动子顺式元件的预测与分析
启动子顺式元件预测表明,VvbHLH93基因的启动子含有激素信号和胁迫响应的相关元件,包括光响应元件(AE-box、GT1-motif、TCT-motif等)和低温、干旱等应答元件(表2)。表明该基因可能参与植物生理调控及对逆境的响应过程。

表2 VvbHLH93启动子顺式元件预测
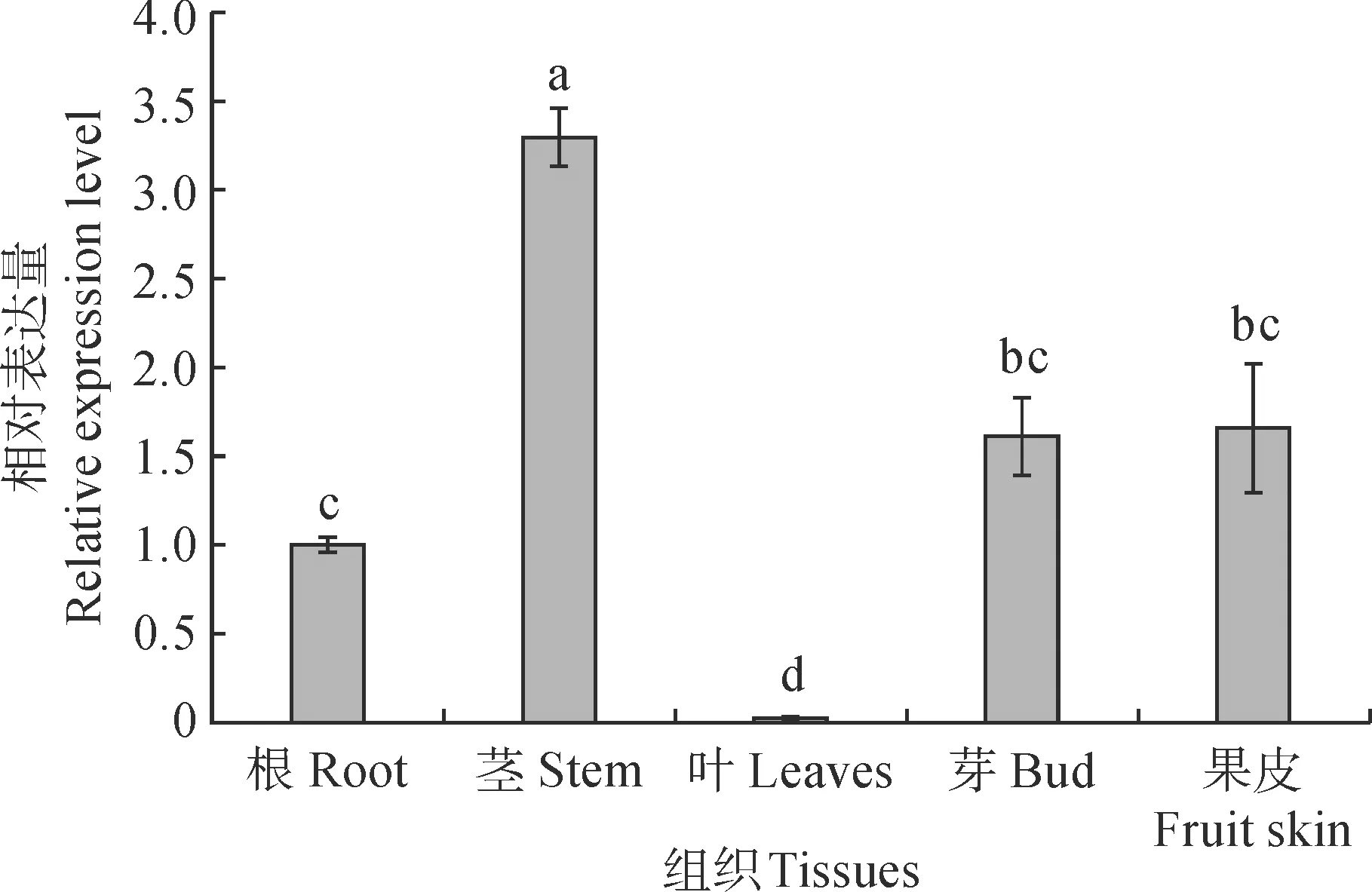
不同小写字母表示不同组织基因的表达差异显著(P<0.05),下同图5 VvbHLH93在赤霞珠不同组织中的相对表达量Different normal letters indicate differences between different tissues for the same gene at 0.05 level. The same as belowFig.5 The relative expression levels of VvbHLH93 in different tissues
2.4 VvbHLH93的表达分析
2.4.1 在葡萄不同组织中的表达如图5所示,VvbHLH93在‘赤霞珠’不同组织中表达水平存在显著差异,在根、茎、叶、芽、果皮不同组织中均有表达。从相对表达量来看,VvbHLH93在茎中的表达量最高,显著高于VvbHLH93在其他组织中的表达水平;其次是芽和果皮,但VvbHLH93在芽和果皮中的表达量无显著差异;VvbHLH93在根中的表达量较低,在叶片中的表达量显著低于其他组织。说明VvbHLH93在‘赤霞珠’不同组织中的表达具有组织特异性。
2.4.2 在葡萄果实不同发育时期的表达如图6所示,随着赤霞珠葡萄果实的发育成熟,VvbHLH93相对表达量不断降低,第5周后相对表达量基本为0,总体呈现出降低的变化趋势。

0.幼果期(直径> 2 mm);1~11依次为幼果期后1~11周采样图6 VvbHLH93在不同发育时期中的相对表达量0. Young fruit stage (diameter > 2 mm); 1—11 samples were collected at 1—11 weeks after young fruit stage Fig.6 The relative expression levels of VvbHLH93 in different stages
2.4.3 在不同胁迫处理下的表达通过顺式作用元件分析,在VvbHLH93启动子序列中预测到了多个与植物激素和逆境胁迫相关的响应元件,表明该基因可能在响应非生物胁迫的转录调控机制发挥作用。进一步通过qRT-PCR分析发现,VvbHLH93基因在高温胁迫、盐胁迫、低温胁迫和充分灌溉胁迫下具有表达特异性(图7)。胁迫试验数据表明,低温、盐、高温和充分灌溉处理‘赤霞珠’盆栽苗6 h后,VvbHLH93的表达量显著下调(P<0.05),分别为对照的52%、10%、13%和7%。

CK. 对照;LW. 4 ℃低温;NaCl. 盐;HW. 40 ℃高温;FI. 充分灌溉图7 VvbHLH93在不同胁迫下的相对表达量CK. 28 ℃ control group; LW. 4 ℃ low temperature; NaCl. Salt;HW. 40 ℃ high temperature; FI. Full irrigation Fig.7 The relative expression levels of VvbHLH93 under different stresses
3 讨 论
bHLH转录因子是植物细胞生长发育、应对各种胁迫的关键调控因子,具有促进植物开花[16]、调节植物抗旱性[17-18]和耐盐性[19-20]等重要作用。目前葡萄bHLH转录因子的功能研究相对较少,还有大量成员的功能未知。
本研究以酿酒葡萄‘赤霞珠’为研究对象,克隆获得VvbHLH93的全长cDNA序列,并对其进行了初步的生物信息学分析和表达特性分析。该基因编码312个氨基酸,具有高度保守的bHLH结构域,属于bHLH转录因子家族成员。氨基酸序列进行同源性分析和系统进化树分析表明VvbHLH93与荷花bHLH93同源关系最近。
qRT-PCR分析结果表明VvbHLH93在‘赤霞珠’不同组织中表达水平存在显著差异,从相对表达量来看,VvbHLH93在茎中的表达量最高,在叶片中的表达量最低。表明VvbHLH93在‘赤霞珠’不同组织中的表达具有组织特异性。与烟草的研究存在不同,NtbHLH93在根中表达量最高[21]。VvbHLH93在葡萄果实不同发育时期中的表达量差异比较显著,发育后期基本不表达,总体呈现降低的变化趋势。
AtbHLH93已被证实是参与调节拟南芥生长发育和开花时间的重要因子之一[10,22],NtbHLH93基因在烟草甾醇代谢中发挥着重要作用[23],在苹果中,MdbHLH93和MdBT2蛋白相互作用,并激活下游结构基因MdSAG18的转录而负调节叶片的衰老[11]。然而,关于VvbHLH93功能的相关研究报道较少,Muoz-Espinoza等[15]通过qPCR实验研究发现VvbHLH93在大小不同的浆果中存在差异表达,可能参与调控浆果重量,改善浆果品质;Song等[24]研究发现VvbHLH93与MYB激活剂和抑制剂相关,并且受低温胁迫的诱导。此外,转录组学分析发现,外源碳处理和光照处理后VvbHLH93的表达量发生变化,说明其可能参与调节葡萄的生长发育及品质形成[25-26]。在VvbHLH93启动子顺式元件预测中,VvbHLH93基因的启动子含有多种激素信号和胁迫响应的相关元件,包括光响应元件和低温、干旱等应答元件。在烟草的研究发现,bHLH93的表达会受光的影响而上调[27]。以上研究为进一步明确VvbHLH93的功能提供了思路。在本研究中,我们发现VvbHLH93响应高温、盐、低温和充分灌溉胁迫,与对照相比,胁迫处理下VvbHLH93基因表达量显著下调,尤其是充分灌溉胁迫下VvbHLH93基因表达量下降最多,仅为对照的7%,这与已有的研究一致[28]。
综上所述,本研究以酿酒葡萄‘赤霞珠’为试验材料,克隆获得了转录因子bHLH转录因子家族成员之一VvbHLH93,并发现其在不同组织和果实不同发育阶段具有表达特异性。通过对VvbHLH93在多种非生物胁迫下的表达模式分析发现,VvbHLH93不同程度地响应高温、盐、低温和充分灌溉胁迫,尤其是在盐、低温和充分灌溉胁迫下,该基因的表达量显著下调。因此推测VvbHLH93是负调控葡萄抗逆胁迫的关键转录因子。本研究为了解VvbHLH93基因在葡萄生长发育和抗逆境机制提供了一定的理论参考,以便为葡萄的育种和抗逆性增强工作奠定基础。
