山药异淀粉酶基因克隆及其在淀粉代谢中的作用
2023-01-04赵令敏张艳芳邢丽南葛明然刘小燕霍秀文
赵令敏,张艳芳,邢丽南,葛明然,刘小燕,霍秀文*
(1 内蒙古农业大学 园艺与植物保护学院,内蒙古自治区野生特有蔬菜种质资源与种质创新重点实验室,呼和浩特 010019;2 鄂尔多斯市农牧业科学研究院,内蒙古鄂尔多斯 017000)
山药(DioscoreaoppositaThunb.)为薯蓣科(Dioscoreaceae)薯蓣属(DioscoreaL.)具有双子叶特性的单子叶植物[1]。山药是世界上十大根茎类作物之一,为全球超过3亿人提供粮食和经济来源[2]。山药以块茎为主要的产品器官[3-4],其中淀粉作为山药块茎的主要成分,也是主要的热量来源,约占干物质含量的80%[5]。淀粉不仅可以提供山药生长发育所需要的物质和能量,在生物工业中也有广泛的应用[6]。
山药块茎内淀粉积累、直链淀粉和支链淀粉比例调控对山药品质改良有积极意义[7]。支链淀粉主要由可溶性淀粉合成酶(starch synthases,SSS)、淀粉分支酶(starch-branching enzymes,SBE)和淀粉去分支酶(starch debranching enzyme,DBE)催化[8]。DBEs根据催化底物的不同可分为普鲁蓝酶(pullulanase,PUL)(EC3.2.1.41)和异淀粉酶(isoamylase,ISA)(EC3.2.1.68)。异淀粉酶是植物器官中淀粉结构和数量的关键决定因素,在一定程度上决定淀粉支链和直链的比例[9]。异淀粉酶最早是在细菌中发现的,催化水解支链淀粉分支点上的(1,6)-α-葡萄糖基键。此外,对异淀粉酶基因的功能已经在多种植物中研究。例如,在水稻[10]、拟南芥[11]、马铃薯[12]、大麦[13]、甜玉米[14]作物中均被证明ISA基因的缺失会导致淀粉颗粒的形成。异淀粉酶有3种同工型酶,ISA1、ISA2、ISA3,形成3种同工酶聚合物行使其功能,ISA基因引起支链淀粉的积累异常,从而参与淀粉的生物合成。
迄今,已经有大量的ISA基因在植物中被克隆和研究,而山药中的ISA基因还没有被充分发掘。本研究通过测定山药块茎淀粉及其组分含量、ISA活性,并基于本课题组前期的山药转录组测序结果,克隆得到ISA3基因并对其进行生物信息学分析,分析其在山药块茎膨大不同时期及其不同组织的表达情况,进一步探讨了不同淀粉含量的山药块茎淀粉积累规律与淀粉代谢相关酶ISA活性及ISA3基因表达量之间的相关性,挖掘影响块茎淀粉积累的关键因子,为进一步研究ISA3基因在山药块茎淀粉代谢中的功能和发掘调控淀粉代谢相关基因提供重要参考。
1 材料和方法
1.1 试验材料
以内蒙古‘毕克齐’(B1)和‘大和长芋’(DHCY)山药为试验材料,于2021年5月初种植于内蒙古农业大学山药种质资源圃。取样时期为种植后的第90天、105天、120天、135天和150天。取样时选择长势均匀一致的植株,每个品种各选取3株混样作为一个生物学重复,共3次重复。分别取山药的块茎、茎及幼嫩叶片各1 g,用锡箔纸包裹,液氮中速冻,置于-80 ℃冰箱,用于RNA的提取及酶活性测定。
1.2 试验方法
1.2.1 淀粉含量及异淀粉酶活性测定参考何洁等[15]双波长法对山药块茎不同膨大时期的淀粉、直链淀粉和支链淀粉含量进行测定。参考Liang等[16]的方法对异淀粉酶活性进行测定,以支链淀粉为底物,用DNS法测定山药块茎中异淀粉酶活性。每个样品3次重复。
1.2.2 总RNA的提取及cDNA合成采用RNA提取试剂盒(MiniBest Plant RNA Extraction Kit)分别提取B1、DHCY不同发育时期块茎、茎及幼嫩叶片的总RNA,通过试剂盒(PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit)反转录成单链cDNA。
1.2.3ISA3的ORF克隆根据本课题组前期高通量测序获得的山药转录组结果筛选异淀粉酶基因-ISA3(Unigene0001496)。通过Primer Premier 5.0软件在ISA3的开放阅读框(ORF)两端设计引物进行PCR扩增(表1)。反应体系为:Extaq 25 μL,ISA3-ORF-F/R(10 μmol·L-1)各1 μL,cDNA 1 μL,ddH2O 22 μL。反应程序为:94 ℃预变性10 min;94 ℃变性30 s;56 ℃退火30 s;72 ℃延伸2 min;30 个循环;72 ℃延伸10 min。扩增产物经回收、连接转化后,将阳性克隆送至华大基因测序。
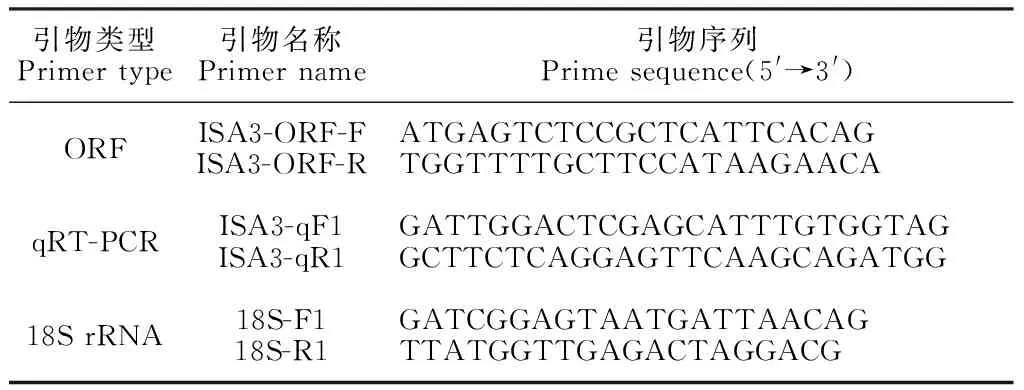
表1 ISA3基因的引物序列
1.2.4 生物信息学分析在NCBI数据库中查找和翻译ISA3基因cDNA序列的CDS;利用在线分析软件Prot Scale(http://www.expasy.org/tools/protscale/)进行疏水性、亲水性预测;利用Prot Param(http://www.expasy.org/tools/protparam/)在线分析软件对ISA3编码的蛋白进行理化性质分析;利用NCBI的CDD(https://www.ncbi.nlm.nih.gov/Structure/ cdd/wrpsb.cgi)进行保守结构域分析;运用SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/ npsa_automat. pl? page= npsa_sopma.html)预测ISA3蛋白的二级结构;将NCBI数据库中的BLAST氨基酸序列进行同源搜索和比对;利用MEGA5.0构建系统进化树。
1.2.5ISA3基因表达分析采用TB GreenTMPremix Ex TaqTM(Tli RNaseH Plus),Bulk试剂盒。以山药的18S为内参基因,利用Primer Premier 5.0软件设计引物(表1)。反应体系为:cDNA 2 μL(200 ng·L-1),ISA3-qF/R各1 μL(10 μmol·L-1),TB Green Premix Ex TaqⅡ 25 μL,ddH2O 1 μL。反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,共40个循环;溶解曲线:95 ℃ 5 s,60 ℃ 1 min,95 ℃ 15 s;每个样品重复检测3次。利用2-ΔΔCT法计算基因的相对表达量。
1.2.6 相关性分析将淀粉及其组分含量、异淀粉酶活性及其ISA3基因的表达量进行相关性分析。采用Excel 2010应用软件进行数据处理和绘图,采用SPSS25.0统计分析软件对数据进行分析。
2 结果与分析
2.1 山药块茎淀粉含量及异淀粉酶活性
对2个品种山药块茎不同膨大时期的直链淀粉、支链淀粉和总淀粉含量进行测定,结果表明,2个品种山药的总淀粉含量在块茎膨大过程中总体呈先升高后降低的变化趋势,但其淀粉含量差异较大:‘毕克齐’(B1)的淀粉含量范围为28%~82%,最高可达81.31%,且在120 d时期淀粉含量显著高于其他时期;‘大和长芋’(DHCY)的淀粉含量范围为55%~95%,最高可达94.06%,同样在120 d时期淀粉含量显著高于其他时期。
同时期品种间比较发现(图1,Ⅰ),除135 d外,其余时期DHCY的淀粉含量均显著高于B1。在块茎膨大过程中,B1和DHCY的直链和支链淀粉含量也呈先上升后降低的变化趋势。支链淀粉含量变化较大,在T1已经进入快速积累期,在T3时B1和DHCY的支链淀粉含量均显著高于其他时期,T1~T5期间DHCY的支链淀粉含量均显著高于B1(图1,Ⅱ)。但2个品种山药块茎直链淀粉含量均一直维持较低水平,且在2品种之间变化趋势不明显,DHCY的直链淀粉含量高于B1,但未达到显著水平(图1,Ⅲ)。
2个品种山药块茎不同膨大时期的异淀粉酶(ISA)活性测定结果(图1,Ⅳ)显示,在整个膨大期,B1的酶活性均高于DHCY,酶活性从T1开始增加,至T3开始下降,且仅在T3时期2个品种山药的ISA活性呈显著性差异。

取样时期为种植后的天数;不同大写字母表示同一品种不同取样时间之间的显著差异(P<0.05);不同小写字母表示不同品种同一取样时间的显著差异(P<0.05);图5同图1 山药块茎膨大期淀粉组分含量及异淀粉酶活性的变化Different capital letters indicate significant differences among different sampling times of the same variety (P<0.05); Different normal letters indicate significant differences among different varieties at the same sampling time (P<0.05); The same as Fig.5Fig.1 Changes of starch and component contents and starch debranching enzyme activity during the expansion stage of yam tubers
2.2 ISA3基因的克隆
以山药块茎总RNA反转录cDNA为模板,使用ISA3-ORF-F和ISA3-ORF-R为引物,进行PCR扩增,获得大小约为1 500 bp的条带(图2)。经测序后表明ISA3基因的ORF片段长1 584 bp,共编码527个氨基酸(图3)。
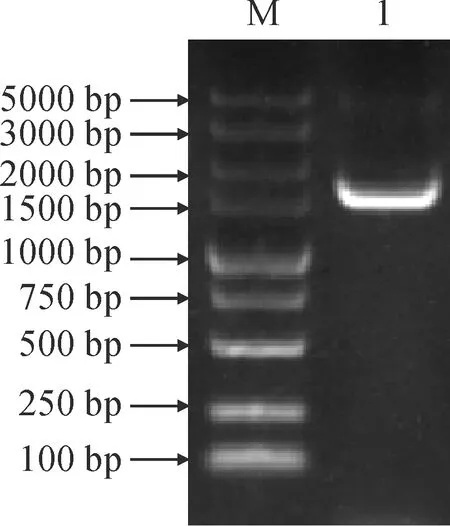
M. DL5000;1. PCR产物图2 ISA3的ORF扩增M. DL5000; 1.PCR productFig.2 ISA3 open reading frame amplification

图3 ISA3的CDS序列及其推导的氨基酸序列Fig.3 CDS and its deduced amino acid sequences of ISA3
2.3 ISA3蛋白序列和进化分析
对山药ISA3蛋白理化性质分析,预测ISA3基因编码蛋白的理论分子量为60.21 kD,分子式为C2703H4054N740O783S24,总原子数8 304,等电点为6.15。ISA3蛋白的总平均疏水性为-0.484,预测为亲水性蛋白。CDD分析显示,ISA3蛋白含有AmyAc_Glg_debranch(alpha amylase catalytic domain found in glycogen debranching enzymes)结构域。SOPMA分析预测ISA3蛋白的二级结构,该蛋白主要由α螺旋(h)、β转角(t)、无规则卷曲(c)和延伸链构成,其中无规则卷曲最多,占氨基酸序列的51.04%,其次为α螺旋(24.10%)和延伸链(18.60%),β转角最少(6.20%)。
选取NCBI中Blastp 搜索与其序列一致性较高的单子叶和双子叶植物ISA3,以及广泛研究的水稻、玉米等物种的ISA3蛋白,构建系统进化树(图4)。结果表明,山药ISA3蛋白与同为薯蓣科的几内亚山药和参薯的ISA3蛋白聚在一个分支。从系统进化树(图4)可以看出,山药ISA3蛋白与小果野蕉、椰子和海枣等单子叶植物遗传距离较近,与辣椒、莲和野大豆等双子叶植物遗传距离较远,而野生稻、小麦和玉米等禾本科单子叶植物则形成另一个分支。

图4 山药ISA3氨基酸序列与其他物种同源序列的进化树分析Fig.4 Evolutionary tree analysis of the amino acid sequence of yam ISA3 and homologous sequences of other species

表2 山药块茎膨大期淀粉合成关键酶活性及其基因表达量与淀粉含量的相关性
2.4 ISA3基因的表达分析
对2个品种山药ISA3基因在不同膨大时期以及不同组织中的表达模式进行分析。结果(图5)表明,在B1中,ISA3基因的表达量呈先上升后降低的趋势,T1~T2时期的表达量显著升高随后下降,在T2时期的表达量显著高于其余各时期。而DHCY山药中ISA3基因的表达呈下降的趋势,在T1之后的表达量显著降低,且其余时期无显著变化(图5)。2个品种山药ISA3基因不同组织的表达情况(图6)表明,在B1中ISA3基因的表达量为块茎>叶片>茎,在DHCY中ISA3基因的表达量为茎>叶>块茎。结果说明,不同品种山药ISA3在不同组织存在特异性表达。
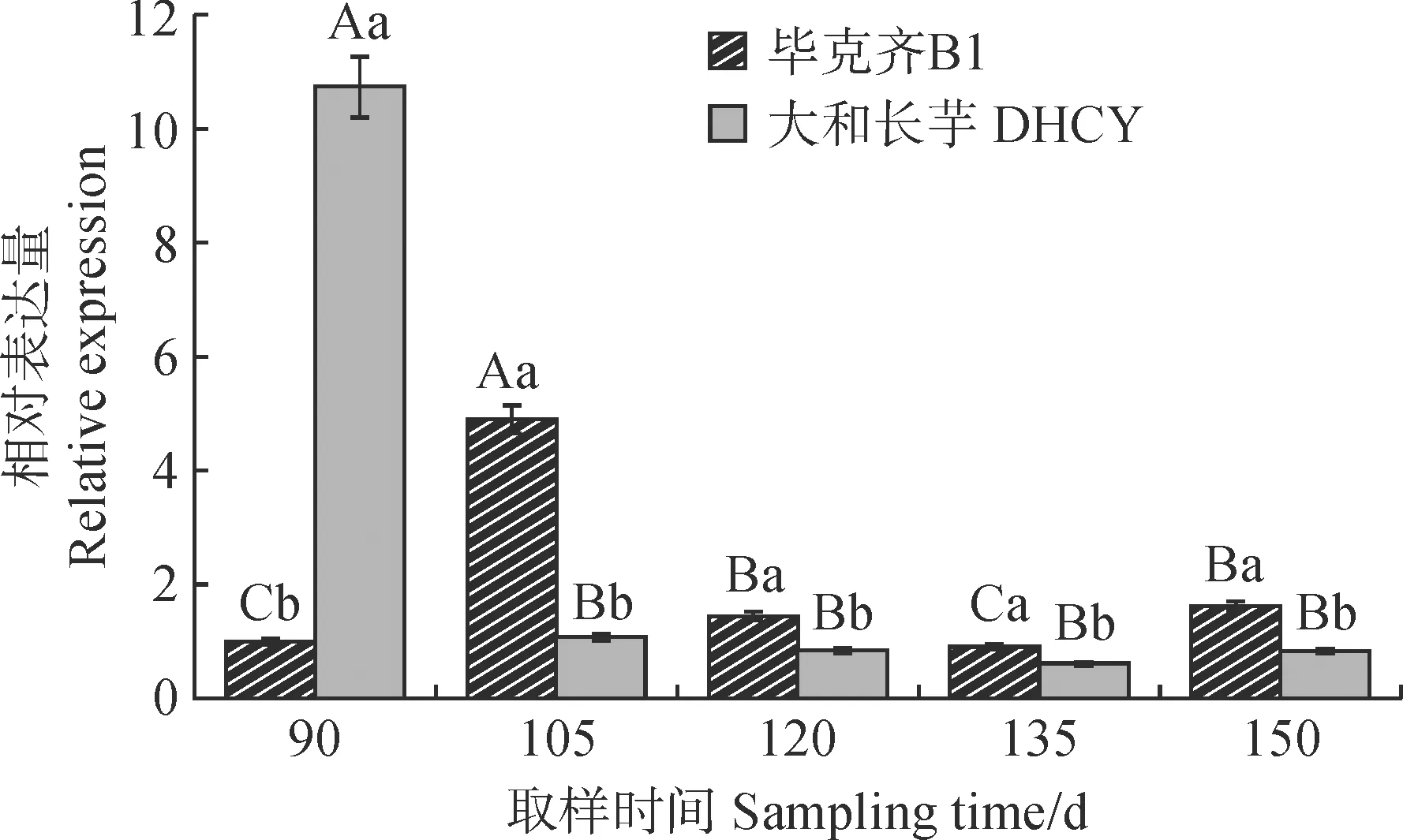
图5 山药块茎膨大期ISA3的表达变化Fig.5 Changes of ISA3 expression during the tuber expansion of yam
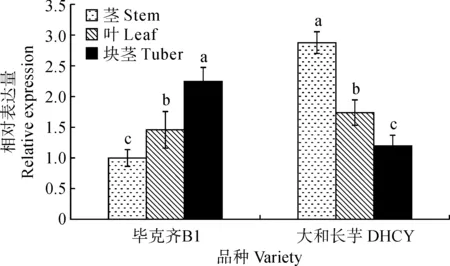
不同小写字母表示不同组织间差异显著图6 山药不同组织中ISA3的表达The normal letters mean significance difference among different tissuesFig.6 Expression of ISA3 in different tissues of yam
2.5 相关性分析
在山药块茎膨大过程中,分别分析了2个品种山药直链淀粉含量、支链淀粉含量、淀粉含量、ISA酶活性及ISA3基因表达之间的相关性。结果(表2)发现,在B1和DHCY山药块茎内,淀粉含量与支链淀粉含量、直链淀粉含量之间呈极显著正相关关系。在2个品种山药块茎中,ISA活性与淀粉含量、直链淀粉含量和支链淀粉含量之间均为正相关关系。在B1中,ISA活性与淀粉和支链淀粉含量呈显著正相关关系(r=0.560、0.565,P<0.05)。在DHCY中,ISA活性与淀粉和支链淀粉含量呈极显著正相关关系(r=0.775、0.781,P<0.01)。在B1中,ISA基因表达量与ISA活性呈负相关关系,且在DHCY中达到极显著负相关关系。
3 讨 论
淀粉的合成降解代谢与植物器官的发育密切相关[17],是影响块茎产量和品质的重要因素[18]。淀粉在食品以及工业生产上都有着极大的经济价值,因此,对于淀粉的生物合成和降解机理也越来越受到研究者的关注[19-20]。异淀粉酶是淀粉代谢过程中的关键酶,直接参与支链淀粉的合成[21]。本研究中2个品种山药ISA与支链淀粉和淀粉含量呈显著和极显著正相关关系,且在淀粉含量高的品种DHCY中的相关性系数高于淀粉含量低的品种B1。在水稻灌浆过程中非糯品种与糯稻品种异淀粉酶活性变化特性不同,非糯品种呈单峰曲线变化,并且直链淀粉含量低的品种灌浆各时期的酶活性显著高于含量高的品种,胚乳中较高的异淀粉酶活性有利于支链淀粉的合成,而支链淀粉的合成积累却降低了直链淀粉的积累[22]。野生型拟南芥异淀粉酶的缺失可导致突变系中淀粉的积累减少90%,并且糖原的积累也减少90%[23]。说明异淀粉酶活性有利于支链淀粉的合成,而支链淀粉的合成积累对直链淀粉的积累起到相对抑制的作用。
ISA编码的3种亚型基因已经在很多作物及藻类中分离出来[24-25],其中包含将淀粉储存在籽粒中的水稻[26]、玉米[27]、大麦等[28],以及淀粉集中在块根(茎)中的木薯、甘薯和山药等作物[29-30]。本研究采用转录组测序和RT-PCR方法,从山药中分离鉴定了ISA3基因,蛋白序列分析表明,山药ISA3蛋白在结构上含有糖原脱支酶中的α淀粉酶催化的结构域,表明ISA3蛋白有淀粉酶催化、降解支链淀粉为糖原等功能。Pawinee等[31]克隆了木薯异淀粉酶异构体3(MeISA3)的全长基因,并在大肠杆菌SoluBL21(DE3)中进行了克隆和表达。在马铃薯中,已经发现了3个参与淀粉合成的ISA同工酶,分别是Stisa1、Stisa2、Stisa3,他们分别由ISA1、ISA2、ISA3基因编码,Stisa1和Stisa2通过形成复合体的形式催化水解淀粉,而Stisa3能够单独参与淀粉的分解过程[32],因此,由ISA3基因编码的Stisa3在淀粉代谢过程中起着至关重要的作用。这些结果表明,ISA3基因参与调控多种不同植物的淀粉代谢。研究发现,不同淀粉含量作物品种的异淀粉酶同工型具有不同的基因表达模式。ISA3的表达量在山药块茎膨大时期呈双峰趋势,与ISA酶活性、支链淀粉和淀粉含量变化趋势相反,呈负相关和极显著负相关关系,推测ISA3基因对ISA活性起着负调控作用,从而影响支链淀粉结构及淀粉的合成。ISA3表达模式具有很强的组织特异性,在叶、茎与块茎组织中均有表达,且在不同品种不同组织之间存在特异表达。侯夫云等[33]为研究甘薯块根淀粉合成酶基因的表达特征,以淀粉含量不同的2个品种为试验材料,利用转录组数据克隆了甘薯异淀粉酶IbISA的cDNA片段,并对块根不同生长期淀粉合成相关酶基因IbISA的表达进行研究,表明IbISA基因表达量呈双峰曲线变化,在栽插后100 d时表达量达到高峰,低淀粉品种的IbISA表达量显著高于高淀粉品种。这与本研究结果一致。在玉米的淀粉合成通路中分离ISA基因在30 d时上调表达,同时也检测到该基因所对应的蛋白也在30 d时上调表达,促进支链淀粉的合成[34]。这与本研究结果不一致,可能是物种不同或ISA家族不同基因行使的功能不同所致。Zhu等[35]对NnISAs基因的在莲不同部位的表达模式进行分析表明,NnISAs转录表达水平在叶、叶柄、地下茎、种子和根组织中均可检测到,且NnISA3的表达模式与NnISA1和NnISA2的表达趋势有明显的不同,在叶柄中转录水平较高。不同植物中的ISAs表达模式也不一定相同,ISAs基因正在从不同的植物中被克隆鉴定,ISA虽不决定植物器官形成,但可能参与调控支链淀粉和淀粉的合成,从而调控植物生长发育的过程。而ISA在山药中怎样与下游蛋白互作、与哪些通路相关联从而影响山药块茎内淀粉的合成及其在淀粉结构中的功能还需进一步研究。
