葡萄醛酮还原酶(AKR)基因家族的鉴定与表达分析
2023-01-04周雪婷梁国平卢世雄郭丽丽陈佰鸿
周雪婷,梁国平,卢世雄,郭丽丽,陈佰鸿,毛 娟
(甘肃农业大学 园艺学院,兰州 730070)
醛酮还原酶(AKR)是NADPH依赖型的氧化还原酶超家族的成员之一,可以催化许多羰基化合物的还原。AKR家族具有经典的(α/β)8桶状折叠结构。其中,(α/β)8桶状结构羧基端的3个环(Loop A、 B、C)的组成和大小决定其底物的特异性[1]。AKR催化活性位点由N末端Asp50、Tyr55、Lys84所构成[1],而Asp50、Tyr55、Lys84、His117是AKR催化四联体,被认为是醛酮还原酶负责底物催化的关键氨基酸[2]。
AKR基因可能从藻类开始就参与生理活动。研究表明,AKR基因确实在植物生长发育中发挥了重要作用,尤其在藻类中外源性物质解毒方面[3]。在植物生长发育的各个阶段,植物会遇到一些生物和非生物胁迫[4]。植物在受到紫外线[5]、干旱[5-9]、化学农药[7]、重金属[7,10]、高浓度盐[9]、高温和低温[9-10]、病原菌毒素[11-12]等胁迫时,活性氧与活性乙醛水平增加,将导致植物体受到损伤[13],生物体中含有许多发生氧化还原反应的酶,这些酶能促进细胞的生长发育[14],植物会利用大量具有氧化还原活性的酶类使有毒物质分解为毒性较小的乙醇和碳水化合物,而醛酮还原酶家族通常催化醛、酮、类固醇以及其他羰基化合物的还原[9]。在非生物胁迫下,植物醛酮还原酶基因表达量增加,醛酮还原酶增加,从而将有毒的羰基化合物转化为相应的无毒醇类化合物。有研究表明,编码毛地黄醛酮还原酶的DpARs基因可以被干旱胁迫诱导表达[15]。苜蓿AKR基因可以被干旱胁迫诱导表达,并且在细菌中过表达AKR可以代谢多种底物,包括胁迫诱导产生的羟基壬烯醛[7]。当植物细胞中水含量降低时,AKR4C1—AKR4C4通过产生增强渗透压的物质(如山梨醇)来维持细胞组分的完整性[6,16-18]。在干旱胁迫下水稻细胞中的丙酮醛含量增加,而丙酮醛的活性羰基基团能共价修饰DNA和蛋白质,此时水稻醛酮还原酶AKR4C14可以将丙酮醛还原成相应的醇[19]。
醛酮还原酶基因的研究多见于动物细胞和人类中[7],但其生理作用在植物中的研究相对较少。葡萄是一种主要的具有重要经济效益的果树树种,在全世界范围广泛种植。在中国西北地区存在着许多对葡萄生长发育不利的因素,如干旱、盐碱、寒冷等。本研究以葡萄对非生物胁迫为切入点,利用生物信息学方法,分析葡萄AKR家族基因的理化性质及蛋白质结构等,并通过qRT-PCR初步研究其在激素和模拟非生物胁迫条件下的表达情况,为提高葡萄抗非生物胁迫提供一定的理论参考。
1 材料和方法
1.1 试验材料及处理
试验材料是‘黑比诺’葡萄(Vitisvinifera‘Pinot Noir’)试管苗,保存在甘肃农业大学的果树生理与生物技术实验室。将单芽茎段接于50 mL GS固体培养基上,置于LED白光下(光照16 h,温度25 ℃,黑暗8 h,温度20 ℃)继代培养30 d后,选择长势良好且无污染的试管苗,在超净工作台中将其完整地从培养基上取出用灭菌水冲洗根部,然后继续培养在分别含有400 mmol·L-1NaCl[20]、10% PEG[21-22]、0.2 mmol·L-1ABA[23]、50 mg·L-1GA3[24-25]、0.05 mg·mL-1NAA[26]、5 mmol·L-1SA[27]、0.1 mmol·L-1MeJA[27-29]的GS液体培养基中,以等体积蒸馏水处理作为对照;在低温植物培养箱中进行4 ℃低温胁迫处理[29],以正常生长的试管苗作为对照。均处理24 h,每个处理设置3组重复。然后取样、保存、提取RNA。
1.2 方 法
1.2.1 葡萄AKR基因家族鉴定及序列分析从拟南芥基因组数据库TAIR(https://www.arabidopsis.org/)中下载AKR基因家族的CDS序列,并导入葡萄基因组数据库(https://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis/)中,得到葡萄AKR家族基因并下载其全长、CDS序列和氨基酸序列等[22,30]。使用DNAMAN工具进行筛选,剔除重复片段序列。
用ExPASy数据库(https://web.expasy.org/protparam/)对蛋白质的理论等电点、氨基酸大小、分子量等进行分析[31]。用在线网站(http://mg2c.iask.in/mg2c_v2.1/)进行染色体定位。用在线软件GSDS 2.0(http://gsds.cbi.pku.edu.cn/)进行基因结构分析。用在线网站(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page =npsa_sopma.html)对二级结构进行分析;用WoLF PSORT(http://www.genscript.com/wolfpsort.html)在线软件对亚细胞定位进行预测。
1.2.2 系统进化树、选择压、密码子偏好性、共线性分析用葡萄AKR家族基因的氨基酸序列和从拟南芥数据库及Phytozome基因组网站(https://phytozome.jgi.doe.gov/pz/portal.html)分别获得的拟南芥、柑橘和番茄AKR家族成员的氨基酸序列(表1);用ClustalX对拟南芥、柑橘、番茄和葡萄的氨基酸序列进行多重比对;用MEGA 5.0软件构建系统发育树并进行自检(bootstrap)[32],重复设定默认值为1000;用网站(http://www.bork.embl.de/pal2nal/)进行选择压分析;用网站(https://galaxy.pasteur.fr/?form=codown)进行密码子偏好性分析;用各数据库中获取的葡萄、柑橘、番茄和拟南芥的相关信息,利用TBtools的Multiple Synteny Plot进行4个物种间的共线性关系分析。

表1 葡萄、柑橘、番茄和拟南芥AKR基因家族基本信息
1.2.3 葡萄AKR基因家族的荧光定量分析应用实时荧光定量PCR仪,以VvGAPDH作为内参基因[33],由上海生工股份有限公司在线设计并合成VvAKR基因引物序列(表2)。用CTAB法提取葡萄试管苗根、茎、叶中的RNA,利用Evo M-LV反转录试剂盒Ⅱ进行反转录合成cDNA,将其稀释到相同浓度作为实时荧光定量的PCR模板,qRT-PCR的反应体系总体积20 μL,包括10 μL的2×SYBR,1 μL cDNA,上、下游引物各1 μL,ddH2O 7 μL。基因相对表达量采用2-ΔΔCT法进行分析[34]。
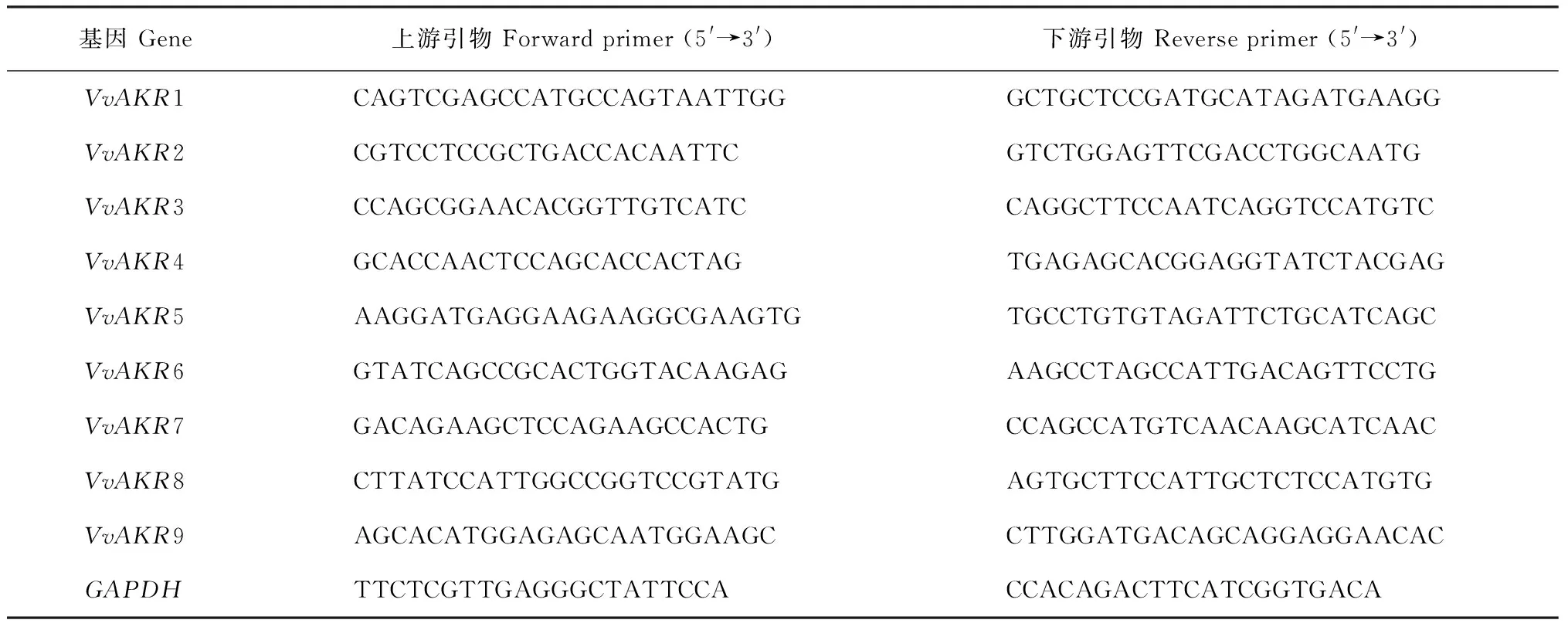
表2 葡萄AKR基因家族的实时荧光定量引物
1.3 数据处理与统计分析
使用Excel 2010和SPSS 22.0软件对试验数据进行统计分析,采用单因素(One-way ANOVO)的Duncan检测(P< 0.05)对数据进行显著性分析[20],使用Origin Pro 9.0软件进行作图。
2 结果与分析
2.1 葡萄AKR基因家族理化性质及蛋白质结构和亚细胞定位分析
通过同源比对,共得到9个葡萄AKR基因(VvAKR1~VvAKR9),分布于葡萄5条染色体上(Chr1、Chr3、Chr4、Chr5、Chr8),其中有3个基因在第5条染色体上。在第3、8条染色体上分别含有2个基因,第1、4条染色体上分别有1个基因(图1)。VvAKR2蛋白序列最长,VvAKR9蛋白序列最短,氨基酸残基数介于275~268之间,等电点介于5.1~9.1之间,分子量为30 440~307 078.63 kD,基因外显子数介于5~46之间。葡萄AKR基因家族主要集中定位在细胞质、叶绿体、细胞核中。葡萄AKR基因家族编码蛋白质二级结构主要以α-螺旋和不规则卷曲为主。在VvAKR中α-螺旋在32.88%~73.97%之间、不规则卷曲在20.18%~44.66%之间、β-转角在1.84 %~7.40 %之间(表3)。
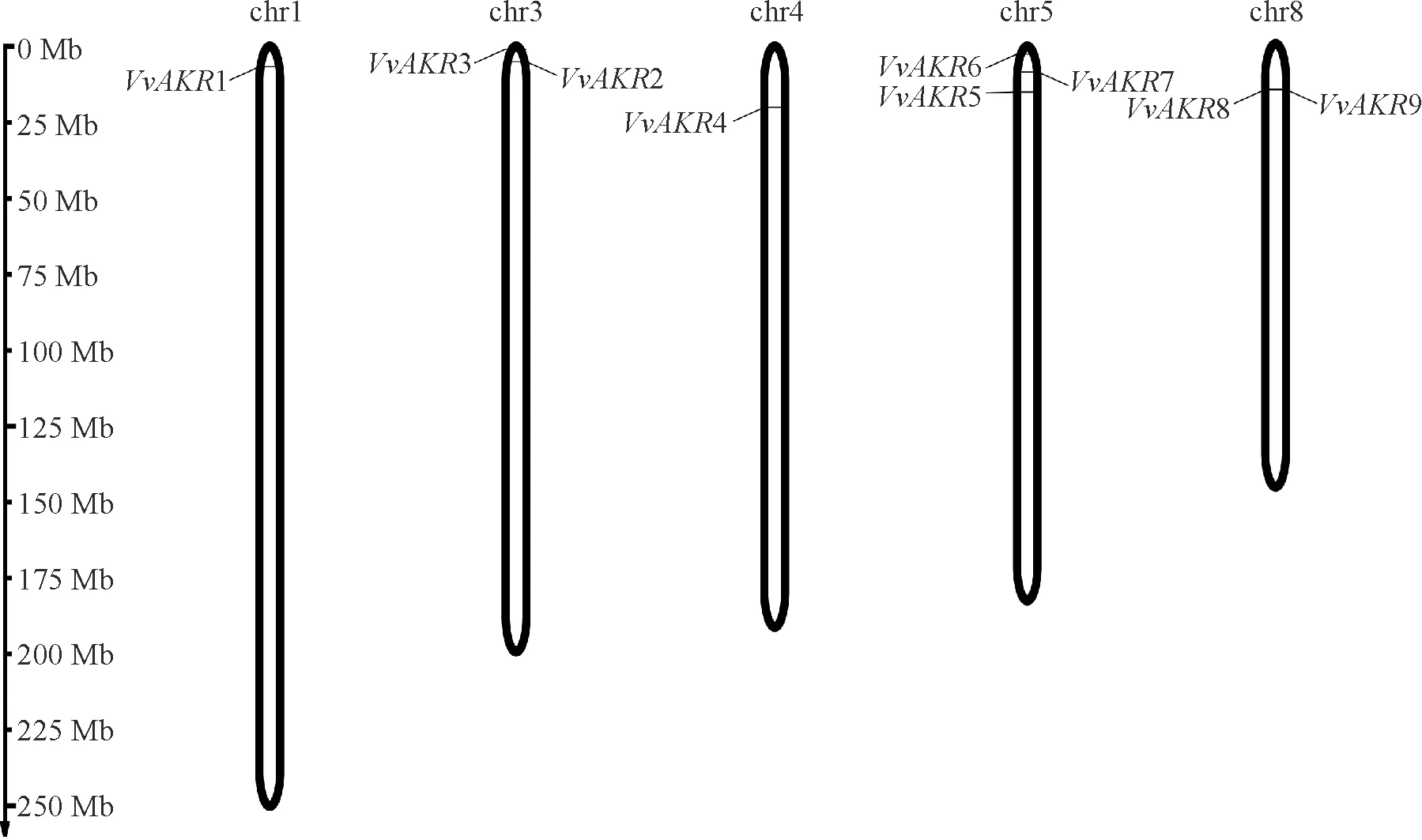
图1 葡萄AKR基因家族染色体定位Fig.1 Chromosomal locations of AKR gene family in grape
2.2 葡萄AKR基因家族基因结构和系统进化分析
用葡萄、柑橘、番茄和拟南芥等4个物种AKR基因的氨基酸序列构建系统进化树(图2),结果显示:该基因家族分为6个亚族(Group1~Group6);Group1包含10个成员,分为2个小分支Ⅰa(2个VvAKR、4个AtAKR)和Ⅰb(2个CitAKR、1个VvAKR、1个SlAKR);在Group2、3、4、5中分别含有5、2、1、1个成员;在Group6中有11个成员,分为2个小分支Ⅵa(2个VvAKR、2个AtAKR)和Ⅵb(3个VvAKR、4个AtAKR),在第6亚族中,葡萄AKR家族成员最多。各分支中,葡萄VvAKR和拟南芥AtAKR进化关系较近。

Vv. 葡萄;At. 拟南芥;Cit. 柑橘;Sl. 番茄图2 葡萄、拟南芥、柑橘和番茄AKR家族的系统进化树Vv. V.vinifera; At. A.thaliana; Cit. C.sinensis; Sl. S.lycopersicumFig.2 The phylogenetic tree of AKR family in grape,A. thaliana, citrus and tomato

表3 葡萄AKR基因家族信息、蛋白质二级结构分析和亚细胞定位预测
葡萄AKR基因家族成员的基因结构(图3)分析显示:基因结构基本相似,均含有内含子和外显子。其中,除VvAKR3、VvAKR8和VvAKR9基因结构完整外,VvAKR1和VvAKR7不含有上下游基因序列,VvAKR4不含有下游基因序列,VvAKR2、VvAKR5和VvAKR6不含有上游基因序列。VvAKR2外显子数最多有46个,VvAKR1外显子数最少有5个。
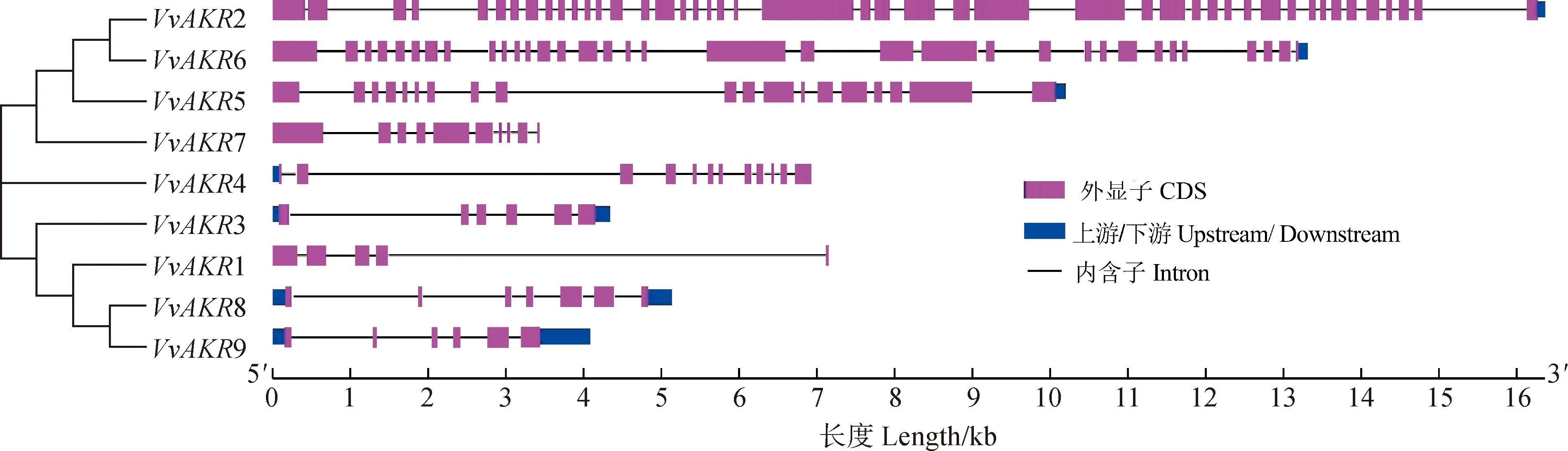
图3 葡萄AKR基因家族成员基因结构Fig.3 Gene structure of AKR gene family members in grape
2.3 葡萄AKR基因家族密码子偏好性分析
对葡萄AKR基因组密码子进行分析(表4)。结果表明,葡萄中所有基因的Gravy值都为负值,说明AKR基因家族成员为亲水性蛋白。有效密码子数结果显示,基因的Nc值在51.63~61.00之间,平均值为55.35;密码子适应指数(CAI)范围在0.19~0.28之间;都表明该基因家族密码子偏好性较弱。GC和GC3s平均值分别为0.45和0.42,表明密码子组成偏向A与T碱基。
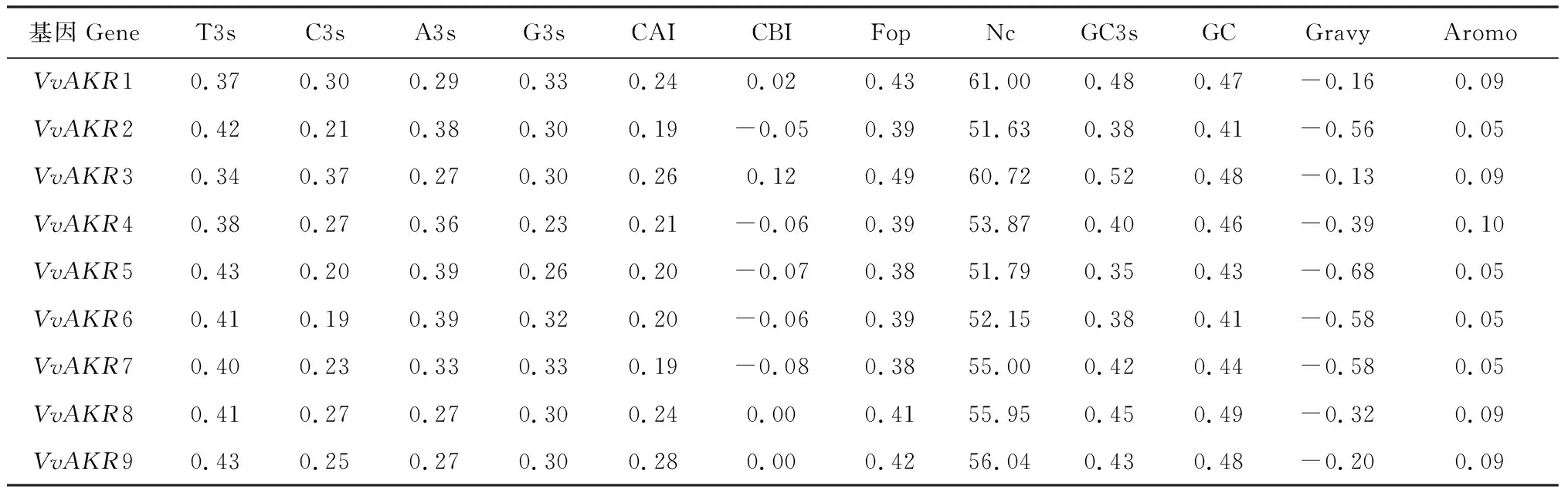
表4 葡萄AKR基因家族密码子使用特性
计算葡萄AKR基因的相对同义密码子使用度(RSCU)(表5),发现了34种密码子的RSCU值大于1,表现为使用偏好,是理想的密码子。分别是UUU、UUG、CUU、CUC、CUG、AUU、AUC、AUG、GUU、GUG、UCU、UCC、UCA、CCU、CCA、ACU、ACA、GCU、GCA、UAU、UAA、CAU、CAG、AAU、AAG、GAU、GAG、UGU、UGA、UGG、AGA、AGG、GGU、GGC。
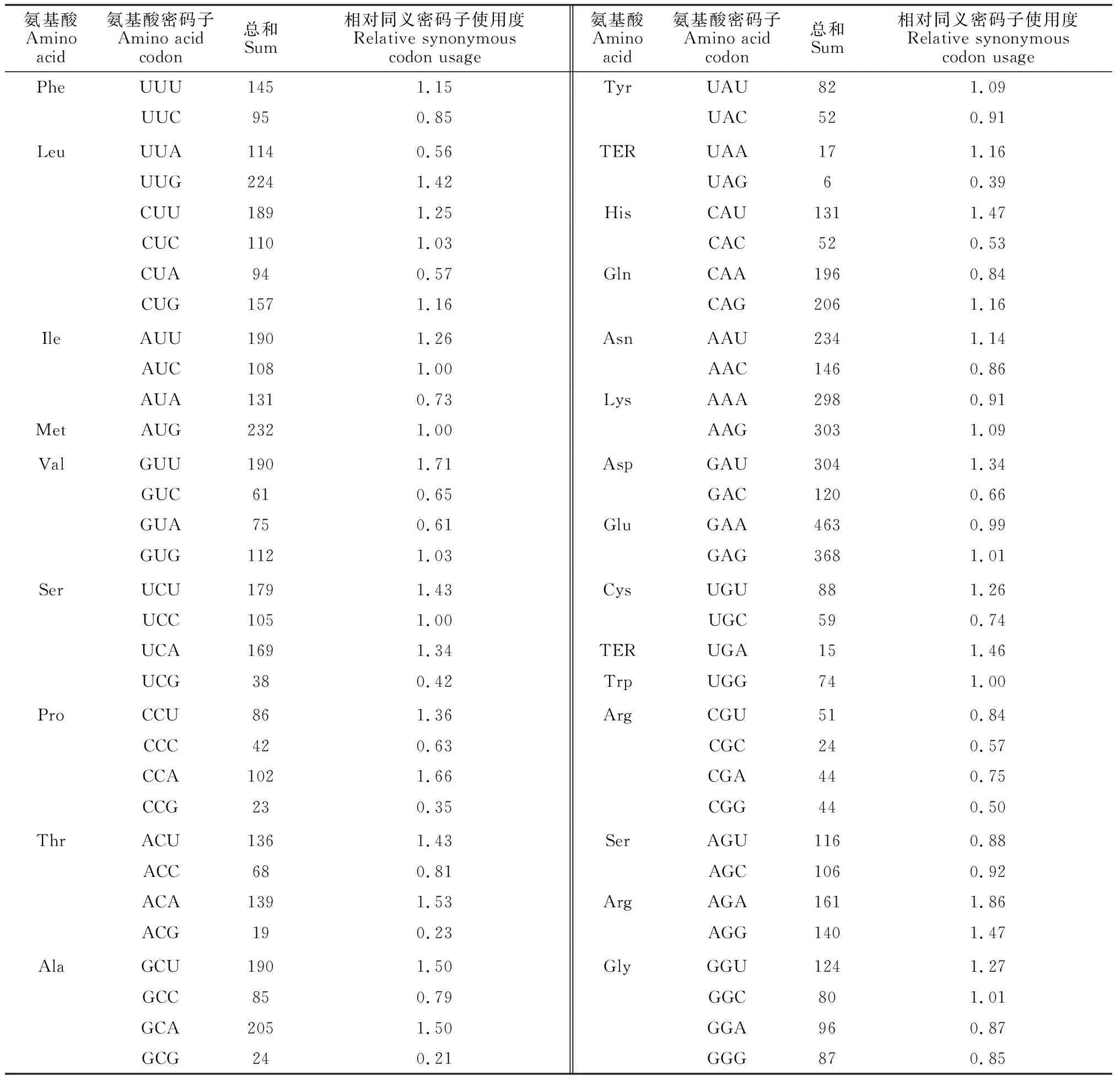
表5 葡萄AKR家族基因同义密码子使用频率
2.4 AKR基因家族选择压和共线性分析
对AKR基因家族进行选择压分析,计算Ka/Ks的值,若该值小于1,则表示纯化选择;若该值等于1,则中性进化;若该值大于1,则正选择。将所有拟南芥基因与葡萄基因进行计算,获得所有葡萄基因的Ka/Ks(表6)。结果表明,在葡萄和拟南芥两物种中除了VvAKR9基因与拟南芥Ka/Ks大于1,表现为正向选择;其余葡萄和拟南芥AKR家族基因间Ka/Ks均小于1,表现为纯化选择。认为AKR家族基因在葡萄和拟南芥之间主要进行纯化选择,没有中性进化。
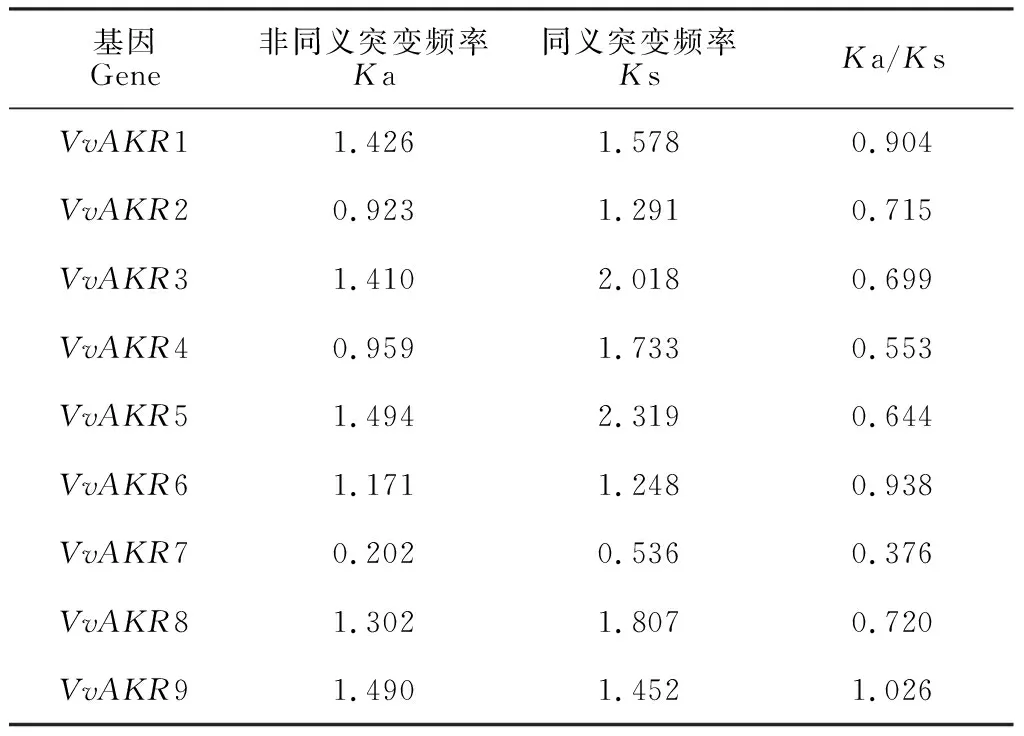
表6 葡萄和拟南芥AKR基因家族的选择压分析
通过共线性关系分析发现(图4),葡萄、拟南芥、番茄和柑橘4个物种内各基因存在复制现象且较为明显,4个物种之间也存在复制现象。其中,葡萄9个AKR基因中VvAKR8和VvAKR9之间共线性较强,拟南芥15个AKR基因中AtAKR7和AtAKR8之间,AtAKR12和AtAKR14之间共线性较强。

Vv. 葡萄;At. 拟南芥;Cit. 柑橘;Sl. 番茄图4 葡萄与柑橘、番茄、拟南芥AKR家族基因的共线性关系Vv. V. vinifera; At. A. thaliana; Cit. C. sinensis; Sl. S. lycopersicumFig.4 Collinearity of AKR family genes between grape, citrus, tomato and A. thaliana
2.5 葡萄AKR基因家族的荧光定量分析
对葡萄AKR基因家族的9个基因进行实时荧光定量分析,结果表明,葡萄根、茎、叶对激素和非生物胁迫的响应程度有差异(图5),VvAKR基因主要在叶组织中进行表达,其次是根组织,在茎组织中表达量较低。

CK. 对照(4 ℃处理以常温作为对照,其余处理以蒸馏水作为对照);1~9. VvAKR1~VvAKR9;小写字母表示同一组织组织中不同基因间差异显著(P< 0.05)图5 不同处理下葡萄不同组织间AKR基因的相对表达CK. Control (4 ℃ treatment with normal temperature as control, and other treatments with distilled water as control);1-9. VvAKR1—VvAKR9;Different normal letters indicate significant differences (P< 0.05)Fig.5 The relative expression of AKR genes in different tissues of grape under different treatments
在不同激素处理下,用0.2 mmol·L-1ABA处理时,主要在叶组织中进行表达,其中VvAKR1显著上调表达,是对照的69倍;根组织中只有VvAKR3显著上调表达。用0.05 mg·mL-1NAA处理时,叶组织VvAKR1呈极显著上调表达,是对照的112.7倍;茎组织中VvAKR3显著上调。用50 mg·L-1GA3处理时,主要在叶组织中进行表达,其中VvAKR1呈极显著上调表达,是对照的208.8倍;茎组织中VvAKR3显著上调表达。
用0.1 mmol·L-1MeJA处理时,在叶、根组织中表达量较高,分别以VvAKR1、VvAKR6上调表达最为显著,分别是对照的112、60.9倍。用5 mmol·L-1SA处理时,主要在根组织中进行表达,其中VvAKR8表达最显著,是对照的145.3倍;叶组织中VvAKR1显著上调。
在非生物胁迫下,用400 mmol·L-1NaCl处理时,主要在叶、根组织中表达量较高,分别以VvAKR1、VvAKR3上调表达最为显著,分别是对照的26.8、43.8倍。在4 ℃低温胁迫下,叶组织中表达量最高,其中VvAKR1极显著上调,是对照的131.6倍。其次是根组织,其中VvAKR8显著上调,是对照的74.8倍;茎组织中VvAKR9显著上调。在10% PEG处理下,根、茎组织中VvAKR3均呈显著上调,分别是对照的69.4、28倍;叶组织中VvAKR1显著上调,是对照的24.6倍。
3 讨 论
醛酮还原酶(AKR)以还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)作为其辅酶,能将醛酮类化合物还原成相应的醇类[35-38]。当前关于醛酮还原酶基因的研究,相对于植物来说在动物细胞和人类中较为多见[39]。本研究通过已知拟南芥AKR基因的CDS序列从葡萄基因组数据库中同源搜索到9个VvAKR基因。将葡萄、拟南芥、柑橘和番茄4个物种AKR基因的氨基酸序列进行系统进化分析,该基因家族可分为6个亚族,葡萄AKR家族成员只存在于第1、2和6亚族,其中第6亚族含有的葡萄AKR家族成员最多,VvAKR8和VvAKR9是1对旁系同源基因且在响应非生物胁迫中都呈上调表达。理化性质分析结果显示,葡萄AKR家族序列氨基酸数量存在较大差异,介于275~2 686之间,所有蛋白均为亲水性蛋白,等电点在5.1~9.1之间,与苜蓿AKR家族结果相似[40]。亚细胞定位预测显示,VvAKR蛋白主要集中定位在细胞质、叶绿体和细胞核中,与苜蓿AKR家族[40]和马铃薯AKR家族[41]主要定位在叶绿体的结果有相似。通过对拟南芥各基因和葡萄各基因之间选择进化分析发现,Ka/Ks小于1,因此,认为葡萄和拟南芥基因间可能存在纯化选择关系。
用qRT-PCR技术分析葡萄AKR基因在激素诱导和非生物胁迫下的抗性。该家族基因在根、茎、叶不同组织中对激素和非生物胁迫的响应程度有差异。在盐、干旱和低温非生物胁迫下,葡萄根、茎、叶组织中VvAKR1、VvAKR3、VvAKR8和VvAKR9基因表达量较高;在激素处理下,根组织中VvAKR3、VvAKR6和VvAKR8基因在ABA、MeJA、SA处理下表达量较高;茎组织中VvAKR3基因在NAA、GA3处理下表达量较高;叶组织中VvAKR1基因在各激素处理下表达量都较高。在高浓度盐胁迫下,拟南芥AKR基因的表达量显著提高[9]。毛地黄的醛酮还原酶DpARs基因可以被高浓度盐所诱导表达[42]。苜蓿中鉴定出的AKR基因在高浓度盐胁迫下的植物防御系统中起关键作用[43]。以上研究与葡萄AKR基因在盐胁迫下的表达情况一致。在高温胁迫下,毛地黄的醛酮还原酶如DpARs基因可以被诱导表达[42]。在低温胁迫下,水稻细胞中的丙酮醛含量增加,此时水稻AKR4C14可以被诱导表达,将丙酮醛还原成相应的醇[19]。这与葡萄AKR基因在低温胁迫下的表达情况相似。有研究人员从番茄等物种克隆得到AKR基因[43-44],发现AKR基因能促进植物细胞的生长发育及代谢过程,对于干旱、低温和高盐刺激有抵抗能力[44-45]。此研究结果与葡萄AKR基因在非生物胁迫(盐、干旱以及低温)条件下的表达情况一致。大麦胚胎中的AKR4C1蛋白质通过响应脱落酸(ABA)的诱导,在失水条件下能增强植物细胞的抗性[46]。此研究与葡萄AKR基因在脱落酸的诱导下表达情况一致。
综上所述,本研究从葡萄基因组网站共获得9个VvAKR基因,先进行生物信息学分析,然后用qRT-PCR技术进行分析,葡萄AKR家族VvAKR1、VvAKR3、VvAKR6、VvAKR8和VvAKR9基因在激素和非生物胁迫下的表达量较高。本试验为进一步研究葡萄AKR基因家族在非生物胁迫下的功能鉴定提供了一定的理论依据。
