姜黄素下调miR-21表达缓解ox-LDL诱导的血管内皮细胞损伤
2023-01-03刘佳奇刘绥军
刘佳奇,刘绥军
冠状动脉粥样硬化性心脏病(冠心病,CHD)是指动脉粥样硬化引起的冠状动脉(冠脉)狭窄或梗阻,导致心肌缺血、缺氧或坏死。冠心病是目前全球死亡的主要原因之一,我国约有1100万冠心病患者[1,2]。探索冠心病发展的潜在分子机制将为其防治提供新思路。越来越多的研究发现使用天然有效物质可减少血管疾病的发生,姜黄素具有天然多酚活性,含有三种姜黄素类化合物(姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素),其中姜黄素为主要成分[3]。研究证据表明,姜黄素在心血管疾病、慢性炎症、神经退行性疾病和癌症等方面均具有治疗价值[4]。姜黄素可通过影响UCP2信号传导、或增加一氧化氮的生物利用度,减少氧化应激,以改善中老年人血管内皮功能,预防中风[5,6]。MicroRNAs(miRNAs)是一组内源性的非编码小RNA,长度约为18~25个核苷酸。人类miRNAs占所有基因的1%,但可调节约三分之一基因的表达、修饰、转录和翻译[7]。更多的临床研究聚焦于miRNAs的功能,微小RNA-21(MicroRNA-21,MiR-21)位于染色体17q23-2,在细胞活力、血管生成和抗凋亡、葡萄糖稳态等多种生理和血管病变过程中相关[8-10],并参与某些有效活性成分调控血管内皮细胞分化等功能[11]。本研究采用氧化低密度脂蛋白(ox-LDL)诱导构建血管内皮细胞损伤模型,探究姜黄素通过调控miR-21表达加强血管内皮细胞的增殖、迁移与侵袭功能,发挥潜在心血管保护作用。
1 材料与方法
1.1 试验材料与试剂人血管内皮细胞系血管内皮(VE)细胞购自中国科学院上海生物化学与细胞生物学研究所。姜黄素购自美国Sigma公司;ox-LDL购自MCE(MedChemExpress)公司;胎牛血清(FBS)、DMEM高糖培养基、胰蛋白酶购自美国Gibco公司;青霉素-链霉素双抗混合液购自美国Sigma公司;TRIzol试剂购自美国Life Technologies公司;CCK-8试剂盒和BCA蛋白浓度检测试剂盒购自碧云天科技有限公司;逆转录试剂盒和荧光定量试剂盒购自大连宝生物有限公司;miR-21、增殖细胞核抗原(PCNA)、基质金属蛋白酶9(MMP-9)和GAPDH引物合成自苏州金唯智生物科技有限公司;兔源GAPDH、PCNA和MMP-9一抗以及HRP标记的二抗均购自美国Abcam公司。
1.2 细胞培养复苏细胞,在培养液中加入10%FBS和100 U/ml双抗,置于37℃,5%CO2的恒温培养箱中进行孵育培养。取对数生长期的VE细胞,用0.25%胰蛋白酶进行消化传代。待细胞生长至密度约50%~60%,更换为无血清培养基进行培养。取对数生长期VE细胞并接种于96孔板,分别加入0、10、50、100、200、400、1000 μg/ml的ox-LDL;或0、5、10、50、100、200 μg/ml的姜黄素,CCK-8法检测各浓度下细胞增殖活力,确定适宜的ox-LDL和姜黄素处理浓度。将VE细胞分为空白组(未处理)、模型组(100 μg/ml ox-LDL)和姜黄素组(100 μg/ml ox-LDL+50 μg/ml姜黄素)。其中模型组在VE细胞中加入100 μg/ml的ox-LDL诱导的CHD血管内皮细胞损伤模型[12]。姜黄素组在VE细胞中加入100 μg/ml的ox-LDL和50 μg/ml的姜黄素。
1.3 CCK-8实验检测细胞增殖向每孔细胞加入10 μl CCK-8溶液,培养4 h,加入DMSO溶液终止反应。利用酶标仪检测450 nm波长下细胞吸光度值(OD值),以空白孔测定值作为空白对照,分析各组细胞活力。
1.4 划痕实验检测细胞迁移将密度为5×105/ml的VE细胞常规培养,直至形成单层细胞;用灭菌10 μl白色Tip枪头在单层培养细胞上划一条直线,Tip枪头尽量垂直,显微镜下观察并记录,随后用PBS洗去脱落的细胞。在显微镜下观察并拍照。将细胞置于37℃、5%的恒温培养箱中培养,24 h后用PBS洗去划落的细胞,于倒置显微镜下观察并拍照,分析细胞从致伤区迁移的相对距离。
1.5 Transwell实验检测细胞侵袭按照1:20的稀释比例将基质胶稀释,取稀释液100 μl,将稀释液均匀涂于包被小室底部基底膜,放置在4℃环境中风干。向每个Transwell小室加100 μl DMEM培基水化基底膜,37℃静置1 h后用1%血清的DMEM培养液重悬细胞至浓度为1×105/ml;往小室外加入含10%血清的DMEM培养液900 μl,在每个小室内接种细胞数约1×105,常规培养24 h;取出Transwell小室,PBS洗涤后用4%多聚甲醛固定 30 min;待小室底部的膜风干,晶紫染液染色 20 min后,放PBS反复淋洗,经光学显微镜100倍放大观察、照相,每组随机选取5个视野计数。
1.6 荧光定量PCR(RT-qPCR)实验检测基因表达VE细胞处理48 h后,向每孔细胞中加入1 ml TRIzol试剂提取细胞总RNA,根据反转录试剂盒说明书步骤合成cDNA,以此cDNA为模板进行荧光定量PCR检测。反应条件如下:95℃ 30 s;40个循环的95℃ 5 s及 60℃ 30 s。目标基因的表达使用GAPDH作为内参,定量结果采用2-ΔΔCt表示。引物序列:miR-21-F:5'-C GCGCTAGCTTATCAGACTGA-3',miR-21-R:5'-GTGCAGGGTCCGAGGT-3';U6-F:5'-GCTT CGGCAGCACATATACTAAAAT-3',U6-R:5'-C GCTTCACGAATTTGCGTGTCAT-3';PCNA-F:5'-GAAGATCTCGCTTCCTCCAATGTATGCT-3',PCNA-R:5'-TCGACCATGGTGGCGGAGTGGCAA CAA-3';MMP-9-F:5'-TCTATGGTCCTCGCCCT GAA-3',MMP-9-R:5'-CATCGTCCACCGGACT CAAA-3';GAPDH-F:5'-AGACACCATGGGGAA GGTGAA-3',GAPDH-R:5'-ATTGCTGATGATC TTGAGGCTG-3’。
1.7 Western blot检测蛋白表达VE细胞处理48 h后,向每孔细胞中加入150 μl蛋白裂解液RIPA提取总蛋白。将样本与上样缓冲液按照对应比例混匀,沸水煮10 min使蛋白质变性。样品(每孔上样30 μg)通过SDS-PAGE电泳凝胶混合液恒压电泳, 采用湿转法将凝胶上的蛋白转移至PVDF膜,将膜置于5% BSA,脱色摇床封闭2 h。TBST洗3次后4℃孵育一抗(1:1000)过夜。TBST洗PVDF膜3次,每次5 min,室温孵育二抗(1:4000)1 h。TBST洗涤PVDF膜3次,每次5 min,避光环境中用ECL发光试剂盒进行显影,并在化学发光仪器中曝光拍照。最终结果表示为目标条带与内参GAPDH的光密度比值。
1.8 统计学分析本研究采用SPSS 21.0软件进行数据分析,计量资料采用均数±标准差,两组间样本分析采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 血管内皮细胞损伤模型建立CCK-8结果显示,10、50、100、200、400、1000 μg/ml ox-LDL处理组细胞存活率分别为(85.979±3.142)%、(75.209±2.824)%、(58.916±3.138)%、(48.810±2.087)%、(41.531±4.530)%和(32.647±2.264)%,与空白组(0 μg/ml)相比,各组细胞存活率均明显下降(P<0.05)。其中使用100 μg/ml ox-LDL处理VE细胞的存活率约60%,故选择此浓度构建血管内皮细胞损伤模型。
2.2 姜黄素对ox-LDL诱导损伤VE细胞增殖的影响CCK-8结果显示,与空白组相比,模型组VE细胞活力降低(P<0.01),表明100 μg/ml ox-LDL处理显著降低了VE细胞的增殖活力,证实模型构建成功。与模型组相比,姜黄素组VE细胞活力明显增加(P<0.05),证明50 μg/ml姜黄素处理可明显减轻ox-LDL诱导的VE细胞增殖抑制,表1。

表1 白藜芦醇影响LPS诱导的VE细胞增殖
2.3 姜黄素对ox-LDL诱导损伤VE细胞迁移的影响细胞划痕实验结果显示,空白组ox-LDL诱导损伤VE细胞伤口愈合程度为(64.397±4.648)%、模型组为(33.063±3.532)%、姜黄素组为(61.773±2.451)%。模型组VE细胞伤口愈合程度显著低于空白组(P<0.01);姜黄素组VE细胞伤口愈合程度显著高于模型组(P<0.01),表明50 μg/ml姜黄素处理明显减轻ox-LDL诱导的VE细胞迁移抑制,图1。
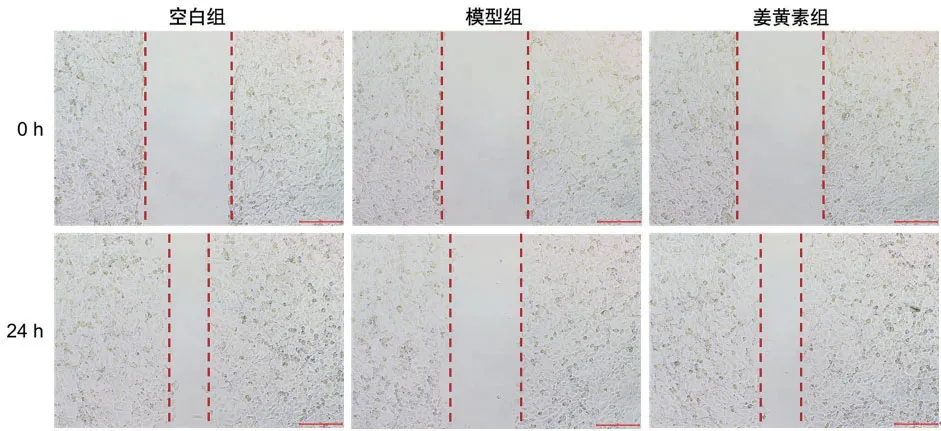
图1 VE细胞迁移情况
2.4 姜黄素对ox-LDL诱导损伤VE细胞侵袭的影响Transwell小室实验结果显示,空白组明显减轻了ox-LDL诱导的VE细胞穿膜细胞数量(404.333±10.105)个,模型组(256.667±11.865)个,姜黄素组(393.000±11.547)个。模型组VE细胞穿膜细胞数量明显低于空白组(P<0.01);姜黄素组VE细胞穿膜细胞数量高于模型组(P<0.01),表明50 μg/ml姜黄素处理明显减轻ox-LDL诱导的VE细胞侵袭抑制,图2。

图2 VE细胞侵袭情况
2.5 姜黄素对ox-LDL诱导损伤VE细胞相关因子表达的影响RT-qPCR和Western blot结果显示,与空白组相比,模型组VE细胞PCNA(P<0.01)和MMP-9(P<0.01)的mRNA和蛋白表达水平降低。与模型组相比,姜黄素组VE细胞PCNA和MMP-9的mRNA及蛋白表达水平均升高(P<0.01),图3~4。

图3 PCNA和MMP-9的mRNA相对表达量情况
2.6 姜黄素抑制ox-LDL诱导损伤VE细胞中miR-21的表达RT-qPCR检测结果显示,空白组VE细胞中miR-21的相对表达量为1.000±0.080,模型组中miR-21的相对表达量为8.020±0.483,姜黄素组中miR-21的相对表达量为2.241±0.205,姜黄素处理明显抑制ox-LDL诱导损伤VE细胞中miR-21的表达(P<0.01),图5。
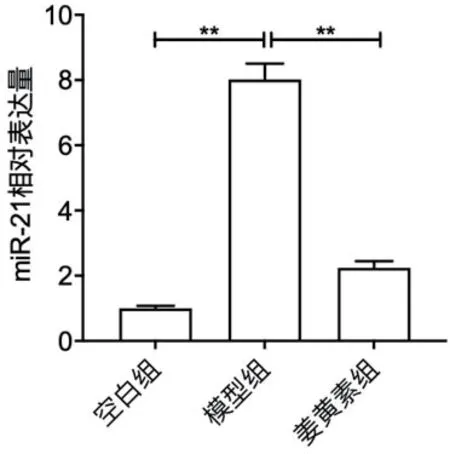
图5 miR-21表达情况
3 讨论

图4 PCNA和MMP-9蛋白表达情况
血管内皮细胞是血管壁的重要组成部分,血管内皮细胞的异常增殖和迁移是冠心病、高血压、经皮冠状动脉介入治疗后再狭窄等疾病的重要病理生理过程。本研究发现,不同浓度(10~1000 μg/ml)的ox-LDL处理VE细胞存活率均有不同程度下降,采用100 μg/ml的ox-LDL处理VE细胞,构建CHD血管内皮细胞损伤模型。姜黄素作为一种在我国已使用了几个世纪的香料和食用色素,由多种分子靶点(包括转录因子、生长因子、受体、细胞因子、趋化因子和酶等)介导,发挥抗氧化性、抗炎、抗纤维化和抗肿瘤特性等治疗活性[13-15]。研究显示,姜黄素可能对一系列与衰老相关的疾病(如糖尿病、高血压、神经退行性疾病、骨质疏松症,以及心血管疾病和动脉粥样硬化等),具有协同疗效[16,17]。关于姜黄素治疗应用的一个新兴研究领域是改善血管功能障碍,与降低心血管疾病风险有关。为进一步探究姜黄素在冠心病血管内皮功能中的作用,我们在ox-LDL诱导的血管内皮细胞损伤模型中添加50 μg/ml的姜黄素进行处理,检测发现ox-LDL诱导模型组VE细胞的增殖、迁移和侵袭过程均受到明显抑制,而姜黄素处理明显增强了VE细胞的增殖、迁移和侵袭能力,表明姜黄素能够缓解由于ox-LDL引起的血管内皮损伤。另外,ox-LDL诱导下调了VE细胞中PCNA和MMP-9表达,姜黄素在一定程度上增加了VE细胞中PCNA和MMP-9表达。PCNA是DNA复制的重要组成部分,是DNA聚合酶d和DNA聚合酶e的辅助蛋白,也是DNA重组和修复所必需[18],是细胞增殖标志物。MMP-9是金属基质蛋白酶,在细胞转移的过程中发挥着重要的作用。研究显示姜黄素能够抗动脉粥样硬化,这种特性与其维持内皮细胞功能的有益作用有关。姜黄素可调节内皮细胞动力学,一定程度上防止血管内皮功能障碍[19]。同样,姜黄素改善内皮功能,减少跨内皮单核细胞迁移[20]。血管新生是对缺血的一种修复性反应,血管生成是导致动脉壁粥样硬化斑块形成的主要原因,可能导致心脏病发作和中风。根据细胞类型不同,姜黄素具有抗血管生成或促进血管生成的作用(如抑制肿瘤细胞的血管生成[15],增强内皮祖细胞血管生成[17,19]等)。
miRNAs与多种心血管疾病的治疗相关,包括冠心病。研究显示miRNAs在调节冠心病发病机制中至关重要,包括影响心肌肥厚、心肌重构和血管生成等。研究显示miR-21在冠心病患者外周血单个核细胞PBMC中的异常高表达[21]。另外,miR-21不仅能够抑制冠心病中内皮祖细胞EPCs的血管生成,还能够促进心肌细胞凋亡。总之,miR-21是心血管疾病的显著调控因子,其SNPs rs1292037(T>c)和rs13137(a>T)与冠心病风险增高和预后不良相关。除SNPs外,miR-21的生物学功能可能被其他机制改变(如DNA甲基化等),因此miR-21在冠心病中的转录调控仍需进一步探索。本研究中,我们检测发现miR-21在ox-LDL诱导损伤VE细胞中异常高表达,而姜黄素处理显著抑制miR-21表达,提示姜黄素可能抑制miR-21表达,诱导血管内皮细胞增殖和转移等过程来改善血管内皮功能紊乱。
综上所述,本研究表明姜黄素能够促进ox-LDL诱导损伤血管内皮细胞VE的增殖、迁移与侵袭,阻滞血管内皮的恶性发展,其分子作用机制可能与抑制miR-21表达有关。本研究在细胞层面证实了姜黄素影响miR-21表达,缓解血管内皮功能损伤,为其在血管内皮治疗的临床推广提供一定依据。
