阿替利珠单抗的不良事件风险信号挖掘Δ
2022-12-29狄潘潘胡云飞孟祥松钱会贾淑云亳州市人民医院静配中心安徽亳州6800亳州学院中药学院安徽亳州6800亳州市人民医院呼吸与危重症医学科安徽亳州6800
狄潘潘,胡云飞,孟祥松,钱会,贾淑云(.亳州市人民医院静配中心,安徽 亳州 6800;.亳州学院中药学院,安徽 亳州 6800;.亳州市人民医院呼吸与危重症医学科,安徽 亳州 6800)
阿替利珠单抗(atezolizumab)是一种全人源化的免疫球蛋白G1单克隆抗体,于2016年获美国FDA审批上市,于2020年在我国获批上市,用于治疗局部晚期或转移性尿路上皮癌的成人患者。该药可与程序性死亡配体1(programmed death ligand-1,PD-L1)结合并阻断PDL1与程序性细胞死亡蛋白(programmed cell death protein-1,PD-1)、B7.1受体的相互作用,解除PD-1/PD-L1信号通路介导的免疫抑制,提高免疫系统对肿瘤细胞的识别和杀伤作用,从而达到清除肿瘤细胞的作用[1]。该药具有显著的临床疗效,但同时也伴随各种免疫相关不良反应,如Stevens-Johnson综合征[2]、严重脑炎[3]及重症肌无力[4]等。虽然药物在上市前都会经过一系列有效性和安全性的评估研究,但因用药疗程和观察时间较短,较难发现一些迟发的、罕见的不良反应,加之阿替利珠单抗在我国上市时间较短,国内关于其安全性的研究极少。因此,本文对美国FDA不良事件呈报系统(FDA adverse event reporting system,FAERS)数据库中关于阿替利珠单抗上市后的药品不良事件(adverse drug events,ADEs)数据进行挖掘,分析ADEs风险信号,以期为该药的临床安全使用提供参考。
1 资料与方法
1.1 资料来源
本研究所用数据来自FAERS数据库(https://www.fda.gov/drugs/questions-and-answers-fdas-adverse-eventreporting-system-faers/fda-adverse-event-reporting-systemfaers-public-dashboard),并通过OpenVigil 2.1数据平台查询FAERS数据库。
1.2 数据提取和筛选
以“atezolizumab”和“tecentriq”为检索词进行检索,收集阿替利珠单抗从上市(2016年5月18日)至2022年3月31日的ADEs报告。根据国际人用药品注册技术协调会开发的《国际医学用语词典》(Medical Dictionary for Regulatory Activities,MedDRA)(23.0版)药物不良反应术语集中的首选术语(preferred term,PT)和系统器官分类(system organ classification,SOC)对ADEs进行描述和分类。删除药物适应证或产品储存错误等作为ADEs风险信号的报告,以减少偏倚。
1.3 数据挖掘
目前用于鉴别ADEs风险信号的数据挖掘技术主要为比例失衡法,也称不相称性测定法,其中的报告比值比(reporting odds ratio,ROR)法、比例报告比值比(proportional reporting ratio,PRR)法、英国药品和保健产品管理局(Medicines and Healthcare Products Regulatory Agency,MHRA)的综合标准法(以下简称“MHRA法”)为常用的数据挖掘方法,该3种方法均基于四格表法[5]。比例失衡法基本原理为目标药物-事件组合的频率明显高于整个数据库的背景频率,且达到一定的阈值,提示目标药物与ADEs之间具有关联性,就认为产生了一个信号[6]。PRR值和ROR值越大,表明药物与ADEs的关联性越大,信号强度越强。由于PRR法具有较高的灵敏性,容易出现假阳性信号[7],因此本研究采用ROR法和MHRA法的统计指标来挖掘阿替利珠单抗的ADEs风险信号。信号判定标准为:ROR法——病例报告数≥3,ROR值的95%置信区间(confidence interval,CI)下限>1;MHRA法——病例报告数≥3,PRR值>2,χ2值≥4[8]。
2 结果
2.1 ADEs报告的基本信息
共检索到以阿替利珠单抗为首要怀疑药物的ADEs报告16 051份,其中男性高于女性,年龄主要分布在19~64岁和≥65岁。ADEs报告人口学特征见表1。
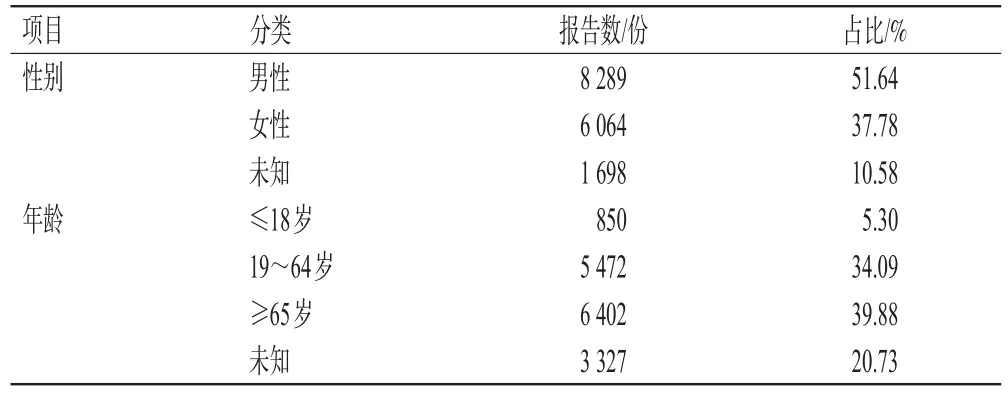
表1 阿替利珠单抗ADEs报告的人口学特征
2.2 风险信号挖掘
共检索到以阿替利珠单抗为首要怀疑药物的PT 1 868个,再经ROR法和MHRA法筛选后最终获得401个PT,涉及ADEs报告8 817份。其中,累计报告数较多的PT包括发热、疾病进展、间质性肺病、贫血症和肺炎等,信号较强的PT包括全身免疫激活、黄斑增厚、副肿瘤神经综合征和内分泌毒性等。此外,还挖掘出说明书未载入的ADEs风险信号,如黄斑增厚、副肿瘤神经综合征、反应性穿孔性胶原病、副肿瘤性皮肌炎、抗红细胞抗体阳性和肺结节病。阿替利珠单抗报告数排序前10位的PT见表2,信号强度排序前10位的PT见表3。
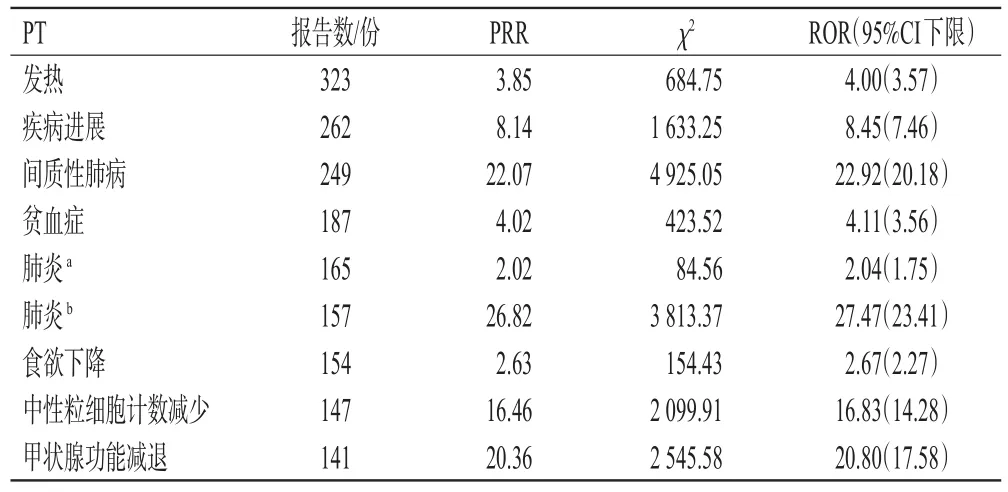
表2 阿替利珠单抗报告数排序前10位的PT
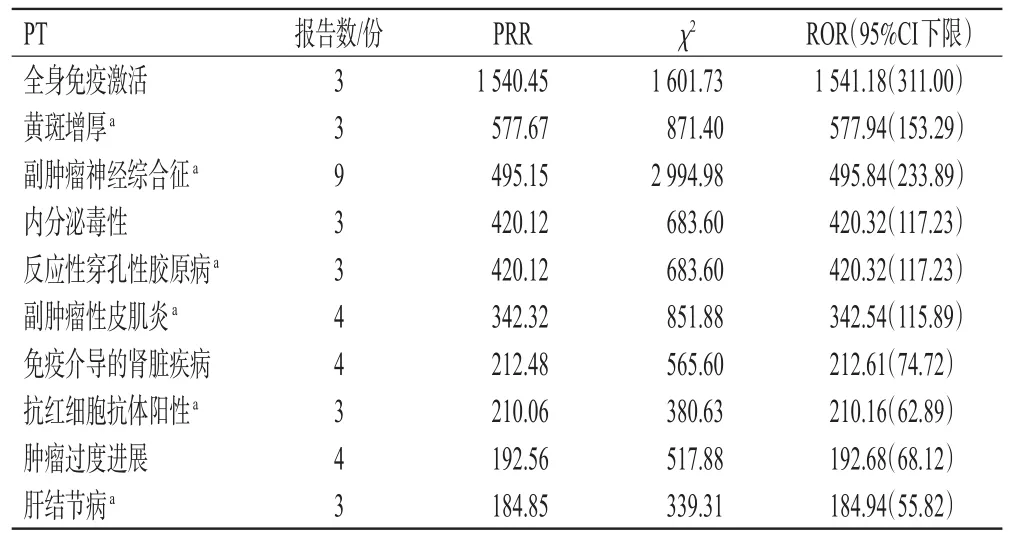
表3 阿替利珠单抗信号强度排序前10位的PT
2.3 ADEs累及的SOC分析
依据MedDRA对信号强度前50位的PT进行SOC分类排序,共涉及17个SOC(图1)。17个SOC中,累计报告数较多的SOC包括肾脏及泌尿系统疾病,良性、恶性及性质不明的肿瘤(包括囊肿和息肉)和内分泌系统疾病等,PT数最多的SOC为良性、恶性及性质不明的肿瘤(包括囊肿和息肉)。
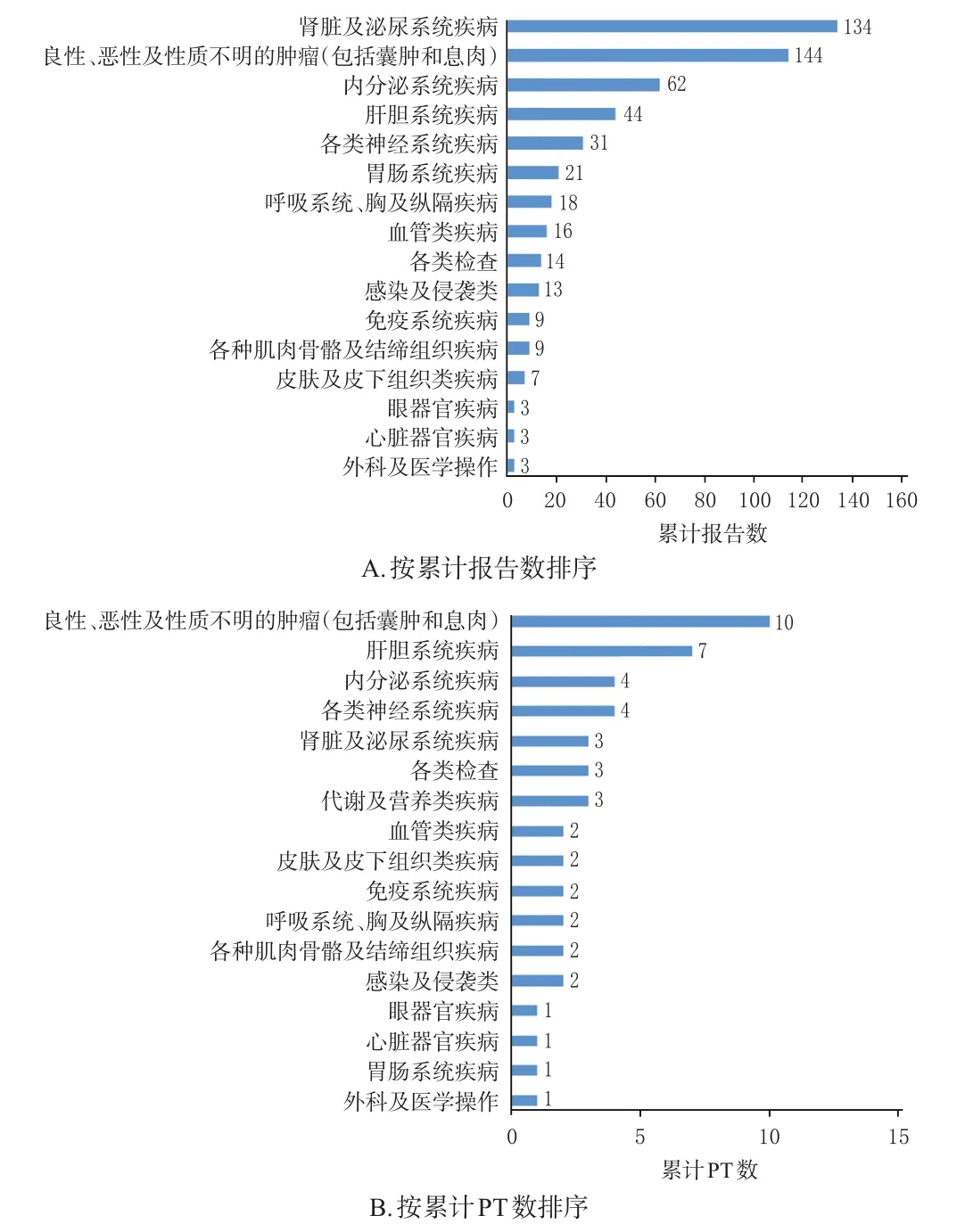
图1 阿替利珠单抗ADEs风险信号累及的SOC分布
3 讨论
3.1 说明书已载入的ADEs
根据阿替利珠单抗说明书,十分常见(≥1/10)或常见(1/100~<1/10)的不良反应有贫血、中性粒细胞减少症、血小板减少症、白细胞减少症、甲状腺功能减退、发热、食欲下降及周围神经病等,与本研究结果基本一致。这提示临床医务人员应对接受阿替利珠单抗治疗的患者进行定期检查,尤其是血常规检查,一旦发现异常应及时干预。
经ROR法和MHRA法分析可知,401个PT中信号强度排序第1位的PT为全身免疫激活,其他较强的PT还有免疫介导的肾脏疾病,且已作为不良反应收录在阿替利珠单抗说明书中。此类ADEs的发生与阿替利珠单抗激活T细胞,导致免疫过度有关[9]。由于免疫介导性疾病导致的死亡率较高[10],因此在患者使用阿替利珠单抗时,临床应特别关注其免疫介导性疾病的发生情况,一旦发病应及时予以激素和对症治疗[11]。如果患者出现3~4级上述免疫相关不良反应,则必须永久停止使用阿替利珠单抗。
3.2 说明书未载入的ADEs风险信号
本研究发现,信号强度排序前10位的PT中,有6个PT未收录在阿替利珠单抗说明书中,分别为黄斑增厚、副肿瘤神经综合征、反应性穿孔性胶原病、副肿瘤性皮肌炎、抗红细胞抗体阳性及肝结节病。
黄斑增厚虽报告数较少,但信号强度较高,在新发现的ADEs中排列第1位。黄斑增厚可见于葡萄膜炎和糖尿病黄斑水肿等多种眼部疾病[12-13],也是白内障术后患者视力不佳的重要原因之一[14]。阿替利珠单抗说明书中罕见关于眼部ADEs的描述,仅提及眼睑红斑、眼睑发疹及内分泌性眼病。与阿替利珠单抗致黄斑增厚相关的最常见ADEs为葡萄膜炎,属于免疫性不良反应。据报道,免疫检查点抑制剂(Immune checkpoint inhibitors,ICIs)致葡萄膜炎的发生率约为1.0%[15]。DOW等[16]回顾性研究126例ICIs致葡萄膜炎的结果显示,83.6%的患者在治疗开始后的6个月内发生葡萄膜炎,平均持续时间为9周,主要表现为前葡萄膜炎、中间葡萄膜炎、后葡萄膜炎和泛葡萄膜炎。阿替利珠单抗的后葡萄膜炎发生率最高,其次为泛葡萄膜炎。虽然阿替利珠单抗的眼部ADEs并不常见,但眼部毒性可能会影响患者视力,显著降低患者的生活质量,临床医师应予以重视。
副肿瘤神经综合征是信号强度排序第2位的新发现ADEs,是一种常伴随肿瘤发生的、会对神经系统造成损伤的综合征[17]。副肿瘤神经综合征亦属于免疫性疾病,发病率较低,临床表现多样,因而易被误诊[18]。ICIs致副肿瘤神经综合征的病例极为罕见[17],且致病机制尚未明确,推测可能与ICIs治疗后增强肿瘤神经抗原特异性T细胞的活性有关[19]。本研究显示,阿替利珠单抗致副肿瘤神经综合征的报告数仅有9例,但却具有强关联性。这提示接受阿替利珠单抗治疗的患者,若出现神经系统方面的异常,在排除其他致病原因之后,可考虑为阿替利珠单抗相关性副肿瘤神经综合征。
反应性穿孔性胶原病是本研究发现的又一个ADEs高风险信号,且未收录在阿替利珠单抗说明书中。反应性穿孔性胶原病是一种较为罕见的、良性、多因素引起的穿孔皮肤病,发病部位一般位于躯干和四肢伸肌表面[20]。阿替利珠单抗等ICIs致反应性穿孔性胶原病的病例报道更为罕见[21]。由于该病发病率低,发病机制不明且患者表现各异,因此临床上难以将其与其他皮肤疾病区分开,常造成漏诊或误诊[22]。反应性穿孔性胶原病的病变部位特征为脐状、继发性火山口状、角化过度的丘疹和/或结节,并伴有剧烈瘙痒[23]。因此在使用阿替利珠单抗等ICIs期间,若发现患者出现上述皮肤异常,临床医师应予以高度关注。
本研究中,包含PT数最多的SOC为良性、恶性及性质不明的肿瘤(包括囊肿和息肉)。这可能是由于肿瘤常存在进展、复发及转移情况,因此该SOC成为了阿替利珠单抗常见的累及系统。从表2也可以看出,“疾病进展”的报告数较多,也从侧面说明单独使用阿替利珠单抗控制肿瘤的效果可能不佳。FAERS数据库属于自发呈报系统,任何人都可以上报各种ADEs,所以不可避免有非专业人员将疾病诊断作为ADEs上报。因此,良性、恶性及性质不明的肿瘤(包括囊肿和息肉)可能属于疾病本身的病程进展而不属于新的ADEs,但具体情况还需临床进一步证实。
3.3 本研究的局限性
虽然本研究的样本量较大,但局限性也较为明显。首先是FAERS数据库中的报告存在填写不规范和部分数据丢失的情况。其次是即使研究采用了ROR法和MHRA法,但仍有可能产生假阳性的ADEs信号。这是因为此类研究的结果是基于报告数量,而与生物学无关联,因此ADEs与药物之间的关联并不是必然的。最后,FAERS数据库中的报告多来自欧美人群,因此研究结果不完全适用于亚洲人群。
4 结语
本研究基于美国FAERS数据库,采用ROR法与MHRA法相结合的ADEs信号挖掘方法,所得结果除阿替利珠单抗说明书已载入的ADEs外,还挖掘出了黄斑增厚、副肿瘤神经综合征、反应性穿孔性胶原病等多种说明书未收录的ADEs风险信号,这在一定程度上弥补了阿替利珠单抗安全性研究的不足,也为临床安全使用该药提供了参考。建议临床在使用阿替利珠单抗过程中,应重点关注患者眼部、神经及皮肤系统方面的异常表现,并及时予以干预,以保障患者用药安全。
