红花多糖对人肝癌细胞凋亡和自噬的影响及潜在机制Δ
2022-12-29白皓天杨婧李娅兰牛捷张翔珂张筠昊梁霄王锐黑龙江中医药大学药学院哈尔滨50040黑龙江中医药大学基础医学院哈尔滨50040教育部北药基础与应用研究重点实验室哈尔滨50040
白皓天,杨婧,李娅兰,牛捷,张翔珂,张筠昊,梁霄,王锐,(.黑龙江中医药大学药学院,哈尔滨 50040;.黑龙江中医药大学基础医学院,哈尔滨 50040;.教育部北药基础与应用研究重点实验室,哈尔滨 50040)
肝癌是较为常见的原发恶性肿瘤之一,具有发病率、病死率较高和预后差等特点,是目前人类难以攻克的病症之一[1]。红花多糖(safflower polysaccharide,SPS)是中药红花Carthamus tinctoriusL.的主要活性成分之一,与化疗药物联用有增强后者疗效、降低后者毒副作用的效果[2-3];同时有研究证实,SPS能通过调控细胞凋亡和细胞周期来发挥对胃癌、乳腺癌等多种恶性肿瘤细胞增殖的抑制作用[4]。磷脂酰肌醇-3-激酶(phosphatidylinositide 3-kinase,PI3K)/蛋白激酶 B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路是肝癌细胞内的重要信号通路,其相关蛋白异常将导致通路功能改变,从而影响肿瘤细胞的增殖、凋亡、转移和侵袭[5]。研究表明,自噬可促进肿瘤细胞凋亡或坏死,与肿瘤的发生发展密切相关[6]。SPS具有诱导肝癌细胞凋亡的作用[2],但其能否通过调节自噬来抑制肿瘤的发生发展及具体作用机制尚不清楚。为此,本研究以人肝癌细胞作为研究对象,研究SPS对其自噬与凋亡的影响,初步探讨SPS抗肝癌的潜在作用机制,以期为临床治疗提供理论支持。
1 材料
1.1 主要仪器
本研究所用主要仪器包括Friocell 22型CO2恒温培养箱(德国Mmm Group公司),Infinite 50型酶标仪(美国BioTek公司),DYCZ-2DN型电泳仪、WD-9423B型化学发光分析仪(北京六一生物科技有限公司),BD Accuri C6型流式细胞分析仪(美国BD公司),CKX41型光学显微镜(日本Olymypus公司),EOS 700D型数码相机(日本Canon公司),DMi1型荧光倒置显微镜(德国Leica公司)等。
1.2 主要药品与试剂
红花药材(批号200301)购自黑龙江雪灵峰中药饮片有限公司,经黑龙江中医药大学中药药剂教研室王锐教授鉴定为菊科红花属植物红花C.tinctoriusL.的干燥花。
DMEM培养基(批号10-013-CVRC)购自美国Corning公司;胎牛血清(批号04-007-1A)购自以色列Biological Industries公司;MTT试剂(批号M8180)购自北京索莱宝科技有限公司;Hoechst 33258染液、Beyo ECL Plus试剂(批号分别为C1017、P0018S)均购自碧云天生物技术有限公司;苏木精-伊红(HE)染液(批号Top 0046)购自北京博奥拓达科技有限公司;BCA总蛋白定量测定盒(批号A045-4-2)购自南京建成生物工程研究所;AO染色试剂盒、Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒(批号分别为I314FA0005、TE55AA6547)均购自生工生物(上海)股份有限公司;兔源β-肌动蛋白(β-actin)、Bax、Bcl-2、胱 天 蛋 白酶 9(caspase-9)、剪切 的 caspase-3(cleaved caspase-3)、微管相关蛋白1轻链3(microtubuleassociated protein 1 light chain 3,LC3)、beclin-1、p62、Akt、PI3K、mTOR单克隆抗体和辣根过氧化物酶标记山羊抗兔 IgG二抗(批号分别为 F200040、#83m8093、#83m4297、#84g5912、#85t5319、#84g5724、#83m8311、#83m5104、#84g5897、#84g5905、#84g5931、#83m8112)均购自美国Affinity Biosciences公司;其余试剂均为分析纯,水为蒸馏水。
1.3 细胞
人肝癌HepG2、SMMC-7721、Huh-7细胞株均购自上海富衡生物科技有限公司,由黑龙江中医药大学中药药剂细胞实验室进行传代保种。
2 方法
2.1 SPS提取纯化
取红花药材适量,按本课题组前期所得最优条件[料液比1∶16.7(mg/mL)、提取温度 91.4 ℃、提取时间89.8 min]进行提取,得粗制SPS;粗制SPS经冷冻离心后,取上清液按Sevage法除去游离蛋白,反复脱脂后洗涤、干燥,即得淡黄色的精制SPS(每1 g精制SPS相当于红花生药261.8 g,以苯酚-硫酸法测得质量分数为95.82%)[7]。将所得精制SPS溶于DMEM培养基中,配制成浓度为200 μmol/L的SPS溶液[8],涡旋混匀,经0.45 μm滤膜滤过后冷存,备用。
2.2 细胞培养
将人肝癌HepG2、SMMC-7721、Huh-7细胞接种于含有10%胎牛血清和1%青-链霉素双抗的DMEM培养基中,置于37 ℃、5%CO2的培养箱中培养(培养条件下同)。
2.3 SPS对不同人肝癌细胞增殖影响的检测
采用MTT法进行检测。取对数生长期的HepG2、SMMC-7721、Huh-7细胞,经胰酶消化后,调整细胞悬液浓度至5×104个/mL。将上述悬液按每孔100 μL接种至96孔板中,培养至细胞贴壁后,分别加入含SPS的DMEM培养基(SPS浓度分别为200、100、50、25、12.5、6.25、0 μmol/L,按前期预实验结果设置),每浓度设置3个复孔,并另设空白对照组(不加细胞与药物,只加培养基)。分别于培养24、48、72 h时,加入5 mg/mL的MTT溶液20 μL,继续培养4 h;弃去上清液,每孔加入二甲基亚砜150 μL,避光振荡10 min。使用酶标仪于570 nm处测定吸光度(A)值,计算细胞增殖抑制率(inhibition rate,IR)及半数抑制浓度(IC50)。IR=(空白对照组平均A值-给药组平均A值)/空白对照组平均A值×100%。实验重复3次。根据细胞增殖抑制结果,确定受试细胞、最适细胞浓度和最佳干预时间进行后续实验。
2.4 SPS对SMMC-7721细胞凋亡影响的观察
采用Hoechst 33258染色法进行检测。根据“2.3”项下结果,取对数生长期的SMMC-7721细胞,按每孔5×105个/mL接种于12孔板中,每孔2 mL,培养24 h待细胞贴壁后,吸去培养液。将细胞分为对照组和SPS低、中、高浓度(20、40、80 μmol/L)组,每组设置3个复孔。对照组加入培养基,各药物组加入含相应浓度SPS的培养基,培养48 h。取各组细胞,以4%多聚甲醛溶液固定约20 min后,用PBS清洗,每孔加入Hoechst 33258染色液100 μL,在室温条件下避光染色10~15 min,用PBS清洗,于荧光显微镜下观察并拍照(活细胞的细胞核呈弥散均匀的淡蓝色荧光,凋亡细胞核则可见致密浓染的颗粒块状亮蓝色荧光)。
2.5 SPS对SMMC-7721细胞迁移能力影响的检测
采用划痕实验进行检测。取对数生长期的SMMC-7721细胞,按每孔1.2×106个/mL接种于6孔板中,每孔2 mL,培养24 h待细胞贴壁后,吸去培养液,用200 μL移液枪枪头在每孔底部中央作一划痕,用PBS清洗。按“2.4”项下方法分组、给药。分别于培养0、24、48 h时用显微镜观察,采用Image J软件分析并计算各组细胞的迁移率:细胞迁移率=(T0时划痕面积-Tt时划痕面积)/T0时划痕面积×100%(式中,T0为0 h,Tt为24或48 h)。
2.6 SPS对SMMC-7721细胞克隆形成能力影响的检测
采用克隆实验进行检测。取对数生长期的SMMC-7721细胞,按每皿5×104个/mL接种于培养皿(直径35 mm)中,每皿3 mL,培养24 h待细胞贴壁后,吸去培养液,用PBS清洗。按“2.4”项下方法分组、给药。培养5 d后,弃去上清液,细胞用PBS清洗,每孔加入甲醇适量,于室温下固定15 min,再用PBS清洗,加入5%结晶紫溶液染色30 min,用水洗净,晾干,于显微镜下观察拍照并计算细胞克隆形成率:细胞克隆形成率=(细胞克隆数/接种细胞数)×100%。
2.7 SPS对SMMC-7721细胞形态影响的观察
采用HE染色法进行观察。取对数生长期的SMMC-7721细胞,按每孔2.5×105个/mL接种于24孔板中,每孔1 mL。培养24 h待细胞贴壁后,吸去培养液。按“2.4”项下方法分组、给药。培养48 h后,细胞用4%多聚甲醛溶液固定约20 min后,用PBS清洗,再用HE染色,于显微镜下观察并拍照(活细胞的细胞核呈蓝紫色,细胞质呈淡红色;凋亡细胞则表现为核染色质致密浓缩、核碎裂等)[9]。
2.8 SPS对SMMC-7721细胞自噬影响的观察
采用AO染色法进行观察。取对数生长期的SMMC-7721细胞,按每孔2.5×105个/mL接种于24孔板中,每孔1 mL。培养24 h待细胞贴壁后,吸去培养液。按“2.4”项下方法分组、给药。培养48 h后,吸去培养液,用PBS清洗后,用0.01% AO染液避光染色15 min;用PBS清洗后,于荧光显微镜下观察并拍照(正常细胞呈绿色荧光,发生自噬的细胞呈红色荧光)。
2.9 SPS对SMMC-7721细胞凋亡、自噬及PI3K/Akt/mTOR信号通路相关蛋白表达影响的检测
采用Western blot法进行检测。取对数生长期的SMMC-7721细胞,按每孔2.5×105个/mL接种于24孔板中,每孔1 mL。培养24 h待细胞贴壁后,吸去培养液。按“2.4”项下方法分组、给药。培养48 h后,细胞用胰酶消化并低温离心。所得细胞经裂解液裂解后,提取其总蛋白,采用BCA法进行蛋白定量。取变性后的蛋白样品40 μg进行SDS-PAGE分离,湿法转膜后封闭,加入β-actin、cleaved caspase-3、caspase-9、Bax、Bcl-2、p62、LC3、beclin-1、PI3K、mTOR、Akt一抗(β-actin的稀释比例为1∶5 000,其余均为1∶1 000),于4 ℃下孵育过夜;TBST溶液清洗3次后,加入二抗(稀释比例为1∶5 000),常温孵育2 h;TBST溶液清洗3次后,用ECL化学发光液显影。使用Image J软件对蛋白条带进行分析,以目标蛋白与内参蛋白(β-actin)的灰度值比值作为目标蛋白的相对表达量[其中,LC3蛋白的相对表达量以LC3Ⅱ与LC3Ⅰ比值(LC3Ⅱ/LC3Ⅰ)表示]。
2.10 统计学方法
采用SPSS 24.0软件和GraphPad Prism 8软件对数据进行统计分析。所有数据均以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 SPS对不同人肝细胞增殖的抑制作用
SPS干预24、48、72 h均可抑制人肝癌HepG2等3种细胞的增殖,并且抑制作用(以IR平均值表示)有随浓度上升而增强的趋势(图1)。干预48 h时,SPS对SMMC-7721细胞的IC50[(73.44±0.79)μmol/L]显著低于该成分对 HepG2、Huh-7 细胞的 IC50[(74.16±0.84)、(78.39±0.61)μmol/L](P<0.05)。基于此,后续研究以更为敏感的SMCC-7721细胞作为研究对象,药物干预时间设为48 h,药物低、中、高浓度分别为20、40、80 μmol/L。

图1 SPS对HepG2、SMMC-7721、Huh-7细胞增殖的抑制作用
3.2 SPS对SMMC-7721细胞凋亡的影响
与对照组比较,SPS各浓度组细胞的亮蓝色荧光均有增加,提示SMMC-7721细胞的凋亡有所增加,且这种作用有随剂量增加而增强的趋势。结果见图2。

图2 SPS对SMMC-7721细胞凋亡状态影响的显微图(×50)
3.3 SPS对SMMC-7721细胞迁移率的影响
与对照组比较,作用时间为24、48 h时,SPS各浓度组细胞的迁移率(SPS低剂量组作用24 h除外)均显著降低(P<0.05或P<0.01)。结果见图3、表1。

图3 SPS对SMMC-7721细胞迁移率影响的显微图(×50)
表1 SPS对SMMC-7721细胞迁移率的影响(±s,n=3)

表1 SPS对SMMC-7721细胞迁移率的影响(±s,n=3)
a:与对照组比较,P<0.01;b:与对照组比较,P<0.05
组别对照组SPS低浓度组SPS中浓度组SPS高浓度组48 h 47.16±0.61 34.38±0.79a 24.19±0.27a 16.82±0.23a 24 h 25.63±0.44 23.91±0.32 15.33±0.18b 13.27±0.27a
3.4 SPS对SMMC-7721细胞克隆形成率的影响
与对照组比较,SPS各浓度组细胞的克隆形成率均显著降低(P<0.01)。结果见图4。
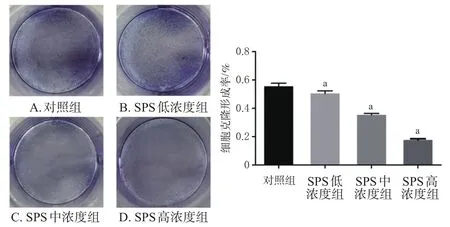
图4 SPS对SMMC-7721细胞克隆形成率的影响
3.5 SPS对SMMC-7721细胞形态的影响
与对照组比较,SPS各浓度组细胞数量明显减少;可见变圆变小、细胞核固缩的蓝黑色凋亡细胞,且凋亡细胞数量有随药物浓度增加而增加的趋势。结果见图5。
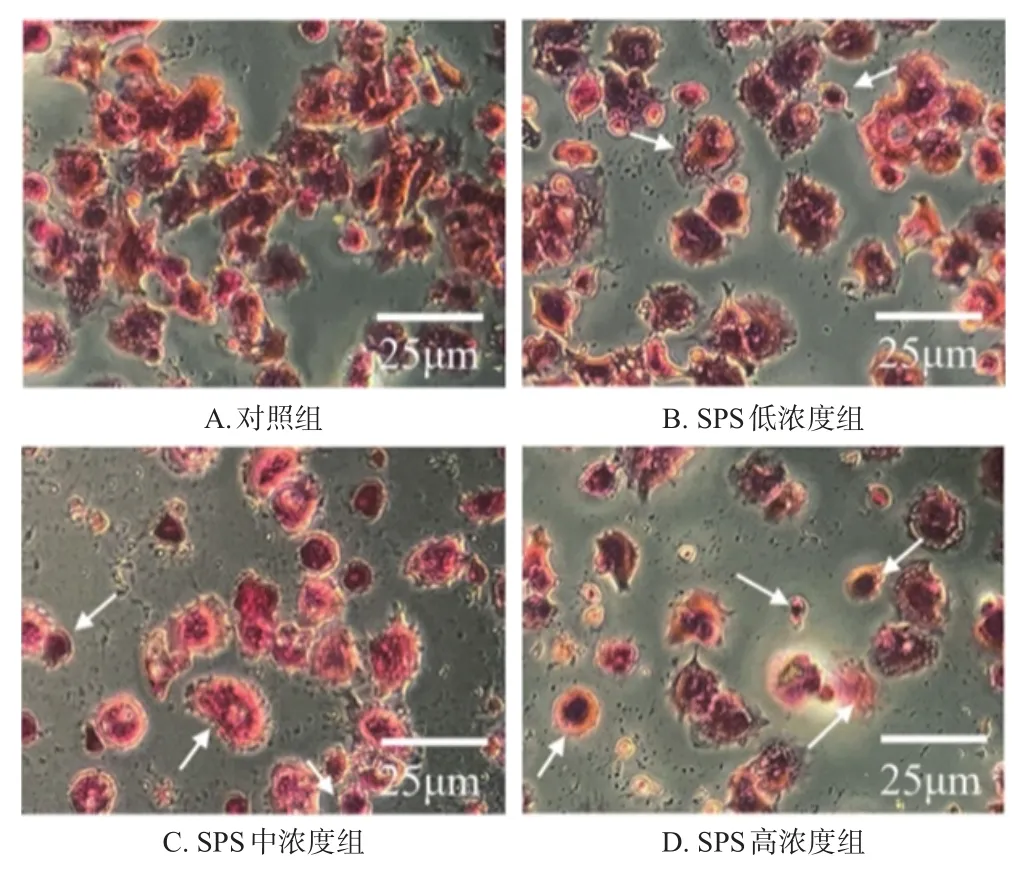
图5 SPS对SMMC-7721细胞状态影响的显微图
3.6 SPS对SMMC-7721细胞自噬的影响
与对照组比较,SPS各浓度组细胞内的红色荧光均有所增强,提示细胞内的自噬水平提升。结果见图6。

图6 SPS对SMMC-7721细胞自噬影响的显微图
3.7 SPS对SMMC-7721细胞凋亡、自噬及PI3K/Akt/mTOR信号通路相关蛋白表达的影响
与对照组比较,SPS各浓度组细胞中cleaved caspase-3、caspase-9、Bax、beclin-1蛋白的相对表达量和LC3Ⅱ/LC3Ⅰ均显著升高(P<0.05或P<0.01),Bcl-2、p62、PI3K、mTOR、Akt蛋白的相对表达量均显著降低(P<0.05或P<0.01),且大部分指标有一定的浓度依赖趋势。结果见图7。

图7 SPS对SMMC-7721细胞凋亡、自噬和PI3K/Akt/mTOR信号通路相关蛋白表达的影响
4 讨论
细胞凋亡是一种细胞程序性死亡过程,参与了多种疾病的发生发展[10]。本课题组前期以人肝细胞LO2、人张氏肝细胞以及小鼠肝实质细胞AML12为对象,初步探讨了SPS的细胞毒性。结果显示,当SPS浓度>200 μmol/L时,3种细胞的活力均低于90%,故本研究选择了较为安全的0~200 μmol/L为MTT实验的浓度范围,并最终筛选出了较敏感的受试细胞(SMMC-7721细胞)、干预浓度(20、40、80 μmol/L)和干预时间(48 h)。
本研究结果显示,随SPS浓度的增加,SMMC-7721细胞的增殖、迁移、克隆能力均有所减弱。Bcl-2蛋白家族中包含促凋亡蛋白(如Bax)和抑凋亡蛋白(如Bcl-2),caspase蛋白家族则是一组存在于细胞质中的结构相似的半胱氨酸蛋白酶,二者均与细胞凋亡密切相关[11—12]。当凋亡发生时,Bax、Bcl-2蛋白表达失衡,表达增加的Bax蛋白会破坏线粒体膜的完整性,进一步诱导caspase-9的活化,而caspase-3亚族则主要负责执行细胞凋亡过程[12]。Western blot实验结果显示,经不同浓度SPS干预后,细胞中cleaved caspase-3、caspase-9、Bax蛋白的相对表达量均显著升高,Bcl-2蛋白的相对表达量均显著降低,提示SPS具有促进SMMC-7721细胞凋亡的作用。
细胞凋亡与自噬是细胞程序性死亡的重要表现形式,在肿瘤的发生发展及治疗过程中具有重要作用,二者可通过独立或互补的关系促进细胞死亡[13]。本研究采用AO染色法观察细胞自噬情况,结果显示,经不同浓度SPS干预后,细胞自噬水平均有所提升。有研究指出,p62、LC3和beclin-1为自噬标志性蛋白。其中,新合成的LC3存在于细胞质内,以可溶性LC3Ⅰ形式存在;当细胞自噬发生时,LC3Ⅰ可转化为自噬特异性信号蛋白LC3Ⅱ,故可通过检测LC3Ⅱ/LC3Ⅰ来反映细胞自噬水平的高低[14]。p62作为运载蛋白可参与多种信号转导,可作为LC3与泛素化底物连接的介质,促进LC3与自噬小体中溶酶体的结合,其表达水平与自噬水平呈负相关[15]。beclin-1是自噬小体形成所必需的蛋白,其表达水平与自噬水平呈正相关[16]。Western blot实验结果表明,经不同浓度SPS干预后,细胞中p62蛋白的相对表达量均显著降低,beclin-1蛋白的相对表达量和LC3Ⅱ/LC3Ⅰ均显著升高,表明SPS可诱导细胞发生自噬效应,其作用效果随SPS浓度升高而加强。
研究证实,PI3K/Akt/mTOR信号通路是调节细胞自噬的主要信号通路[17]。研究表明,PI3K与生长因子受体的结合可改变下游Akt的结构,对凋亡相关蛋白的表达产生影响,从而调节细胞的凋亡与自噬;mTOR蛋白则可负反馈调节细胞自噬,对凋亡的作用具有正、负两重性[18]。此外,PI3K、Akt、mTOR的快速激活还可促进相关蛋白的合成,抑制自噬小体的形成[19]。Western blot实验结果显示,经不同浓度SPS干预后,细胞中与该通路相关蛋白的相对表达量均显著降低,提示SPS能诱导SMMC-7721细胞的凋亡及自噬,这可能与抑制PI3K/Akt/mTOR信号通路的表达有关。
综上所述,SPS有可能通过抑制PI3K/Akt/mTOR信号通路来诱导人肝癌SMMC-7721细胞发生凋亡和自噬,可作为治疗肝癌的候选天然活性成分。在后续研究中,本课题组拟进一步结合PI3K/Akt/mTOR信号通路抑制剂进行深入探讨,为肝癌治疗药物研发提供新的思路与方向。
