miR-153-5p靶向基质金属蛋白酶-16对胃癌细胞增殖、迁移及侵袭的影响
2022-12-28胡小敏王燕程旭敏罗寰
胡小敏,王燕,程旭敏,罗寰
河北北方学院附属第一医院胃肠肿瘤外科,河北 张家口 075000
胃癌是消化系统中最常见的恶性肿瘤之一,也是全球第三大最常见的癌症死亡原因[1]。胃癌也是一种在分子和表型上高度异质的疾病,目前认为手术是唯一的根治性治疗。随着外科手术技术的进步以及传统放化疗和新辅助疗法取得进展,早期胃癌的5年生存率已超过95%[2]。但早期诊断率低导致大多数患者在确诊时已患有晚期疾病,因此错过最佳手术窗口。因此,晚期胃癌的主要治疗方法是新辅助放化疗、分子靶向治疗和免疫治疗[3]。micro-RNA(miRNA)是一组小的非编码RNA,在抑制其靶mRNA 的翻译和稳定性中发挥作用。miRNA 参与多个细胞过程,如分化、转移、细胞周期、细胞凋亡和炎症反应[4-6]。已有研究表明,miR-153-5p参与肝癌、大肠癌等癌症的发生、发展和转移,但其对胃癌细胞增殖、侵袭和迁移的影响尚不清楚[4,7]。基质金属蛋白酶-16(matrix metalloproteinase-16,MMP-16)是一种膜型金属蛋白酶,与癌细胞的增殖、侵袭和迁移有关[8]。据报道,MMP-16 促进卵巢癌细胞的增殖、迁移和侵袭[9]。但MMP-16在胃癌中的作用少有报道。本研究主要探讨了miR-153-5p 与MMP-16 的相互作用,及其对胃癌细胞SGC-7901 增殖、侵袭和迁移的作用机制。
1 材料与方法
1.1 质粒及细胞 miR-NC、miR-153-5p mimic、miR-153-5p inhibitor、pc-NC、pc-MMP-16、PGL3-MMP-16-WT(MMP-16 野生型)、PGL3-MMP-16-MUT(MMP-16突变型)质粒由苏州金唯智生物科技有限公司设计并合成;PRL-CMV 质粒购自美国Promega 公司;正常胃细胞GES-1 和胃癌细胞系(MHCC97H、MKN-1、SGC-7901、MKN45 和MGC803)购自上海素冉生物科技有限公司,37 ℃,5%CO2条件下,于含10%胎牛血清、100 U/mL 青霉素和链霉素双抗溶液的RPMI1640培养基中培养。
1.2 样本 收集河北北方学院附属第一医院2016年1月— 2018年12月经病理确诊的胃癌患者手术切除的癌组织和癌旁组织60 对,其中男性33 对,女性27 对,年龄范围为30 ~78 岁,中位年龄为57 岁。患者手术前均未接受放化疗及其他辅助治疗。本研究经河北北方学院附属第一医院医学伦理学委员会批准,所有研究对象均签署知情同意书。
1.3 主要试剂及仪器 Lipofectamine 2000 转染试剂(货号:1111)购自上海笃玛生物科技有限公司;RPMI1640 培养基(货号:PM150110B)购自武汉普诺赛生命科技有限公司;青霉素和链霉素双抗溶液(货号:C0160-611)购自北京沃比森科技有限公司;胎牛血清(货号:QS071)购自北京百奥莱博科技有限公司;miRcute miRNA 第一链cDNA 合成试剂盒(货号:1708891)购自上海伯乐生命医学产品有限公司;miRcute miRNA 分离试剂盒(货号:DP501)购自天根生化科技(北京)有限公司;SYBR-Green PCR 试剂盒(货号:SR1100-50)购自上海索莱宝生物科技有限公司;Transwell 小室(货号:353097)购自北京明阳科华生物科技有限公司;BCA 试剂盒(货号:R23183-250T)购自上海源叶生物科技有限公司;兔抗增殖细胞核抗原(proliferating cell nuclear antigen,PCNA;货号:ab18197)、Ki67(货号:ab833)、MMP-16(货号:ab73877)、E-cadherin(货号:ab227639)、N-cadherin(货号:ab211126)、VEGF(货号:ab150375)、β-actin(货号:ab5694)单抗及HRP 标记的山羊抗兔IgG(货号:ab6728)购自英国Abcam 公司;FluorChem HD2凝胶成像系统购自美国Proteinsimple 公司;Seahorse XF-96 分析仪购自美国Seahorse 公司;CFX96 实时荧光定量PCR仪购自美国Bio-Rad公司。
1.4 胃癌组织和细胞中miR-153-5p表达水平的检测采用RT-qPCR 法。用miRcute miRNA 分离试剂盒提取研磨的组织(胃癌组织及癌旁组织)以及正常胃细胞GES-1、胃癌细胞系(GES-1、MHCC97H、MKN-1、SGC-7901、MKN45、MGC803)总RNA,经mi-Rcute miRNA 第一链cDNA 合成试剂盒将靶miRNA 逆转录为cDNA,以合成的cDNA 为模板,利用SYBR Green PCR 试剂盒进行RT-qPCR,CFX96 实时荧光定量PCR仪上测定miRNA表达水平。miR-153-5p上游引物序列:5′-ATCATTAAACCCGTAGATCCGAA-3′,下游引物序列:5′-AATGGTTGTTCTCCACACTCTCTC-3′;U6 上游引物序列:5′-CTCGCTTCGGCAGCACA-3′,下游引物序列:5′-AACGCTTCACGAATTTGCGT-3′。引物由苏州金唯智生物科技有限公司合成。反应条件为:95 ℃预变性5 min;95 ℃10 s,55 ℃10 s,72 ℃90 s,共35 个循环。用U6 标准化,2-ΔΔCt方法计算。
1.5 细胞分组及转染 将分组分为3 部分:①对照、miR-NC、miR-153-5p mimic、miR-153-5p inhibitor 组;②miR-NC、miR-153-5p mimic、pc-NC、pc-MMP-16组;③miR-153-5p mimic+pc-NC 和miR-153-5p mimic+pc-MMP-16 组。将对数期SGC-7901 细胞按1 × 106个/孔接种12 孔板,达到85%融合后,参考Lipofectamine 2000 说明书,按照①分组,对照组不进行转染,其他组分别将miR-NC、miR-153-5p mimic和miR-153-5p inhibitor 转染至SGC-7901 细胞;按照②分组,分别将miR-NC、miR-153-5p mimic、pc-NC、pc-MMP-16 转染至SGC-7901 细胞;按照③分组,分别将miR-153-5p mimic 与pc-NC 或pc-MMP-16 质粒共转染至SGC-7901细胞。
1.6 miR-153-5p 对胃癌细胞增殖能力影响的检测采用克隆形成试验。将各转染组细胞按1×106个/孔接种6孔板,37 ℃,5%CO2条件下培养至可见细胞群落;弃培养液,100%甲醇固定菌落;0.25%结晶紫染色30 min;清水洗涤,孔板倒置,叠加1张带网格的透明胶片,直接计数克隆数。
1.7 miR-153-5p 对胃癌细胞迁移能力影响的检测采用划痕试验。将转染后的SGC-7901 细胞按1 ×106个/孔接种至12 孔板,铺满单层后,用小号枪头在孔中间垂直划痕,PBS 洗涤2 次,37 ℃,5% CO2恒温培养箱培养24 h。于划痕0 和24 h 拍图,采用Image J 评估细胞迁移能力,并按下式计算划痕闭合率。
划痕闭合率(%)=(0 h 时的划痕面积- 24 h 时的划痕面积)/0 h时的划痕面积×100%
1.8 miR-153-5p 对胃癌细胞侵袭能力影响的检测采用Transwell试验。在基底胶包埋的Transwell小室上室接种转染后的SGC-7901 细胞悬浮液和不含血清培养基,并在Transwell 小室下室加入含10%血清培养基,37 ℃,5%CO2条件下培养24 h;取出Transwell小室,侵袭细胞用4%多聚甲醛固定,0.5%结晶紫染色30 min,显微镜下观察分析。
1.9 miR-153-5p与MMP-16靶向关系检测 采用双荧光素酶报告试验。收集对数期SGC-7901 细胞,按1 × 106个/孔接种24 孔板,37 ℃,5% CO2条件下培养24 h;在共转染系统中,加入pRL-CMV 报告质粒、miR-NC 或miR-153-5p mimic 与PGL3-MMP-16-WT或PGL3-MMP-16-MUT 质粒,转染至SGC-7901 细胞48 h 后,裂解15 min,双荧光素酶检测系统检测荧光素酶相对活性。
1.10 PCNA、Ki67、MMP-16、E-cadherin、N-cadherin和VEGF 蛋白表达水平的检测 采用Western blot法。收集转染后的SGC-7901 细胞,用RIPA 裂解液提取总蛋白,BCA 试剂盒定量蛋白浓度。将蛋白样品经10% SDS-PAGE 分离后,半干转膜仪转移至聚偏二氟乙烯膜,5%脱脂牛奶室温封闭2 h;加入对应的兔源单抗[PCNA(1∶1 000 稀释)、Ki67(1∶1 000稀释)、MMP-16(1∶800 稀释)、E-cadherin(1∶1 000稀释)、N-cadherin(1∶1 000 稀释)、VEGF(1∶1 000稀释)、β-actin(1∶1 000 稀释)],4 ℃封闭过夜;加入HRP标记的山羊抗兔IgG(1∶2 000稀释),室温封闭1 h;滴电化学反应液曝光。以GAPDH 为内参,用软件ImagePro plus 6.0分析蛋白条带灰度(蛋白相对表达水平= 目标蛋白积分吸光度值/内参蛋白βactin积分吸光度值)。
1.11 统计学分析 采用SPSS 19.0 软件进行统计学分析,所有实验数据以均数± 标准差(x±s)表示。用shapiro-wilk检验分析数据是否符合呈正态分布,多组比较采用单因素方差分析,两两比较采用SNK检验,校验标准α=0.05(双侧)。以P<0.05为差异有统计学意义。
2 结果
2.1 miR-153-5p 在胃癌中的表达与临床病理特征相关性 在胃癌中,miR-153-5p 的表达与性别、年龄和吸烟史无关(P>0.05),而与肿瘤大小、肿瘤-淋巴结-远处转移(tumour-node-metastasis,TNM)分期、淋巴结转移及分化成度有关(P<0.05)。见表1。

表1 胃癌患者miR-153-5p 表达水平与临床病理特征的相关性Tab.1 Correlation between expression level of miR-153-5p and clinicopathological features in patients with gastric cancer
2.2 胃癌组织和细胞中miR-153-5p的表达水平 与癌旁组织(1.00 ± 0.07)相比,胃癌组织中miR-153-5p 表达水平(0.46±0.05)显著下调(t=10.873,P<0.01);与GES-1 细胞相比,胃癌细胞系MHCC97H、MKN-1、SGC-7901、MKN45 和MGC803 中miR-153-5p表达水平显著下调(t分别为16.771、14.452、18.394、12.737、10.645,P均<0.01)。见图1。选择SGC-7901细胞进行后续试验。与对照组相比,miR-NC 组中miR-153-5p 表达水平无明显变化(t= 0.213,P=0.842),miR-153-5p mimic 组表达水平显著上调(t=36.269,P<0.01),miR-153-5p inhibitor 组表达水平显著下调(t=7.393,P<0.01),见图2。表明质粒转染成功。
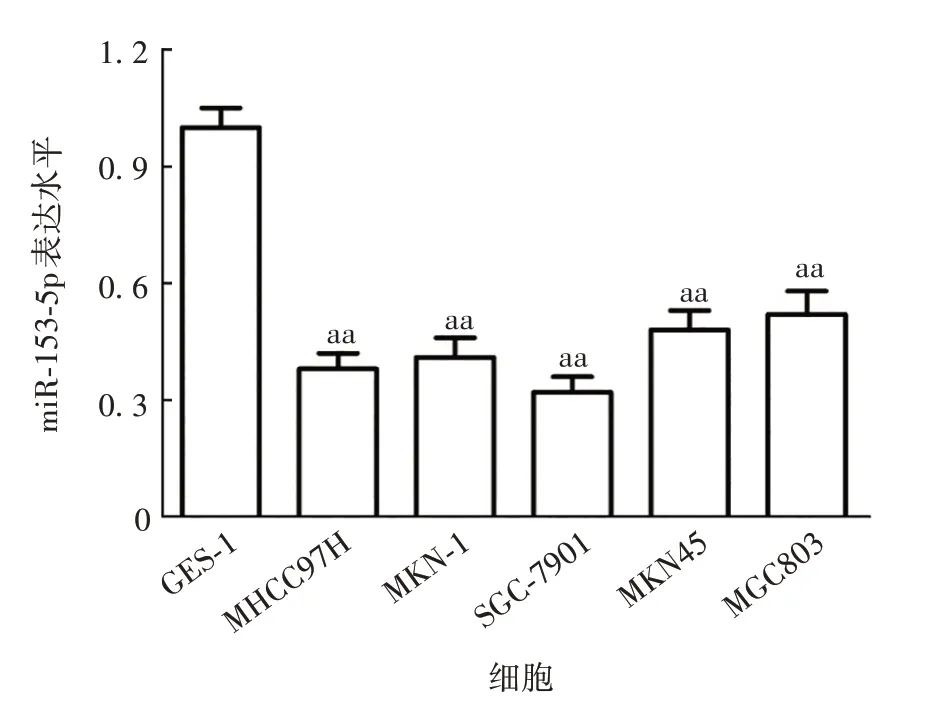
图1 RT-qPCR 法检测miR-153-5p 在不同细胞系中的表达水平Fig.1 Determination of expression levels of miR-153-5p in various cell lines by RT-qPCR

图2 RT-qPCR 法检测各转染组细胞中miR-153-5p 表达水平Fig.2 Determination of expression levels of miR-153-5p in cells of various transfection groups by RT-qPCR
2.3 miR-153-5p对胃癌细胞增殖的影响 与对照组相比,miR-NC 组细胞克隆形成率无明显变化(t=0.067,P= 0.950),miR-153-5p mimic 组显著降低(t= 7.744,P= 0.002),miR-153-5p inhibitor 组显著升高(t= 3.027,P =0.039),见图3 和图4。与对照组相比,miR-NC 组细胞中Ki67、PCNA 蛋白表达水平无明显变化(t分别为2.148、1.438,P分别为0.095、0.224),miR-153-5p mimic 组显著降低(t分别为24.865、43.280,P均<0.01),miR-153-5p inhibitor组显著升高(t分别为14.113、14.664,P均<0.01),见图5 和图6。表明miR-153-5p 可抑制胃癌细胞SGC-7901的增殖。
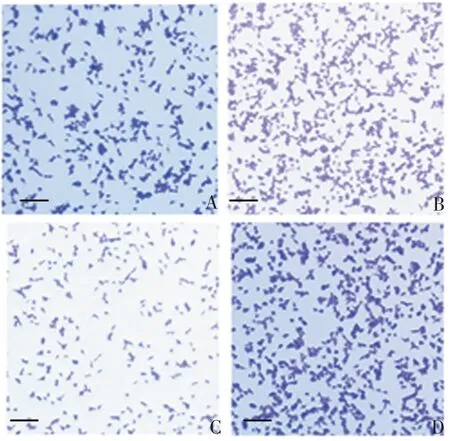
图3 克隆形成试验检测miR-153-5p 对胃癌细胞增殖能力的影响(结晶紫染色,×200)Fig.3 Evaluation of effect of miR-153-5p on proliferation of gastric cancer cells by clone formation test(crystal violet staining,×200)

图4 各组细胞的克隆形成率Fig.4 Cell clone formation rates in various groups
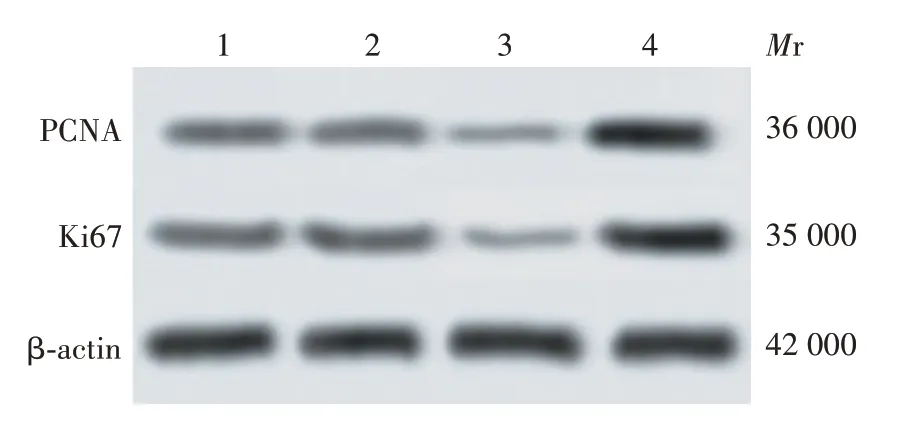
图5 Western blot 法检测各组细胞中PCNA、Ki67 蛋白的表达水平Fig.5 Western blotting of expression levels of PCNA and Ki67 proteins in cells of various groups

图6 各组细胞中PCNA、Ki67蛋白的表达水平Fig.6 Expression levels of PCNA and Ki67 proteins in cells of various groups
2.4 miR-153-5p 对胃癌细胞侵袭及迁移能力的影响 与对照组相比,miR-NC 组SGC-7901细胞侵袭数和划痕闭合率无明显变化(侵袭:t=0.059,P=0.956;迁移:t= 0.099,P= 0.926);miR-153-5p mimic 组SGC-7901细胞侵袭数显著减少(t=6.423,P=0.003),划痕闭合率显著降低(t= 4.199,P= 0.014);miR-153-5p inhibitor 组SGC-7901 细胞侵袭数显著增加(t=5.642,P=0.005),划痕闭合率显著升高(t=4.511,P= 0.011)。见图7 ~10。表明miR-153-5p 可抑制胃癌细胞侵袭和迁移。
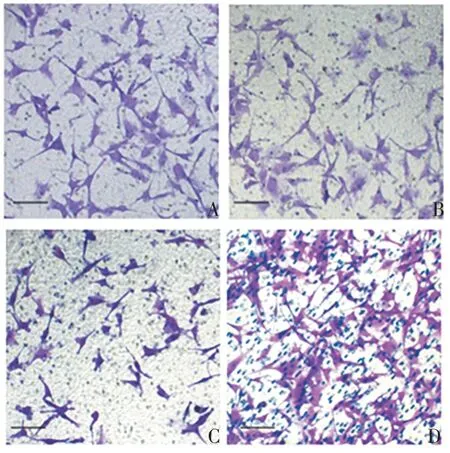
图7 Transwell 试验检测miR-153-5p 对胃癌细胞侵袭能力的影响(结晶紫染色,×200)Fig.7 Transwell assay of effect of miR-153-5p on invasion ability of gastric cancer cells(crystal violet staining,×200)
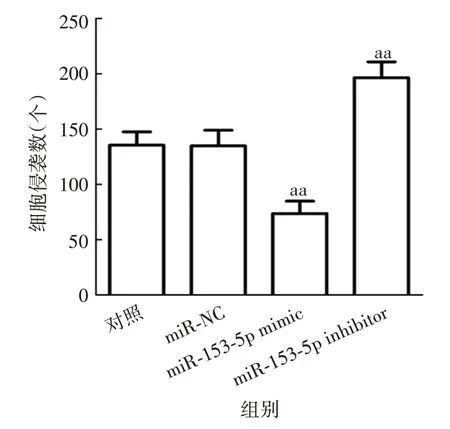
图8 各组细胞侵袭数Fig.8 Account of invasive cells in various groups

图9 划痕闭合试验检测miR-153-5p 对胃癌细胞迁移能力的影响(×200)Fig.9 Evaluation of effect of miR-153-5p on migration ability of gastric cancer cells by scratch test(×200)
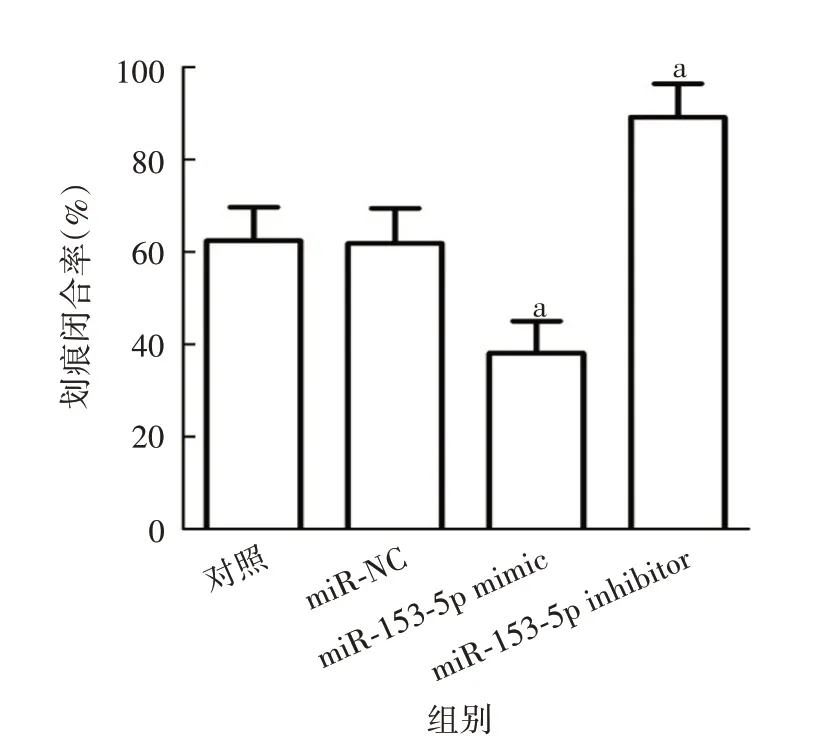
图10 各组细胞划痕闭合率Fig.10 Scratch closure rates of cells in various groups
2.5 miR-153-5p与MMP-16的靶向关系 Targetscan在线网站预测结果显示,miR-153-5p 与MMP-16 3′UTR区存在结合位点,见图11。双荧光素酶报告试验结果显示,miR-153-5p 与PGL3-MMP-16-WT 共转染显著降低了荧光素酶活性(t=11.532,P<0.01),见图12。与miR-NC组相比,miR-153-5p mimic组MMP-16蛋白表达水平显著下调(t=8.314,P=0.001),表明miR-153-5p 靶向下调MMP-16;与pc-NC 组相比,pc-MMP-16 组MMP-16 蛋白表达水平显著上调(t=10.694,P<0.01),表明上述载体转染成功。见图13和图14。

图11 Targetscan软件预测结果Fig.11 Predicted results by Targetscan software
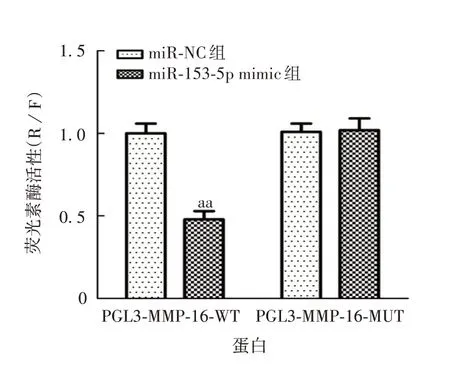
图12 双荧光素酶报告试验验证miR-153-5p 与MMP-16的靶向关系Fig.12 Verification for targeting relationship between miR-153-5p and MMP-16 by dual luciferase reporter assay
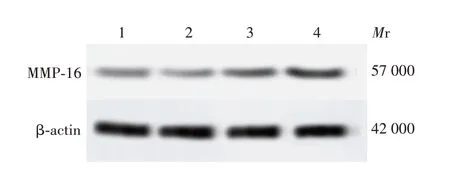
图13 Western blot 检测各组细胞MMP-16 蛋白表达水平Fig.13 Western blotting of expression levels of MMP-16 protein in cells of various groups
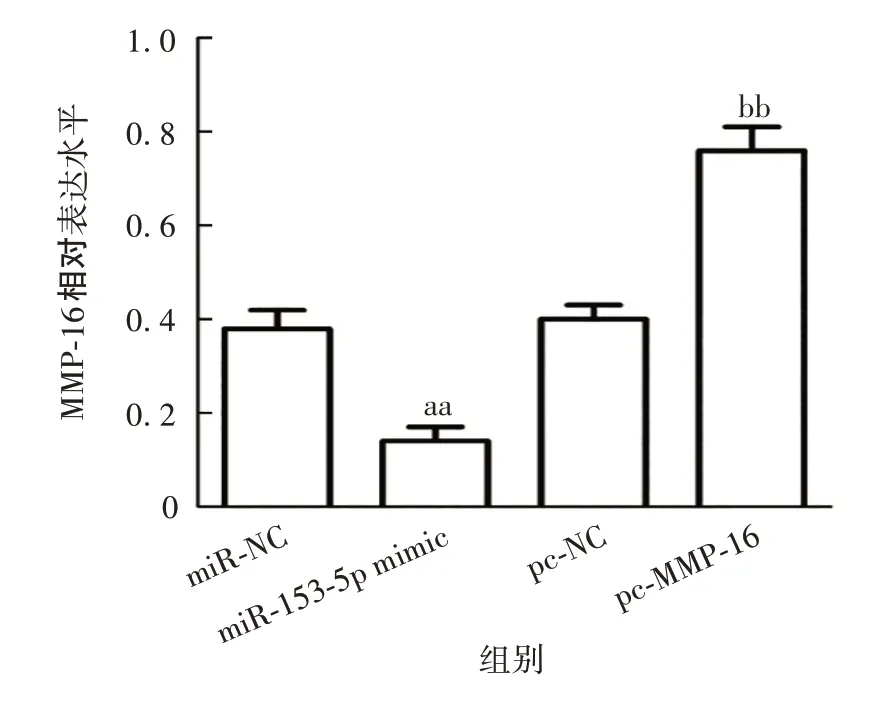
图14 各组细胞MMP-16 蛋白表达水平的Western blot分析Fig.14 Western blotting of expression levels of MMP-16 protein in cells of various groups
2.6 miR-153-5p靶向MMP-16对胃癌细胞增殖、侵袭和迁移作用的影响 与miR-153-5p mimic+pc-NC 组相比,miR-153-5p mimic+pc-MMP-16组SGC-7901细胞中MMP-16蛋白表达水平显著升高[(0.17±0.03)vs(0.61±0.05);t=13.802,P<0.01],见图15;细胞克隆形成率显著升高[(32.24 ± 5.28)vs(64.37 ±4.85);t= 7.762,P<0.01],见图16;细胞侵袭数显著增加[(73.21±10.52)vs(154.35±9.85);t=9.752,P<0.01)];划痕闭合率显著升高[(42.78±4.51)vs(65.34±6.21);t=5.091,P<0.01]。与miR-153-5p mimic+pc-NC 组相比,miR-153-5p mimic+pc-MMP-16 组SGC-7901 细胞中E-cadherin 蛋白表达水平显著降低,N-cadherin 和VEGF 蛋白表达水平显著升高(t分别为16.865、6.148、9.791,P均<0.01)见图17和图18。表明miR-153-5p 通过靶向MMP-16 对胃癌细胞增殖、侵袭和迁移起抑制作用。

图15 各组细胞MMP-16蛋白的表达水平Fig.15 Expression levels of MMP-16 protein in cells of various groups

图16 克隆形成试验结果(结晶紫染色,×200)Fig.16 Results of clone formation test(crystal violet staining,×200)
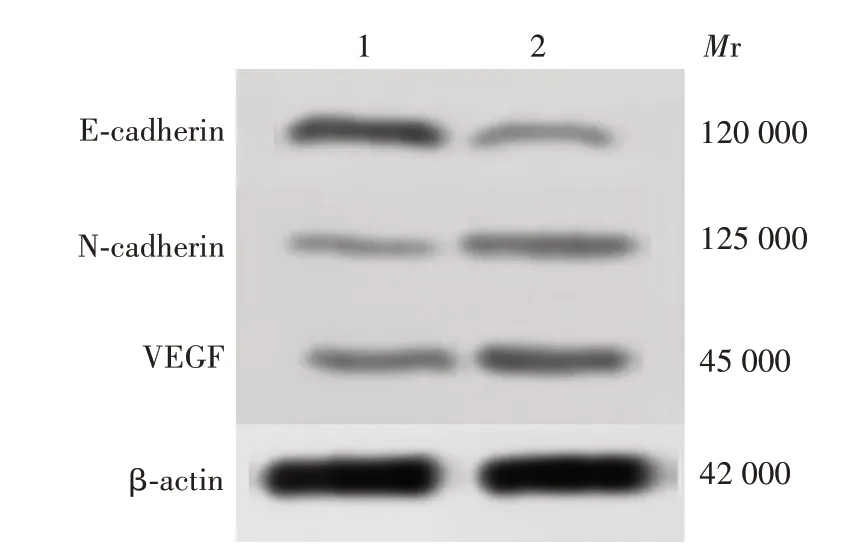
图17 Western blot 法检测各组细胞中E-cadherin、Ncadherin和VEGF蛋白的表达水平Fig.17 Western blotting of expression levels of E-cadherin,N-cadherin and VEGF proteins in cells of various groups
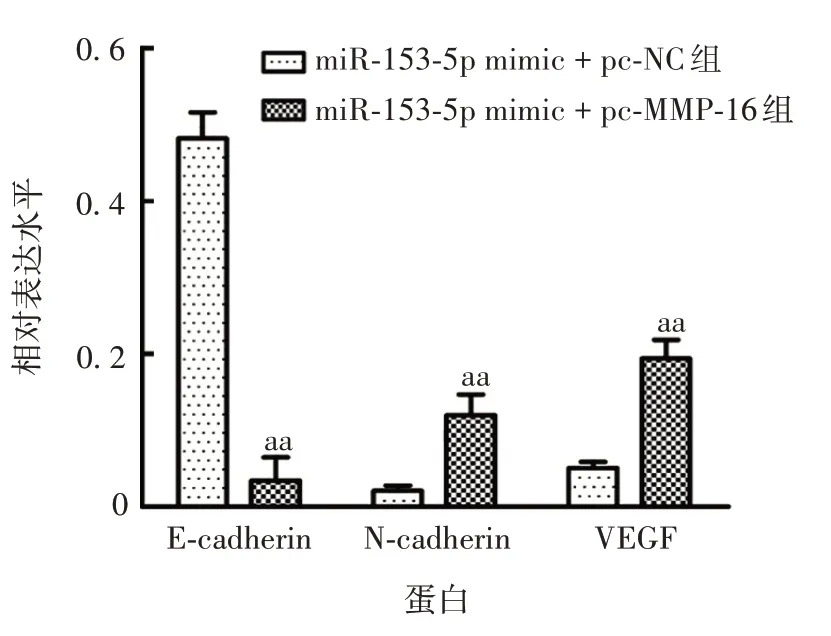
图18 各组细胞E-cadherin、N-cadherin 和VEGF 蛋白的表达水平Fig.18 Expression levels of E-cadherin,N-cadherin and VEGF proteins in cells of various groups
3 讨论
我国属于胃癌发病率较高国家,全球约半数胃癌新发病例出现在我国[10-11],多数患者在初次诊断时已进入进展期,转移性胃癌中位生存期仅8 ~10个月,对民众健康影响极大。近年来,因抗癌特异性等特点,分子靶向治疗受到医学界关注。转移性胃癌中,仅12%~15%为人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)阳性,可使用抗HER-2单克隆抗体曲妥珠单抗联合化疗。但大部分转移性胃癌目前无针对性的靶向治疗。因此,寻求新的治疗靶点,建立靶向分子治疗机制对降低胃癌发病率至关重要。
近年来,生物疗法已被广泛用于癌症治疗[12-13]。miRNA 在人类癌症诊断和治疗过程中具有重要意义,已被提议作为各类癌症的微创预后标志物。迄今为止,已鉴定出多种miRNA 类型参与了胃癌治疗。miR-532 通过靶向裸角质层同源蛋白1(naked cuticle homolog 1,NKD1)促进胃癌迁移和侵袭[14],miR-27b通过靶向核受体亚家族2组F成员2(nuclear receptor subfamily 2 group F member 2,NR2F2)抑制胃癌转移[15],miR-21 通过调控组蛋白1(histatin-1,HTN1)抑制胃癌细胞迁移和侵袭[16]。本研究结果显示,miR-153-5p 的表达与性别、年龄和吸烟史无关(P>0.05),而与肿瘤大小、TNM 分期、淋巴结转移和分化成度有关(P<0.05);miR-153-5p在胃癌组织和细胞中低表达,表明miR-153-5p 与胃癌的发展密切相关。研究还发现,miR-153-5p 过表达抑制胃癌细胞增殖、迁移和侵袭。为寻找其靶向分子,进一步分析了miR-153-5p 的靶向分子。Targetscan 软件预测结果显示,miR-153-5p与MMP-16在3′UTR区存在结合位点,即二者具有靶向关系。
MMP 是一种锌依赖性蛋白酶,对细胞外基质(extracellular matrix,ECM)上的多种底物具有特异的蛋白水解活性[17-18]。据报道,MMP 参与多种疾病的发展和病理过程,如肿瘤细胞侵袭及类风湿性关节炎的血管生成和骨吸收[19-21]。MMP-2 被认为是与细胞迁移和组织重塑相关的最重要的MMP 之一[22-23]。据报道,MMP-16过表达存在于最具侵袭性的结节性黑色素瘤亚型中,该亚型以真皮内的结节状结节生长,并早期转移至淋巴结中[24-25]。CHEN 等[26]报道,MMP-16表达的上调,显著促进了肿瘤细胞的侵袭和迁移能力,但miRNA-145的高表达可通过靶向MMP-16 抑制骨肉瘤转移。XUE 等[27]发现,MMP-16 参与胃癌的上皮间质转化和转移。同样,本研究发现,miR-153-5p 靶向下调MMP-16,MMP-16 高表达逆转miR-153-5p 过表达对胃癌细胞增殖、迁移和侵袭的抑制作用。
综上所述,本研究检测了我国胃癌人群中miR-153-5p的表达水平,并预测了miR-153-5p与MMP-16的靶向关系,揭示miR-153-5p可能通过下调MMP-16参与调节胃癌细胞的增殖、侵袭和迁移。表明miR-153-5p 和MMP-16 可能为胃癌的潜在治疗靶点。本研究仅为相关机制的初步探讨,更深入的分子通路机制尚有待进一步研究。
