丹参多酚酸盐对H2O2诱导心肌细胞凋亡与自噬的影响及机制研究*
2022-12-27李兵
李兵
邯郸市中心医院,河北 邯郸 056001
目前,心血管疾病居我国居民致死疾病谱首位,动脉粥样硬化所致缺血性心血管疾病、缺血性心肌病是其主要致死原因[1],氧化应激所致心肌细胞凋亡与自噬是该病进展的重要病理基础[2-3]。丹参多酚酸盐(salvianolate,SAL)是中药丹参的水溶提取物,具有抗氧化、抗炎等多种生物学活性[4-5],目前临床上主要用于治疗轻、中度稳定型心绞痛。本课题组既往研究发现SAL能够通过抑制氧化应激和炎症反应而对心肌缺血再灌注大鼠起到一定保护作用[6-7]。本实验以H9c2心肌细胞为研究对象,探讨SAL对过氧化氢(hydrogen peroxide,H2O2)诱导H9c2心肌细胞凋亡与自噬的影响及其可能的作用机制。
1 材料与方法
1.1 实验细胞H9c2心肌细胞(上海中国科学院细胞库,目录号:GNR5)。H9c2细胞接种在含10%胎牛血清、1%双抗的DMEM培养基,置37℃、5%CO2细胞培养箱中培养,每3天传代一次,取第三代对数生长期H9c2细胞进行实验研究。
1.2 药物及试剂DMEM培养基(美国Hyclone公司,批号:SH30019.02);SAL[上海绿谷制药有限公司,批号:1903027,规格:50 mg/瓶(含丹参乙酸镁40 mg)];胰酶、胎牛血清(美国Invitrogen公司,批号:S27053、A44382);青链霉素、二甲基亚砜(dimethyl sulfoxide,DMSO)(上海源叶生物科技有限公司,批号:D17A8F61375、B11A5C33718);CCK-8试剂盒、山羊抗兔IgG二抗(北京索莱宝科技有限公司,批号:CK04、SE134);兔抗鼠蛋白激酶B(protein kinase B,Akt)、磷酸化Akt(phosphorylation Akt,p-Akt)、半胱氨酸蛋白酶3(cysteinyl aspartate specific proteinase 3,Caspase-3)、B细胞淋巴瘤2(B cell lymphoma-2,Bcl-2)、Bcl-2相 关X蛋 白(Bcl-2 related X protein,Bax)、磷酸化哺乳动物雷帕霉素靶蛋白(phosphorylation mammalian target of rapamycin,p-mTOR)、Beclin1、微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3,LC3)、P62抗体(Abcam公司,批号:ab207316、ab207324、ab186210、ab185436、ab190527、ab203408、ab182714、ab2061118、ab194329);增强化学发光(enhanced chemiluminescence,ECL)试 剂 盒、Annexin V-FITC/PI凋亡试剂盒、RIPA蛋白裂解液、二喹啉甲酸(bisquinolinecarboxylic acid,BCA)试剂盒(上海碧云天生物科技有限公司,批号:P0018S、C1075S、P0013C、P0012)。
1.3 实验仪器HERACell 150i型细胞培养箱(德国Thermo公司);RT-6100型酶标仪(美国Rayto公司);ST16R型超速冷冻离心机(美国Beckman公司);MF52型倒置荧光显微镜(德国Leica公司);FACS Calibur流式细胞仪、PowerPac HV型电泳仪、Trans-Blot SD型 转 膜 仪(美 国Bio-Rad公司);C600型凝胶成像系统(美国Azure公司)。
1.4 实验方法
1.4.1 模型制备[8]取对数生长期H9c2心肌细胞,经胰酶消化和重悬后制备浓度5×105个/mL的单细胞悬液,200 μL/孔接种于6孔细胞培养板中培养24 h后,更换含有100 μmol/L H2O2的培养基继续培养4 h以制备H2O2诱导H9c2心肌细胞氧化损伤模型。
1.4.2 细胞分组设H2O2组和SAL50、100、200 mg/L组;另取对数生长期H9c2细胞设为正常组。
1.5 观察指标
1.5.1 H9c2心肌细胞增殖率各组细胞经胰酶消化和重悬后制备浓度5×104个/mL的单细胞悬液,100 μL/孔接种于96孔细胞培养板,每组设10个复孔;SAL50、100、200 mg/L组分别加入含50、100、200 mg/L的SAL培养液,H2O2组和正常组加常规培养液,继续培养24 h后,10 μL/孔加入CCK-8溶液,继续培养2 h后消化并收集细胞,然后通过酶标仪测定570 nm处吸光度(A)。
细胞增殖抑制率(%)=(A药物组/A正常组)×100%1.5.2 H9c2心肌细胞凋亡率各组细胞经胰酶消化和重悬后制备浓度5×105个/mL的单细胞悬液,以200 μL/孔接种于6孔细胞培养板,每组设10个复孔;SAL 0、100、200 mg/L组分别加入含50、100、200 mg/L的SAL培养液,H2O2组和正常组加常规培养液,继续培养24 h后消化,以离心半径8.4 cm,2000 r/min离心5 min收集细胞,按照试剂盒说明,滴加稀释后的结合缓冲液重悬细胞,滴加Annexin V-FITC和PI染液,37℃避光孵育15 min,通过流式细胞仪检测细胞凋亡。
1.5.3 H9c2心肌细胞自噬小体数量[8]按照“1.5.2”项方法,各组细胞给药干预并培养24 h后,更换含有GFP-LC3质粒和转染试剂的培养基(不含胎牛血清),继续培养4 h后,通过荧光显微镜下观察,细胞内亮绿色荧光点状聚集即为自噬小体。
1.5.4 H9c2心肌细胞蛋白表达量各组细胞经胰酶消化和重悬后制备浓度1×106个/mL的单细胞悬液,以1 mL/孔接种于直径60 mm培养皿,每组设10个皿,然后按照“1.5.2”项方法,各组细胞给药干预并培养24 h后,消化并收集细胞,滴加RIPA蛋白裂解液于冰上裂解30 min后,4℃,离心半径8.4 cm、12 000 r/min离心15 min,取上清液,BCA法测定蛋白浓度后、沸水浴5 min使蛋白完全变性,以30 μg蛋白量上样进行10%SDSPAGE胶电泳、转PVDF膜、以5%脱脂奶粉TBST溶液室温封闭2 h,分别滴加目标蛋白、β-actin兔抗鼠一抗后4℃孵育过夜,TBST洗膜3次后滴加山羊抗兔二抗37℃孵育1 h,TBST洗膜3次后滴加ECL化学发光液,暗盒中显影后采用凝胶成像系统分析条带灰度值,以β-actin为内参半定量分析目的蛋白相对表达量。
1.6 统计学方法采用SPSS 13.0进行数据统计分析。计量资料以±s表示,各组数据采用单因素方差分析,组间两两比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 H9c2心肌细胞增殖率与正常组比较,H2O2组H9c2细胞增殖率显著降低(P<0.01);与H2O2组比较,SAL100、200 mg/L组增殖率显著升高(P<0.01)。见图1。
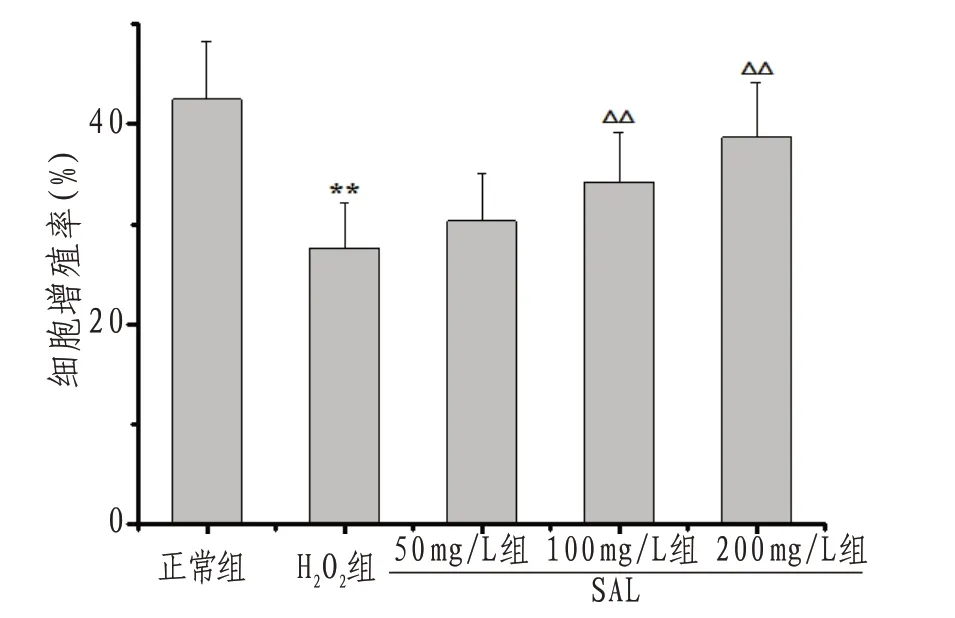
图1 各组H9c2心肌细胞增殖率
2.2 H9c2心肌细胞凋亡率与正常组比较,H2O2组H9c2细胞凋亡数量明显增多,凋亡率显著升高(P<0.01);与H2O2组比较,SAL50、100、200 mg/L组凋亡细胞数量明显减少,凋亡率显著降低(P<0.05或P<0.01)。见图2—3。
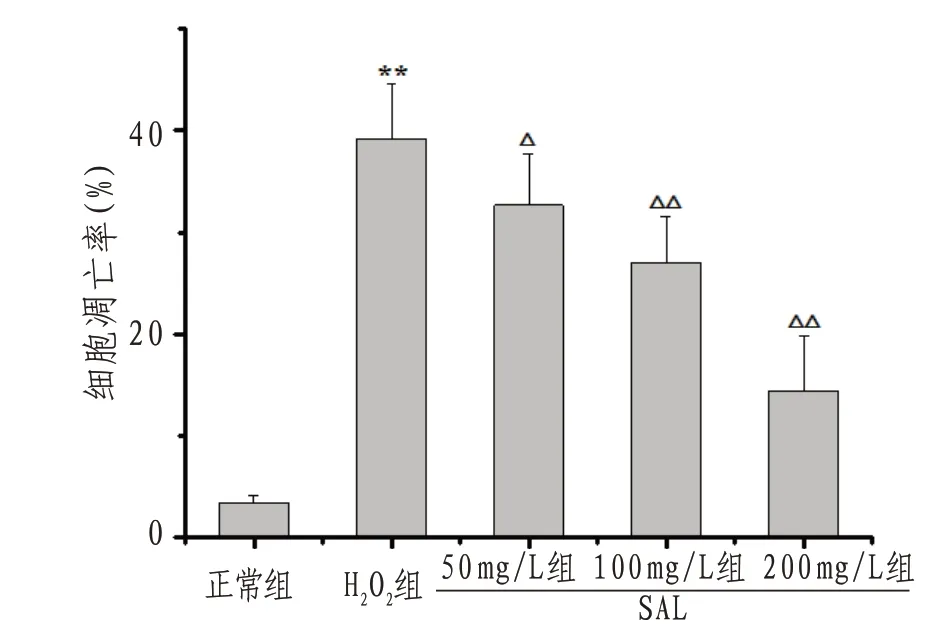
图2 各组H9c2心肌细胞凋亡率
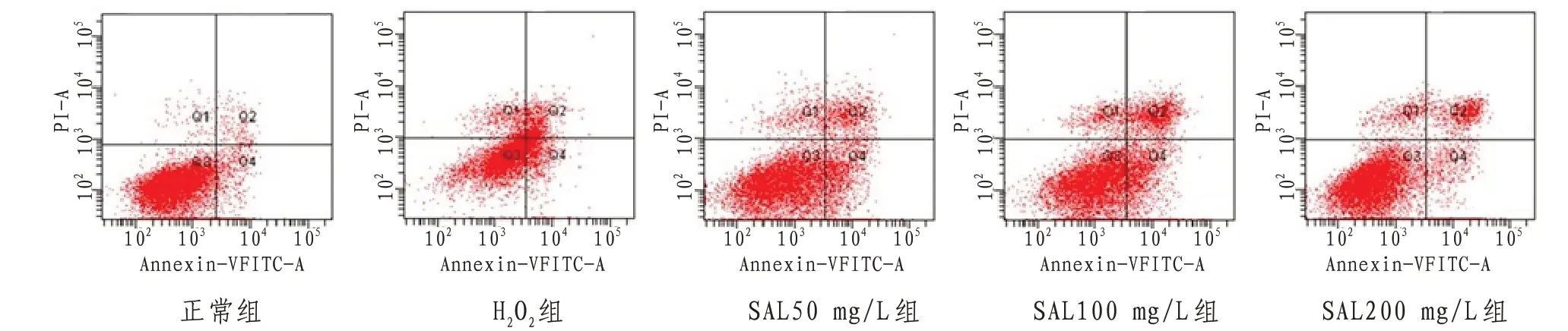
图3 各组H9c2心肌细胞凋亡水平
2.3 H9c2心肌细胞自噬小体数量结果与正常组比较,H2O2组H9c2细胞内自噬小体(亮绿色荧光点状聚集)数量明显增多;与H2O2组比较,SAL50、100、200 mg/L组自噬小体数量不同程度减少,其中SAL200 mg/L组少于其他组。见图4。
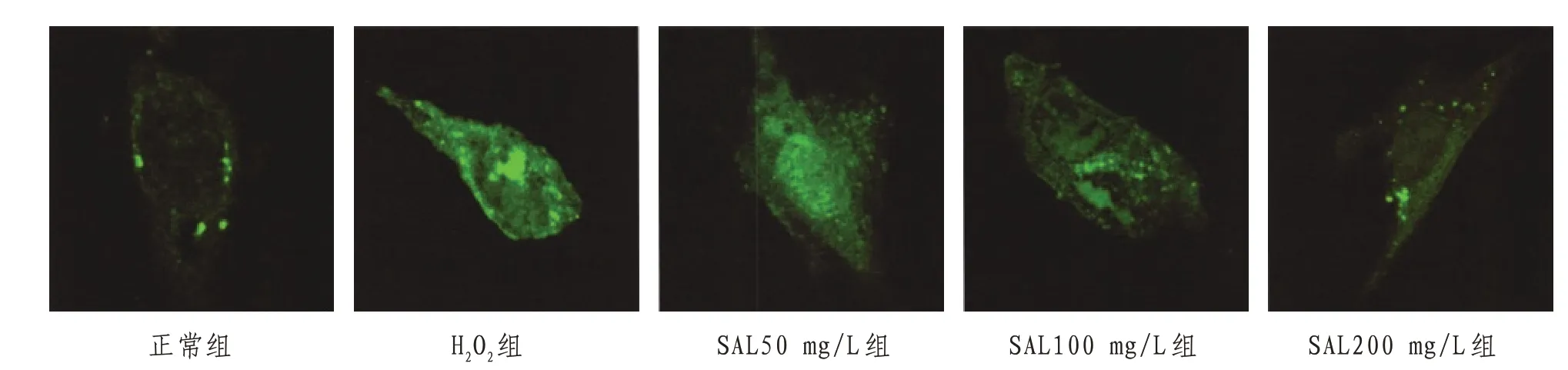
图4 荧光显微下各组H9c2心肌细胞自噬小体(×400)
2.4 H9c2心肌细胞Akt、p-Akt、p-mTOR蛋白表达及p-Akt/Akt表达量与正常组比较,H2O2组H9c2细胞p-Akt、p-mTOR表达明显下调而p-Akt显著降低(P<0.01),两组间Akt表达差异无统计学意义(P>0.05);与H2O2组比较,SAL100、200 mg/L组H9c2细胞p-Akt、p-mTOR表达明显上调(P<0.05或P<0.01),p-Akt显著升高(P<0.01)。见图5—6。
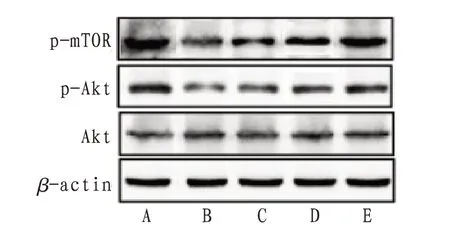
图5 各组H9c2心肌细胞Akt、p-Akt、p-mTOR蛋白表达电泳图
2.5 H9c2心肌细胞Caspase-3、Bcl-2、Bax、Beclin1、LC3、P62蛋白表达及bcl-2/Bax、LC3-Ⅱ/LC3-I比值与正常组比较,H2O2组H9c2细胞Caspase-3、Bax、Beclin1、LC3-I、LC3-II、P62蛋白表达明显上调而bcl-2表达下调(P<0.01),bcl-2/Bax比值降低而LC3-II/LC3-I比值升高(P<0.01);与H2O2组比较,SAL100、200 mg/L组H9c2细胞Caspase-3、Bax、Beclin1、LC3-I、LC3-II、P62蛋白表达明显下调且bcl-2表达上调(P<0.05或P<0.01),SAL50、100、200 mg/L组bcl-2/Bax比值升高而LC3-II/LC3-I比值降低(P<0.05或P<0.01)。见图7—9。
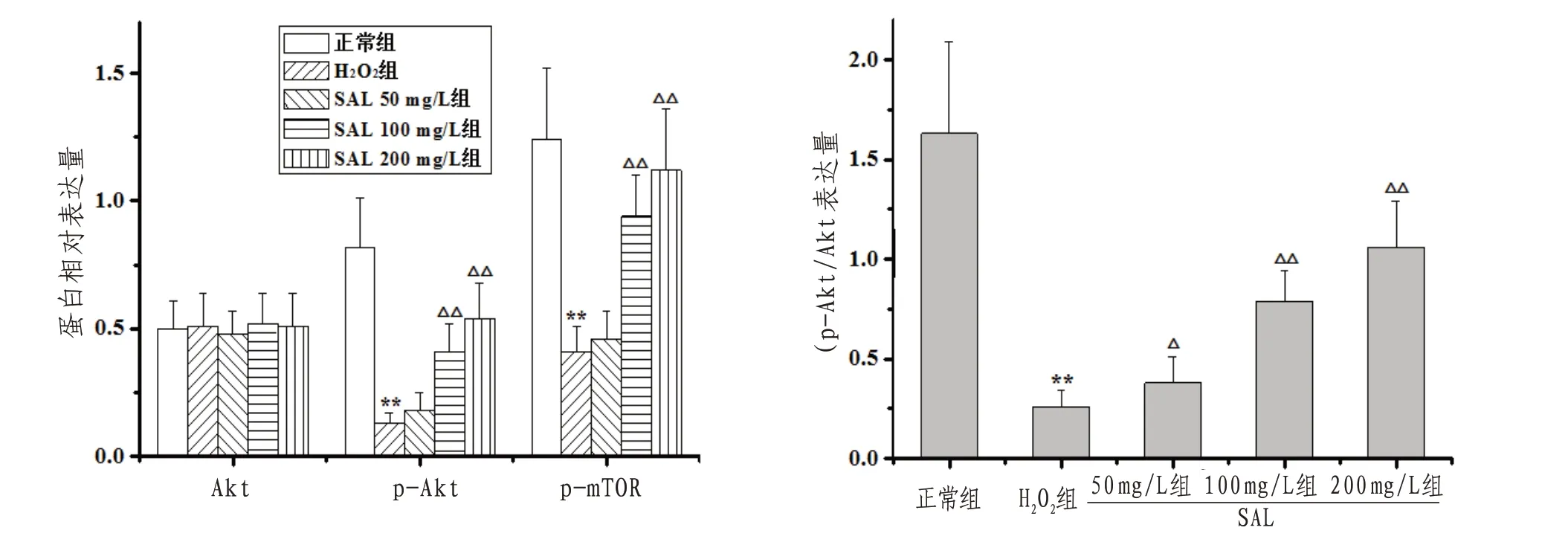
图6 各组H9c2心肌细胞Akt、p-Akt、p-mTOR蛋白相对表达量及p-Akt/Akt表达量
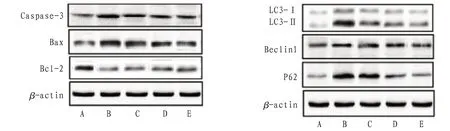
图7 各组H9c2心肌细胞Caspase-3、Bcl-2、Bax、Beclin1、LC3、P62蛋白表达电泳图
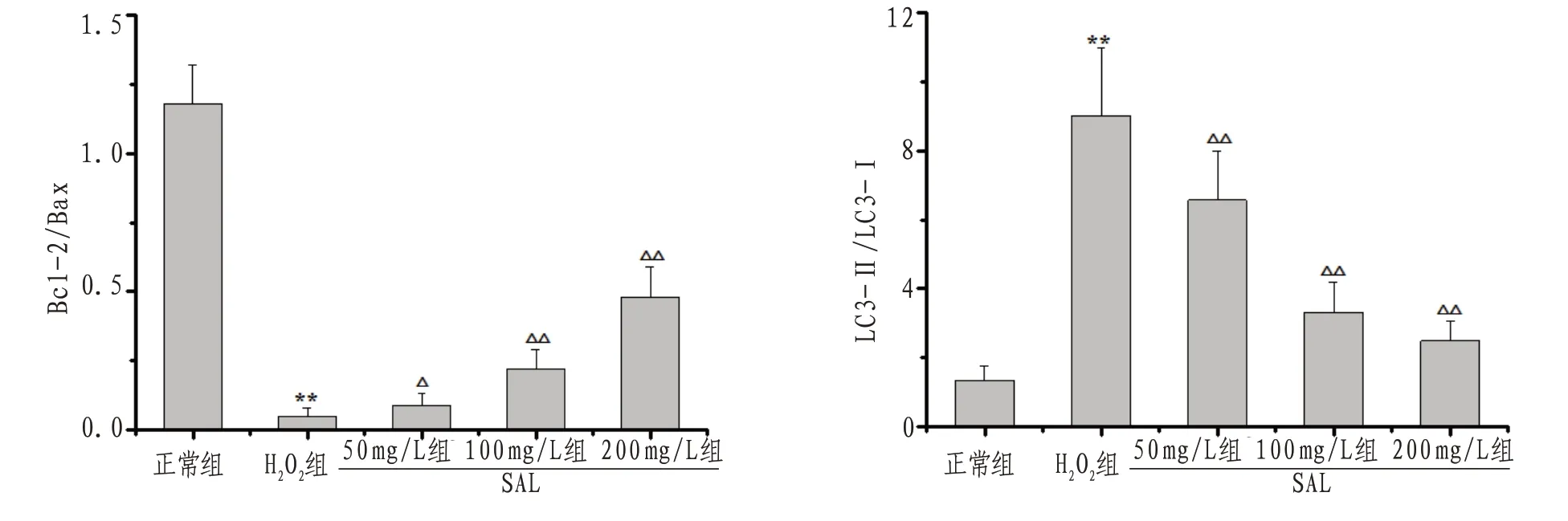
图8 各组H9c2心肌细胞Bcl-2/Bax、LC3-II/LC3-I比值
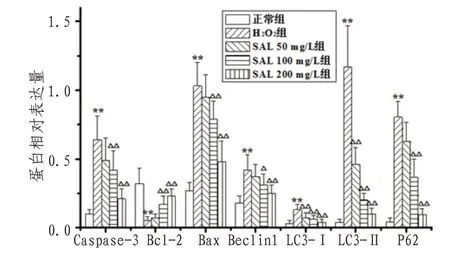
图9 各组H9c2心肌细胞Caspase-3、Bcl-2、Bax、Beclin1、LC3、P62蛋白相对表达量
3 讨论
活性氧自由基(reactive oxygen species,ROS)代谢失衡,诱导细胞凋亡、自噬,与各类心血管疾病进展密切相关[9-10],其中冠状动脉粥样硬化性心脏病、心肌梗死以及经治疗实现再灌注后将引发ROS大量产生而过剩[11-12]。因此,以细胞凋亡和自噬为治疗靶点,对改善心肌细胞氧化应激损伤具有重要意义。
H2O2是细胞生理代谢过程中非常重要的一个中间产物,参与基因转录与表达、细胞增殖等细胞生物过程,但过量的H2O2将会诱发胞内氧化应激反应,进而诱发细胞凋亡与自噬[13]。丹参以唇形科植物丹参的干燥根和根茎入药,味苦、性微寒,归心、肝经,具有活血祛瘀、通经止痛、凉血消痈之功效,临床用于胸痹心痛、脘腹胁痛、癥瘕积聚、痛经闭经等症的治疗。SAL为丹参的水溶提取物,具有良好的抗氧化活性[4,14],目前临床上主要用于轻、中度稳定型心绞痛的治疗。本实验采用H2O2干预制备H9c2心肌细胞氧化应激损伤模型,给予不同浓度SAL进行干预发现,经SAL干预能够明显提高H9c2细胞增殖率并降低凋亡率,减少细胞内自噬小体数量,提示SAL对H2O2所致H9c2细胞氧化应激损伤后凋亡和自噬具有抑制作用。
细胞凋亡和自噬是由基因调控的两种程序化自主死亡途径,参与多种生理、病理过程,对维持细 胞 稳 态 具 有 重 要 作 用[15]。Bcl-2家 族 和Caspase家族蛋白在细胞凋亡过程中发挥着重要调控作用。在氧化应激等病理性刺激下,Bax上调表达并转移到线粒体膜而导致其通透性改变,细胞色素C(cytochrome C,Cyt C)由线粒体释放进入细胞质,从而激活线粒体凋亡通路[16-17]。Cyt C将激活Caspase-3,活化Caspase-3蛋白被认为是细胞凋亡最重要启动因子和执行者,具有剪切细胞结构蛋白等作用[18];Bcl-2主要位于线粒体膜,对膜通透性具有保护作用,并且能够与Bax形成二聚体而抑制Bax活性,所以Bcl-2/Bax表达比值能够反映Bcl-2家族对细胞凋亡所起到的调控作用[19]。LC3蛋白具有LC3-I和LC3-Ⅱ两种亚型,定位于细胞内自噬体膜,其中LC3-Ⅱ能够与线粒体受体蛋白结合而诱导其降解,LC3-I则无具备自噬活性,但自噬发生后LC3-I将转化为LC3-Ⅱ,所以LC3-Ⅱ/LC3-I比值能够反映细胞自噬水平[20-21]。P62能够诱导靶蛋白泛素化而被自噬体包裹而被降解,能够通过PB1结构域与非泛素化蛋白聚集体结合而介导其自噬清除,并且P62能够与LC3蛋白而促进自噬小体的形成[22]。本研究发现,经SAL干预能够明显下调H9c2细胞Caspase-3、Bax、LC3-I、LC3-Ⅱ表达并上调Bcl-2表达,提高bcl-2/Bax比值并降低LC3-Ⅱ/LC3-I比值。
Akt是一种原癌基因,由胞浆移位到脂膜并被磷酸化而激活后,能够诱导Caspase蛋白磷酸化而失活,抑制Bax蛋白表达[23]。p-Akt能够诱导下游基因mTOR磷酸化而活化,p-mTOR能够清除泛素蛋白而抑制细胞自噬,能够诱导Beclin1蛋白磷酸化而失活,而Beclin1能够介导LC3等自噬蛋白转移到自噬体膜的关键因子,从而间接促进细胞自噬[24]。本研究发现,经SAL干预能够明显上调p-Akt、p-mTOR蛋白表达并提高Akt磷酸化,下调Beclin1表达,提示SAL对H2O2所致H9c2细胞氧化应激损伤后凋亡、自噬的抑制作用可能与激活Akt/mTOR/Beclin1通路有关。
综上所述,SAL对H2O2所致H9c2心肌细胞凋亡与自噬具有抑制作用,其机制可能与激活Akt/mTOR/Beclin1通路而抑制促凋亡、促自噬相关蛋白表达和活化有关。
