基于PI3K/Akt/mTOR通路探讨川芎嗪诱导人胃癌细胞凋亡和自噬作用的机制研究*
2022-12-27霍浩然秦瑞峰薛佳栋袁增江
霍浩然,秦瑞峰,薛佳栋,袁增江
邯郸市中心医院,河北 邯郸 056001
近年来,随着人们健康意识的提高及预防幽门螺杆菌根除等措施的实施,胃癌发病率和致死率呈下降趋势,但仍居恶性肿瘤致死率的第三位,仅次于肺癌和肝癌[1]。
川芎嗪(tetramethylpyrazine,TMP)是存在于川芎、温莪术等植物根茎中的一种活性生物碱,化学名2,3,5,6-四甲基吡嗪,具有较为广泛的抗肿瘤活性,已证实TMP对肺癌[2]、肝癌[3]、肾癌[4]等具有抑制作用,病理生理学研究发现TMP的抑癌作用可能与促进癌细胞凋亡与自噬有关。磷脂酰肌醇3-激 酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是调控细胞凋亡自噬的关键信号通路[5]。本实验旨在研究TMP对胃癌细胞凋亡和自噬的影响以及PI3K/Akt/mTOR通路所发挥的调控作用。
1 材料与方法
1.1 实验细胞人胃癌SGC-7901细胞株,购自中国科学院上海细胞生物学研究所(编号:SCSP-573)。
1.2 药物及试剂磷酸川芎嗪注射液(扬子江药业集团有限公司,批号:20191219);PI3K特异性抑制剂LY294002、二甲基亚砜(dimethyl sulfoxide,DMSO)、四甲基偶氮唑(tetramethylazoazole,MTT)(美 国Sigma公 司,批 号:L9908、302A035、C208A);DMEM培养基(美国Hyclone公司,批号:AE20005267);0.25%胰酶、胎牛血清(南京凯基生物科技发展有限公司,批号:20190416、20190504);Annexin V-FITC/PI试剂盒(上海碧云天生物技术公司,批号:C1063);兔抗鼠磷酸化PI3K(phosphorylated PI3K,p-PI3K)、磷 酸 化Akt(phosphorylated Akt,p-Akt)、磷酸化mTOR(phosphorylated mTOR,p-mTOR)、Cleaved Caspase-3、Cleaved Caspase-9、微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)、β-actin单克隆抗体和山羊抗兔IgG二抗(北京中杉金桥生物技术有限公司,批号190130、190425、190319、190508、181204、190426、190131、190511);DAB显色试剂盒(杭州四季青生物工程材料有限公司,批号:20190327)。
1.3 仪器HF240型细胞培养箱(上海力申科学仪器公司);FACSCalibur型流式细胞仪(美国Becton Dicknson公司);5427R型低温高速离心机(德国Eppendrof公司);BX53型荧光显微镜(日本Olympus公司);SE300型蛋白质电泳仪(美国Hoefer公司);DYCZ-40D型电泳槽(北京六一仪器厂);Power-pac 3000型转膜仪(美国Bio-Rad公司);VARIOSKANLUX型多功能酶标仪(美国Thermo Scientific公司)。
1.4 实验方法
1.4.1 细胞培养实验用SGC-7901细胞解冻复苏后接种于含10%胎牛血清和双抗的DMEM培养基,置5%二氧化碳、恒温37℃、饱和湿度的细胞培养箱中进行培养,细胞汇合度约80%时进行传代;取对数生长期细胞进行实验,设空白对照组(DMSO)、TMP(200、400、800 μg/mL)[6]和LY2940025 μg/mL[7]干预组。
1.4.2 细胞增殖抑制率检测取对数生长期SGC-7901细胞经0.25%胰酶消化后,调整细胞浓度为1×104个/mL,200 μL/孔接种于96孔板,继续培养24 h待细胞贴壁后更换培养基,分别以DMSO、TMP(200、400、800 μg/mL)或LY294002 5 μg/mL进行干预,每组设10个复孔,48 h后20 μL/孔加入浓度5 mg/mL的MTT溶液,继续培养4 h后弃培养液,150 μL/孔加入DMSO室温避光震荡至结晶完全溶解后,通过酶标仪测定490 nm处吸光度值(OD490nm)。
细胞增殖抑制率(%)=(1-实验组OD490nm/空白对照组OD490nm)×100%
1.4.3 细胞凋亡水平检测取对数生长期SGC-7901细胞经0.25%胰酶消化后,调整细胞浓度为1×104个/mL,200 μL/孔接种于培养皿(内置消毒玻片),培养48 h后更换培养基,分别以DMSO、TMP(200、400、800 μg/mL)或LY294002 5 μg/mL进行干预,每组设10个培养皿,继续培养48 h后0.25%胰酶消化、离心半径10 cm,1500 r/min离心5 min后弃上清,经PBS溶液洗涤3次后,严格按照Annexin V-FITC/PI试剂盒说明进行操作,通过流式细胞仪检测细胞凋亡水平并计算凋亡率。
1.4.4 细胞自噬水平检测取对数生长期SGC-7901细胞经0.25%胰酶消化后,调整细胞浓度为1×105个/mL,200 μL/孔接种于24孔板,继续培养24 h待细胞贴壁后更换培养基,分别以DMSO、TMP(200、400、800 μg/mL)或LY294002 5 μg/mL进行干预,每组设10个复孔,继续培养48 h后弃培养液并用PBS溶液洗涤3次,500 μL/孔滴加浓度为1 mg/L的吖啶橙溶液避光孵育15 min,PBS溶液洗涤3次后通过荧光显微镜观察并拍照。
1.4.5 细胞蛋白表达水平检测取对数生长期SGC-7901细胞经0.25%胰酶消化后,调整细胞浓度为1×104个/mL,200 μL/孔接种于培养皿(内置消毒玻片),培养48 h后更换培养基,分别以DMSO、TMP(200、400、800 μg/mL)或LY294002 5 μg/mL进行干预,每组设10个培养皿,继续培养48 h后0.25%胰酶消化、离心半径10 cm,1500 r/min离心5 min后弃上清取细胞,于冰上裂解细胞后4℃、离心半径10 cm,12 000 r/min离心15 min去上清,BCA法测定总蛋白浓度后行沸水浴变性,取40 μg总蛋白量上样、行SDS-PAGE凝胶电泳、湿转法将蛋白转移到PVDF膜、5%脱脂牛奶室温封闭1 h后,滴加p-PI3K、p-Akt、p-mTOR、Cleaved Caspase-3、Cleaved Caspase-9、LC3、β-actin一抗后4℃孵育过夜,PBS溶液洗涤3伺候滴加二抗室温孵育1 h,洗膜后滴加DAB显色剂;以β-actin为内参,通过条带灰度值半定量蛋白表达量。
1.5 统计学方法运用SPSS 13.0软件进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 TMP对人胃癌SGC-7901细胞增殖抑制率和细胞凋亡的影响与空白对照组比较,TMP(200、400、800 μg/mL)组和LY294002 5 μg/mL组细胞增殖抑制率和凋亡率明显升高(P<0.01);与LY294002 5 μg/mL组比较,TMP 800 μg/mL组细胞增殖抑制率和凋亡率明显升高(P<0.05)。见图1—3。
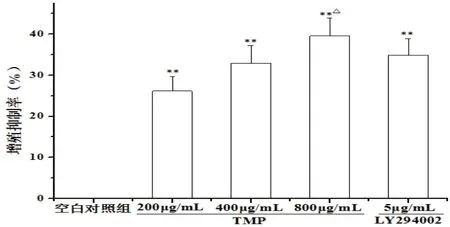
图1 TMP对人胃癌SGC-7901细胞增殖抑制率的影响
2.2 TMP对人胃癌SGC-7901细胞自噬的影响红色荧光为阳性着色,表示自噬溶酶体。与空白对照组比较,TMP 200、400、800 μg/mL组和LY2940025 μg/mL组红色荧光呈不同程度增多,并且TMP作用呈现一定剂量依赖性,提示SGC-7901细胞经TMP或LY294002干预后自噬溶酶体明显增多,即TMP具有诱导SGC-7901细胞自噬的作用。见图4。
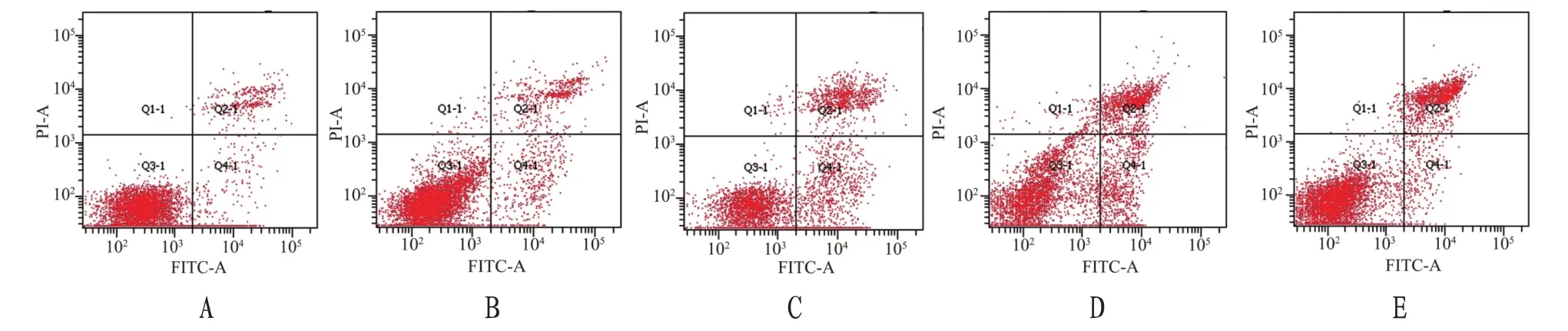
图2 TMP对人胃癌SGC-7901细胞凋亡的影响

图3 TMP对人胃癌SGC-7901细胞凋亡率的影响

图4 荧光显微镜下TMP对人胃癌SGC-7901细胞自噬的影响
2.3 TMP对人胃癌SGC-7901细胞p-PI3K、p-Akt、pmTOR蛋白表达的影响与空白对照组比较,TMP 400、800 μg/mL组和LY294002 5 μg/mL组p-PI3K、p-Akt、p-mTOR相 对 表 达 量 明 显 降 低(P<0.05);与LY294002 5 μg/mL组比较,TMP 800 μg/mL组p-PI3K、p-Akt、p-mTOR相对表达量降低(P<0.05)。见图5。
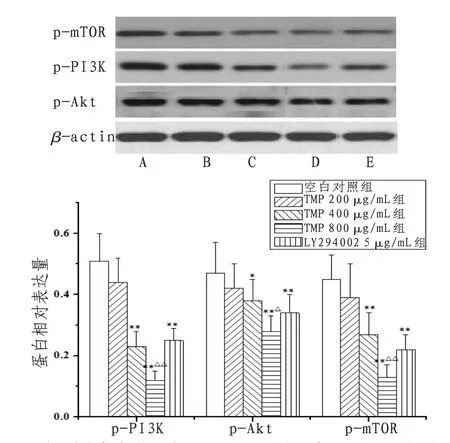
图5 TMP对人胃癌SGC-7901细胞p-PI3K、p-Akt、p-mTOR蛋白表达的影响
2.4 TMP对人胃癌SGC-7901细胞Cleaved Caspase-3、Cleaved Caspase-9蛋白表达的影响与空白对照组比较,TMP 400、800 μg/mL组和LY294002 5 μg/mL组Cleaved Caspase-3、Cleaved Caspase-9相对表达量明显提高(P<0.05);与LY294002 5 μg/mL组比较,TMP 800 μg/mL组Cleaved Caspase-3相对表达量明显提高(P<0.01)。见图6。
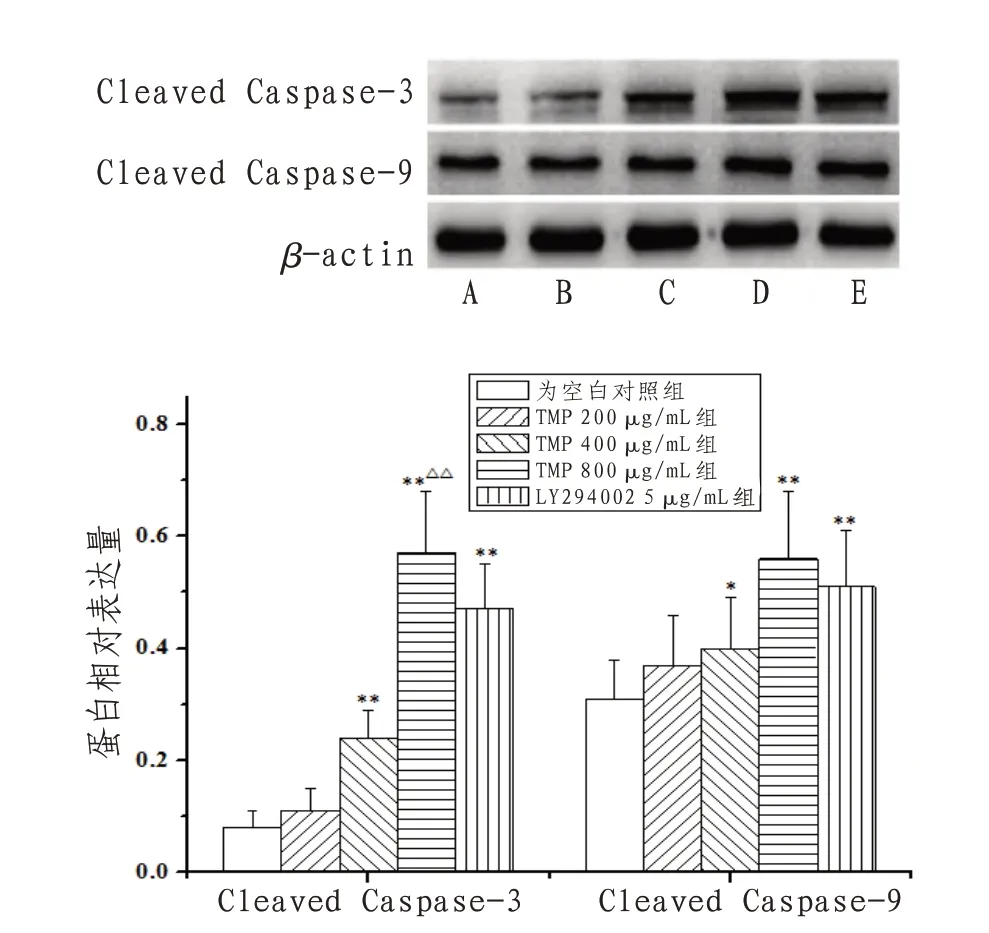
图6 TMP对人胃癌SGC-7901细胞Cleaved Caspase-3、Cleaved Caspase-9蛋白表达的影响
2.5 TMP对人胃癌SGC-7901细胞LC3蛋白表达及LC3-Ⅱ/LC3-I比值的影响与空白对照组比较,TMP 400、800 μg/mL组和LY294002 5 μg/mL组LC3-Ⅱ、LC3-I相对表达量和LC3-Ⅱ/LC3-I比值明显提高(P<0.01);与LY294002 5μg/mL组比较,TMP 800 μg/mL组LC3-Ⅱ、LC3-I相对表达量和LC3-Ⅱ/LC3-I比值明显提高(P<0.05)。见图7。
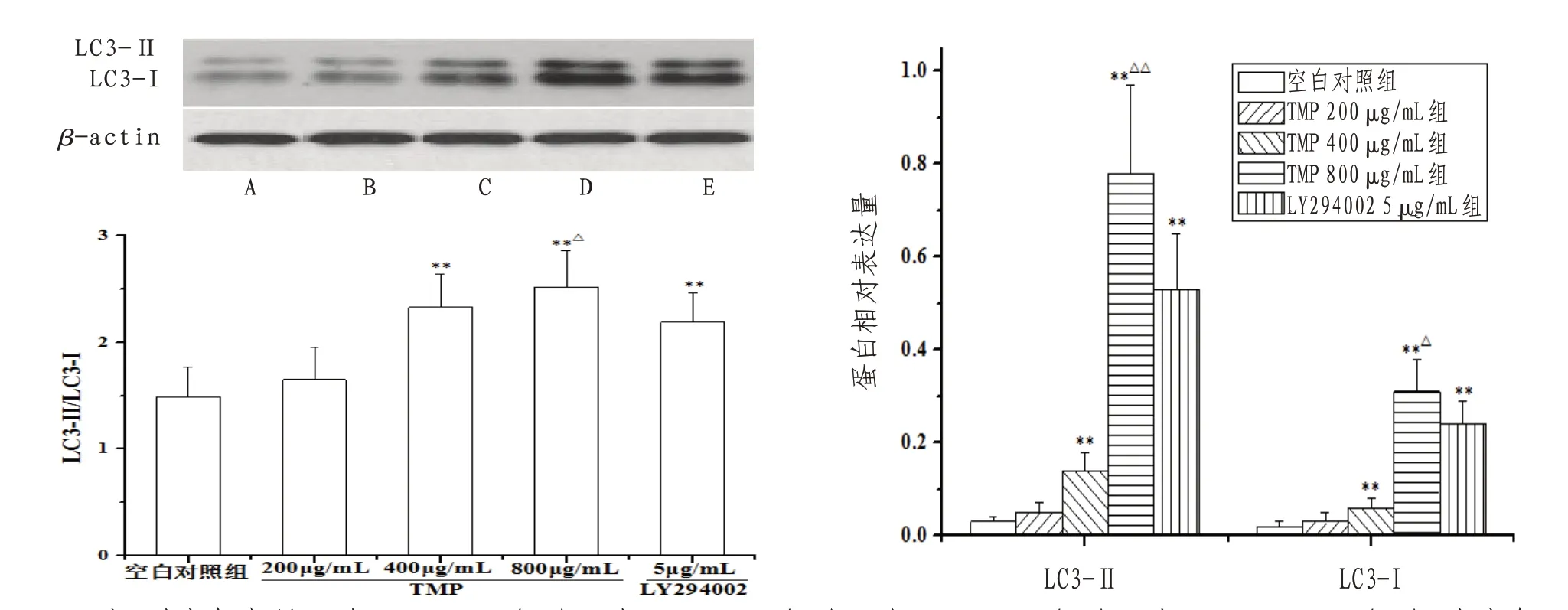
图7 TMP对人胃癌SGC-7901细胞LC3蛋白表达及LC3-Ⅱ/LC3-I比值的影响
3 讨论
胃癌是全球范围内最常见的消化系统肿瘤之一,每年新发病例约100万,每年病死人数约74万[8]。中医药抗肿瘤有独到的理论体系与诊疗优势[9],胃癌属中医“噎膈”“积聚”等范畴,其病机主要在于脾胃虚寒、瘀毒内阻、气血双亏所致胃脘气滞食积、痰凝血瘀、结而成积。
中药川芎是主产于我国四川省、云南省、贵州省等地的一种伞形科蒿本属植物,它辛温香燥,《日华子本草》记载其“上行可达巅顶、下行可达血海”“治一切风、一切气、一切劳损、一切血,排脓消瘀血”,具有广泛的活血祛瘀功效。中药川芎的主要活性成分TMP是一种吡嗪生物碱,既往文献[10]报道TMP可干预细胞凋亡自噬而抑制肿瘤。本研究发现,TMP可明显抑制人胃癌SGC-7901细胞增殖,促进其凋亡和自噬,并且800 μg/mL TMP组对SGC-7901细胞增殖、凋亡和自噬的效应优于LY294002组,提示TMP可促进胃癌细胞凋亡和自噬。
细胞凋亡和自噬是细胞两条程序化死亡途径,二者可作为抗癌治疗的靶点[11]。因肿瘤局部环境缺氧、Ca2+过载等将导致线粒体膜孔道开放度异常升高,致使线粒体内细胞色素C(cytochrome c,Cyt C)、凋亡诱导因子(apoptosis inducing factor,AIF)等释放进入细胞质,二者能够陆续活化Caspase-9、Caspase-3蛋白,其中Caspase-3可剪切破坏核酸、膜蛋白、结构蛋白等分子结构而导致细胞凋亡。LC3是细胞自噬的标志性蛋白,分为无生理活性的LC3-Ⅰ亚型和有促细胞自噬活性的LC3-Ⅱ亚型。文献[12]报道显示,自噬状态下无活性的LC3-Ⅰ可酶解一段多肽而成为有自噬活性的LC3-Ⅱ,所以LC3-Ⅱ/LC3-I比值可体现细胞自噬状况。
Akt为PI3K下游靶基因,其表达与活化受PI3K调控。p-PI3K、p-Akt为二者活化状态,p-Akt可间接抑制Caspase-3活化而抑制细胞凋亡[13]。mTOR是调控细胞自噬的关键蛋白,p-mTOR为其活化状态,有文献[14]报道p-mTOR可清除泛素蛋白而阻碍细胞自噬进程,而mTOR磷酸化过程受p-Akt调控。研究发现,给药干预PI3K/Akt/mTOR通路活化可促进胃癌细胞凋亡和自噬。本研究发现,TMP可明显降低SGC-7901细胞p-PI3K、p-Akt、p-mTOR相对表达量,提高Cleaved Caspase-3、Caspase-9、LC3-Ⅱ相对表达量和LC3-Ⅱ/LC3-Ⅰ比值[15];除Caspase-9外,800 μg/mL TMP组对其他蛋白表达和LC3-Ⅱ/LC3-Ⅰ比值的效应优于LY294002组,提示TMP促进胃癌细胞凋亡和自噬的作用可能与抑制PI3K/Akt/mTOR通路活化有关。
综上所述,TMP可能通过抑制PI3K/Akt/mTOR通路活化而诱导人胃癌细胞凋亡和自噬,本研究结果为TMP做为胃癌治疗药物提供了理论依据。
