基于网络药理学及分子对接分析川芎嗪治疗脓毒症的作用机制*
2022-12-27古惠文江勉君朱君瑶史忠亮郭力恒
古惠文,江勉君,朱君瑶,史忠亮,郭力恒
1广州中医药大学第二临床医学院,广东 广州 510403;2广州中医药大学第二附属医院
脓毒症是机体感染免疫失调导致的威胁生命的器官功能障碍[1]。据报道,因脓毒症入住ICU的患者占中国ICU患者的1/4,其90天死亡率高达35%[2]。目前,在脓毒症早期明确诊断,及早开始液体复苏与抗感染治疗是改善脓毒症预后的主要方式。近年来,中药材提取物被广泛用于治疗脓毒症,并取得良好的临床疗效,如丹参酮Ⅱ2a[3]、红花黄色素[4]和人参多糖[5]等。川芎嗪是提取自川芎的酰胺类生物碱,具有抗血栓、抗缺血再灌注损伤,保护重要器官的作用,对脓毒症所引起的器官损伤和并发症具有治疗作用[6]。但是,目前针对川芎嗪治疗脓毒症的研究较少,未能全面揭示川芎嗪治疗脓毒症的机制。本研究借助网络药理学研究方法和分子对接技术,挖掘川芎嗪治疗脓毒症的靶点,进行功能富集分析和疾病信号通路分析,筛选关键靶点与川芎嗪进行分子对接,以阐明川芎嗪治疗脓毒症的机制。
1 资料与方法
1.1 川芎嗪化合物靶点预测1)使用中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)数据库(http://tcmspw.com/tcmsp.php)预测川芎嗪化合物靶点,将预测结果上传Uniprot数据库(https://www.uniprot.org/)进行检索,选择物种为Homo sapiens(Human)的靶点,筛选出人源靶点。2)使用Pubchem数 据 库(https://pubchem.ncbi.nlm.nih.gov/)检索Ligustrazine,收集川芎嗪化合物的2D结构保存为SDF格式;将川芎嗪2D结构SDF上传至PharmMapper平台(http://www.lilabecust.cn/pharmmapper/),通过反向药效团匹配法预测川芎嗪相关靶点,将靶点上传Uniprot数据库,择物种为Homo sapiens(Human)的靶点,筛选出人源靶点。3)在通过Pubchem数据库收集川芎嗪Pubchem ID上传至BATMAN-TCM数据库(http://bionet.ncpsb.org/batman-tcm/)进行化合物靶点预测,筛选相关度较高。综合上述3种方法预测川芎嗪化合物靶点,排除重复、非人源和不符合要求的靶点,获得川芎嗪化合物靶点。
1.2 脓毒症疾病靶点预测以“Sepsis”作为检索词,在GeneCards(https://www.genecards.org/),OMIM(https://www.omim.org/),TTD(http://www.biomedsearch.com/)、DrugBank(https://www.drugbank.ca/)数据库预测脓毒症疾病靶点;收集上述4个疾病数据库所预测的脓毒症疾病靶点,排除重复靶点,获得脓毒症疾病靶点。
1.3 川芎嗪-脓毒症靶点网络构建将川芎嗪化合物靶点与脓毒症疾病靶点上传至生物平台OmicShare,进行靶点映射,取交集部分作为川芎嗪治疗脓毒症的作用靶点。将川芎嗪治疗脓毒症作用靶点上传至Cytoscape 3.7.1绘图软件构建川芎嗪-脓毒症靶点网络图。
1.4 川芎嗪治疗脓毒症作用靶点相互作用网络构建为了阐明靶点蛋白在系统上的作用,将作用靶点上传至STRING数据库(https://stringdb.org/)进行蛋白互作网络构建PPI,物种限定为“Homosapiens”,设置置信度为midum confidence(0.4)。Cytoscape-Cytohubba可以提供11种算法对复杂网络进行分析,筛选出在网络中发挥重要作用的靶点。将在STRING中所得的网络导入如Cytoscape 3.7.1中,利用插件Cytohubba,选择MCC算法对PPI网络进行分析打分,选择分值最大的前10个靶点作为关键靶点。
1.5 GO功能富集分析与KEGG信号通路分析将川芎嗪治疗脓毒症作用靶点上传至DAVID数据库(https://david.ncifcrf.gov/),设置P<0.05,对川芎嗪治疗脓毒症作用靶点同时进行生物过程(biological process,BP)、分子组成(molecular function,MF)、细胞组成(cellular component,CC)分析和KEGG信号通路富集分析。
1.6 川芎嗪-关键靶点分子对接在PDB数据库搜索川芎嗪治疗脓毒症的关键靶点的蛋白晶体复合物,借助PyMOL软件将靶蛋白与原配体分离,同时去除靶蛋白中的水分子、磷酸根及多余的非活性配体,在AutoDuck Tools软件中对处理后靶蛋白进行加氢、加电荷等操作。将川芎嗪的2D结构导入ChemBio3D软件,以mol2的格式保存其3D结构,将靶点蛋白、原配体、川芎嗪的3D结构统一设置成AutoDuck Tools软件可识别的pdbqt格式,以原配体所在位点为靶蛋白的活性口袋,进行靶蛋白与川芎嗪的分子对接,对比分析川芎嗪与各靶蛋白的亲和力。
2 结果
2.1 川芎嗪化合物靶点与脓毒症疾病靶点通过“1.1”项中的3种方法收集川芎嗪化合物靶点,经排除重复、非人源性,不符合要求的靶点后,共收集川芎嗪化合物靶点243个。在GeneCards OMIM,DrugBank,TTD 4个数据库收集脓毒症疾病靶点,排除重复靶点后,共收集脓毒症靶点1227个。使用生物平台OmicShare对川芎嗪化合物靶点与脓毒症疾病靶点进行映射得到川芎嗪治疗脓毒症的作用靶点46个;将结果导入Cytoscape 3.7.1构建川芎嗪-脓毒症网络图。见图1。
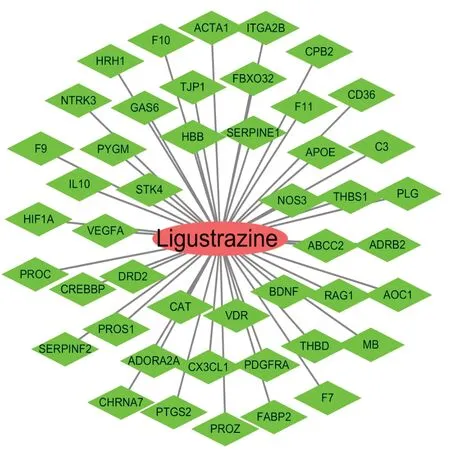
图1 川芎嗪-脓毒症靶点网络图
2.2 川芎嗪治疗脓毒症的PPISTK4和FBXO32靶点未与其余靶点存在相互作用关系,将其排除。使用Cytohubba插件对PPI图进行分析,共有44个节点,184条相关作用连线,筛选出关键节点10个,包括SERPINE1、PLG、SERPINF2、CPB2、F9、THBD、F10、IL-10、VEGFA、NOS3。见图2、表1。
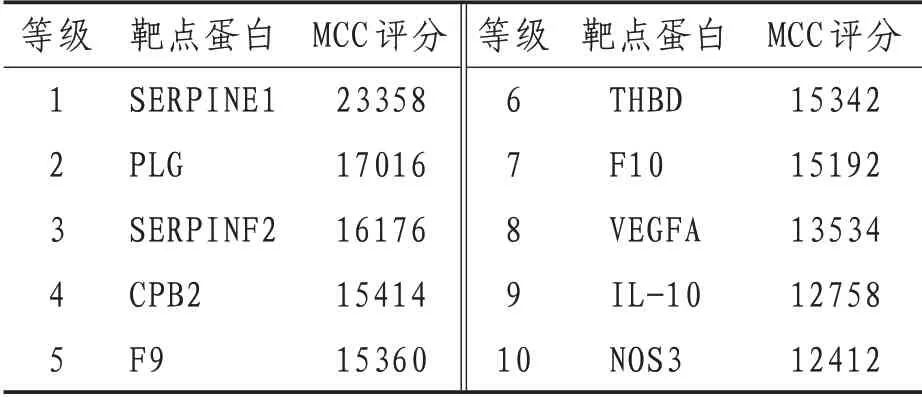
表1 川芎嗪治疗脓毒症关键靶点及MCC分值

图2 川芎嗪治疗脓毒症作用靶点的蛋白互作网络关系
2.3 GO功能富集及KEGG信号通络依据P<0.05筛选GO条目,BP有30个,CC7个,MF7个。BP涉及凝血、血管再生、纤溶系统、钠离子迁移、炎症反应等;CC涉及细胞外区域、血液微粒、细胞外泌体、纤维蛋白复合物、细胞外基质;分子功能涉及血红素结合、丝氨酸型内肽酶活性、钙离子结合、肝素结合、氧转运蛋白活性、氧结合。依据P-Value<0.05筛选KEGG条目,得到KEGG条目10条,涉及补体和凝血级联、疟疾、神经活性配体-受体相互作用、钙信号通路、HIF-1信号通路、Rap1信号通路、金黄色葡萄球菌感染、FoxO信号通路、VEGF信号通路、利什曼病。见图3、表2。
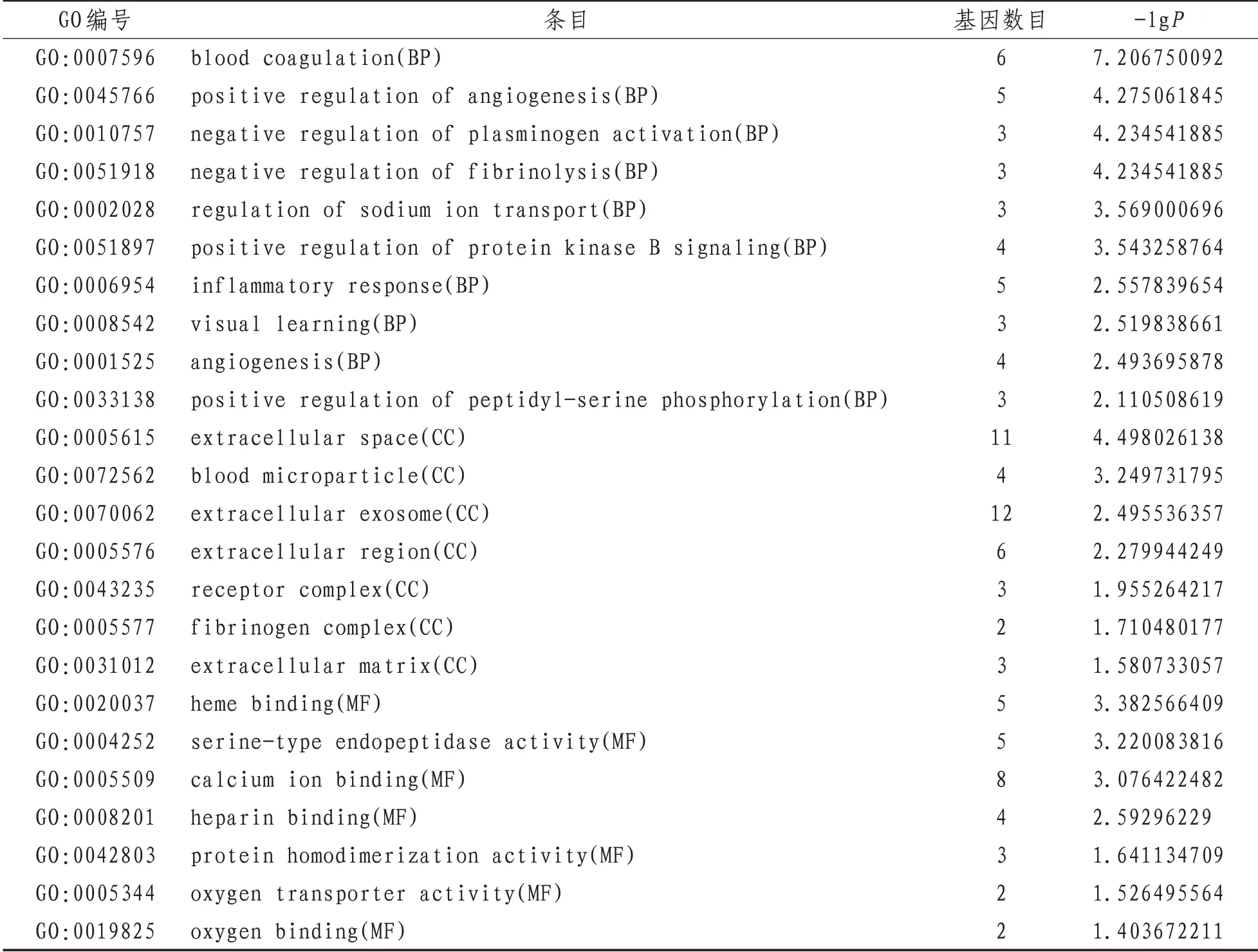
表2 川芎嗪治疗脓毒症作用靶点的GO分析
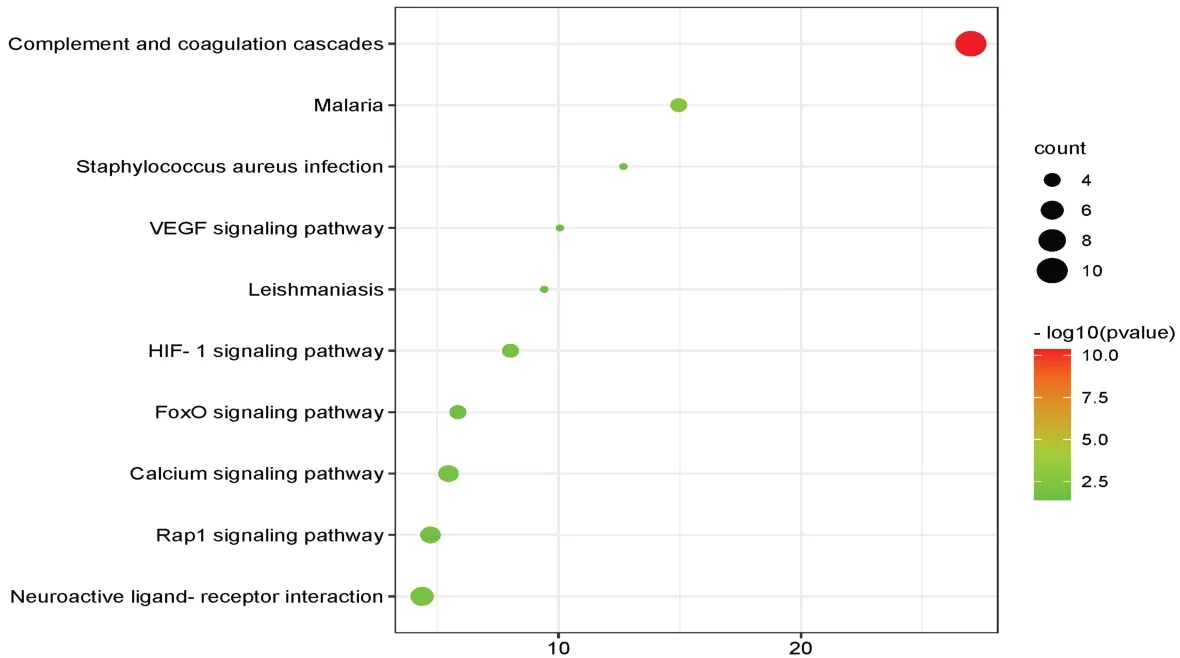
图3 川芎嗪对脓毒症作用靶点的KEGG分析的气泡图
2.4 川芎嗪-关键靶点分子对接使用AutoDock vina1.1.2将化合物川芎嗪10个关键靶点蛋白进行分子对接验证。其中Affinity<-4.5 kal/mol的靶点有IL-10、CPB2、THBD、SERPRINE1。结果表明这5个靶点蛋白容易与川芎嗪分子进行结合,结合后结构稳定。见表3。
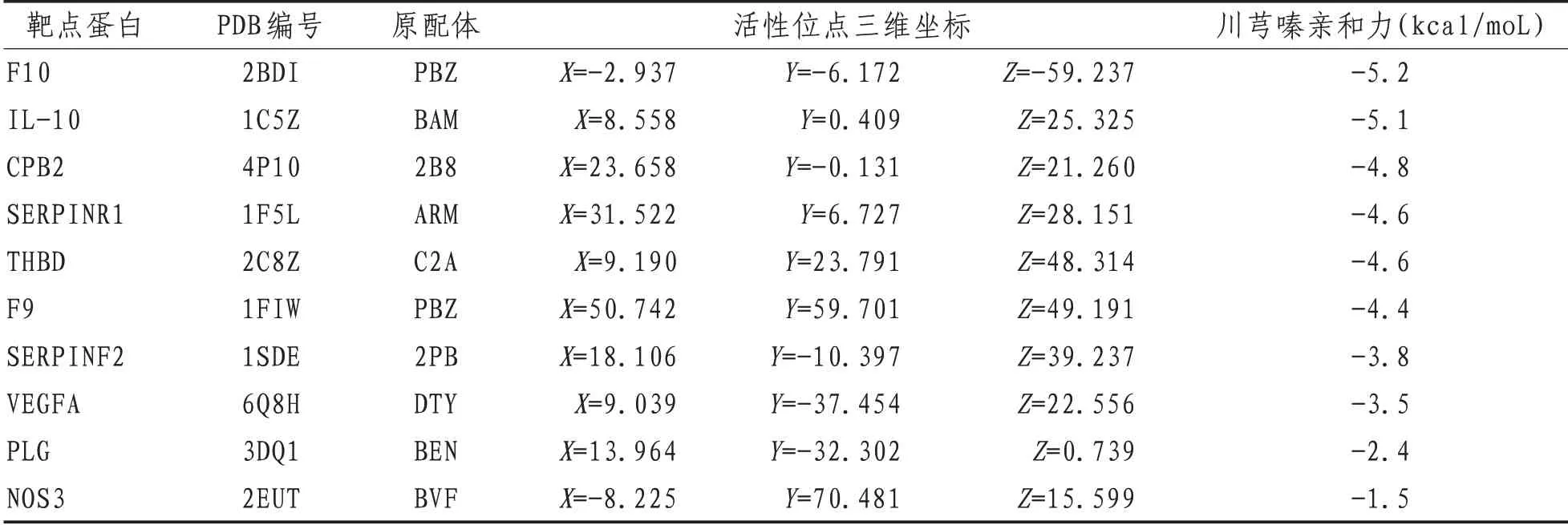
表3 川芎嗪治疗脓毒症作用关键靶点分子对接结果
3 讨论
川芎嗪具有抗炎、抗氧化、抗凋亡的作用[7]。临床研究表明,川芎嗪能够抑制肿瘤坏死因子(tumor necrosis factor-α,TNF-α)和白细胞介素6的生成,改善脓毒症患者的预后[8-9]。同时多个动物研究也表明,川芎嗪对于脓毒症动物的重要器官具有保护作用。如肖雷等[10]研究表明,川芎嗪可能通过激活Nrf2/HO-1通路,增强超氧化物歧化酶、谷胱甘肽转移酶活性,降低丙二醛水平,增强肝组织抗氧化能力,保护脓毒症小鼠的肝功能。YING等[11]发现,川芎嗪可减少NMDAR1(谷氨酸受体)和凋亡蛋白Caspase3的表达,减少脓毒症小鼠的肾脏损伤,提高脓毒症小鼠的存活率。
本研究通过Cytohubba插件对PPI网络进行分析,筛选出在PPI中发挥重要作用的10个关键靶点,然后利用分子对接技术对关键靶点与川芎嗪分子进行分子对接。结果显示F10、IL-10、CPB2、THBD、SERPRINE1等5个靶点蛋白与川芎嗪分子对接亲和力最高,容易形成稳定结构,发挥作用。其中F10、CPB2、THBD、SERPRINE1涉及凝血-抗凝-纤溶系统,IL-10涉及炎症反应。感染造成炎症因子大量生成,损伤血管内皮细胞,激活凝血系统,抑制抗凝和纤溶系统引起血液高凝状态甚至是弥漫性血管凝血(diffuse intravascular coagulation,DIC),这成为脓毒症后期形成多器官功能障碍综合征的关键因素[12-13]。F10是凝血途径中的重要凝血因子,既可以被FIXa激活启动内源性凝血途径,又可以被FⅢFVⅡa复合物激活启动外源性凝血途径,是凝血级联中的关键酶[14]。临床研究表明,对脓毒症患者使用低分子肝素抑制FXa激活可以延长部分活化凝血酶原时间及凝血酶原时间,减少纤维蛋白生成,改善凝血功能障碍和器官功能障碍[15-16]。血栓调节蛋白是THBD基因编码的蛋白产物,可减少内皮细胞损伤,有保护血管上皮的作用[17-18]。羧肽酶B2(carboxypeptidase b2,CPB2)与SERPINE1参与纤溶系统的调节,都具有限制纤溶酶生成,减少纤溶的作用。LEENAERTS等[19]通过限制纤溶酶生成正反馈机制而减少纤溶。SHI等[20]则通过抑制尿激酶与组织型纤溶酶原激活剂减少纤溶。IL-10是由T细胞产生的具有免疫调节作用的细胞因子;可通过减少IFN-γ、IL-2和IL-12的生成来抑制巨噬细胞的活性。这可避免细胞因子风暴的形成,维持免疫平衡[21-22]。
通过KEGG分析获得10条信号通路,包括补体与凝血级联,钙信号通路,HIF-1信号通路,VEGF信号通路,金黄色葡萄球菌感染,FoxO信号通路,Rap1信号通路。其中富集因子最大的补体和凝血级联可能是川芎嗪治疗脓毒症的过程中主要的作用途径。补体是固有免疫系统的重要组成部分,通过调理病原体,吸附白细胞吞噬和裂解病原体和感染组织,激活特异性免疫系统[23]。而且补体与凝血级联关系密切,补体可以通过刺激炎症因子的释放激活凝血途径,生成大量凝血酶,同时抑制抗凝与纤溶系统[24]。研究表明,大量补体的消耗往往意味广泛凝血的激活[25];而过度的凝血激活对于脓毒症患者是不利的,这会造成血液高凝状态甚至是DIC[26]。钙信号通路广泛存在于人体,参与机体生理病理过程。脓毒症时,钙通路开放,造成钙离子内流。钙离子的大量增加促进自噬相关基因增加和自噬相关信号受体的表达,增加机体自噬,维持细胞稳定,减少细胞凋亡[27]。HIF-1A信号通路可被由感染或灌注不足引起的缺氧所激活,启动全身HIF-1A信号级联反应,破坏肺泡上皮细胞,这可能是造成脓毒症急性肺损伤的机制[28]。VANDERFM,封萍等[29-30]发现,通过乌司他丁抑制VEGF的生成可有效的减少血管损伤,改善脓毒症患者的预后。金黄色葡萄球菌(staphylococcus aureus,SA)是常见的病原菌,同时也是脓毒症的主要致病菌。SA入侵机体后,可以通过各种粘附分子定植在细胞表面,或者血浆蛋白和细胞外基质中,释放多种毒力因子,包括破坏组织细胞的外毒素和造成免疫紊乱的内毒素。此外,SA可通过抑制中性粒细胞渗出趋化和补体激活吞噬而抑制固有免疫;同时还能通过促进B细胞凋亡和抑制T细胞成熟来抑制特异性免疫[31-32]。FoxO信号通路参与机体的增殖、凋亡、代谢、炎症、细胞因子表达、免疫、分化和抗氧化应激等生理病理过程。其中FOXO3a可以增加前凋亡基因的表达,促进细胞凋亡导致器官损伤。而在敲除FOXO3a基因的大鼠中,LPS所诱导的细胞凋亡出现下调[33-35]。Rap1是cAMP的下游信号分子,能够抑制NF-κB和调节炎症基因的表达,改善由LPS诱发的肺部炎症。
本研究借助网络药理学及分子对接,系统研究了川芎嗪治疗脓毒症的靶点、生物过程、信号通路等,发现川芎嗪治疗脓毒症可能通过作用于F10、IL-10、CPB2、THBD、SERPRINE1等关键靶点,调节脓毒症过程中的补体与凝血级联,钙信号通路,HIF-1信号通路,VEGF信号通路,金黄色葡萄球菌感染,FoxO信号通路,Rap1信号通路,发挥作用,全面揭示了川芎嗪多靶点、多通路、多机制治疗脓毒症的药理学作用,为后续进一步研究提供思路。
