基于药效及正交试验研究蓝金口服液提取纯化工艺
2022-12-27刘学武邹振兴宋太发徐康平周书奥谭桂山王毅清张乐佳
宋 军,陈 静,刘学武,邹振兴,宋太发,徐康平,周书奥,谭桂山,王毅清,张乐佳*
(1.湖南中嘉生物医药有限公司,湖南 长沙 410036;2.新药药效与安全性评价湖南省重点实验室,湖南 长沙 410331;3.中南大学湘雅药学院,湖南 长沙 410013)
蓝金口服液作为医院制剂用于临床20 余年,治疗风热表证型上呼吸道感染疗效确切。 方中板蓝根清解疫毒为君,配金银花、连翘为臣,可清热解毒,增板蓝根之效;用柴胡、荆芥为佐,开肌腠以祛邪外出,透疫毒以泄邪热。 各药相合,于清热解毒之中透表泄热,发汗祛邪之中解毒消肿,对温疫邪毒侵犯人体,发热较甚,邪在卫表者,常为对证之剂。
中药制剂提取纯化工艺的筛选主要通过正交试验优选其工艺条件,评价指标多偏重指标成分,而指标成分的含量高低与临床疗效并没有直接联系,通过指标成分的含量高低来评价工艺优劣有失偏颇[1-2]。中药新药研究中鼓励以“疗效指标”来评价工艺优劣,包括有效成分含量、药物效应的高低等。 本研究采用中药药理和中药化学相结合的中药研究思路,针对处方的功能主治,结合处方药味活性成分的性质,设计不同的提取纯化工艺,选择大鼠干酵母所致体温升高模型进行药效学研究[3],以样品药物效应强度为评价指标,选取合适的提取纯化工艺。在此基础上,通过正交试验和单因素考察试验,进一步优化提取纯化工艺,为后续新药研发提供基础。
1 材料
1.1 主要仪器
高效液相色谱仪(美国安捷伦公司,型号:1260);数显恒温水浴锅、电热鼓风干燥箱(天津泰斯特仪器有限公司,型号:DK-98-Ⅱ、WGL-125B);超纯水机(密理博有限公司,型号:Direct-Q5UV-R);高速离心机(长沙英泰仪器有限公司,型号:TG16);电子天平(赛多利斯科学仪器有限公司,型号:SECURA225D-1CN)。
1.2 主要药品
腺苷对照品(批号:110879-201703,纯度:99.7%)、绿原酸对照品(批号:110753-202018,纯度:96.1%)均购自中国食品药品检定研究院;活性干酵母粉(安琪酵母股份有限公司,批号:12000222);阿司匹林(拜耳医药保健公司,批号:BJ32600);甲醇和乙腈(色谱纯,美国TEDIA 公司),其他试剂均为分析纯。板蓝根[4]214-215(批号:210401)、金银花[4]230-232(批号:210301)、连翘[4]177-178(批号:210102)、柴胡[4]293(批号:201201)、荆芥[4]243-244(批号:201201)、射干[4]297-298(批号:210401)、甘草[4]88-89(批号:210106)等药材饮片均购自湖南新汇制药股份有限公司,经鉴定与分析,均符合《中华人民共和国药典》2020 年版一部[4]各药味项下规定。
1.3 实验动物
健康SD 大鼠110 只,雌雄各半,普通级,体质量(200±20) g,购于湖南斯莱克景达实验动物有限公司,实验动物生产许可证号:SCXK(湘)2019-0004。于湖南省药物安全评价研究中心实验室饲养,实验动物使用许可证号:SYXK(湘)2020-0015。 动物饲养温度:20~26 ℃,湿度:40%~70%,换气次数≥15 次/h,照明时间:每日12 h/12 h 交替照明。
2 方法
2.1 基于药效试验的工艺初筛
2.1.1 实验药物制备 (1)GY-01、GY-02、GY-03、GY-04、GY-05 样品的制备。 取处方量药材荆芥,加10 倍量水,蒸馏法提取约400 mL 芳香水,备用;药渣中加入处方量其他药材金银花、连翘、柴胡、板蓝根、射干、甘草,补加水至总药材的10 倍量,加热提取2 h,滤过;第2 次加10 倍量水提取1.5 h,滤过,合并滤液,取4 份滤液,每份为总体积的1/5,浓缩至相对密度为1.05~1.10 的清膏(60 ℃测),离心(2500 r/min,20 min,离心半径9.954 cm),分别加乙醇至醇浓度为0%、30%、50%、70%,醇沉,离心(2500 r/min,20 min,离心半径9.954 cm),取上清液,浓缩至无醇味,加入相当量芳香水,加水调整体积至200 mL;得GY-01、GY-02、GY-03、GY-04 样品。 上述药渣加10 倍量70%乙醇提取1.5 h,浓缩至无醇味,加水定容过滤,得GY-05 样品。
(2)GY-06、GY-07、GY-08、GY-09 样 品 的 制备。 取处方量药材金银花、连翘、柴胡、荆芥,加10倍量水,蒸馏法提取约400 mL 芳香水,备用;药渣中加入处方量其他药材(板蓝根、射干、甘草),补加水至总药材的10 倍量,加热提取2 h,滤过;第2 次加8 倍量水提取1.5 h,过滤,合并滤液,取4 份滤液,每份为总体积的1/5,浓缩至相对密度1.05~1.10的清膏(60 ℃测),离心(2500 r/min,20 min,离心半径9.954 cm),分别加醇至醇浓度为0%、30%、50%、70%,醇 沉,离 心(2500 r/min,20 min,离 心 半 径9.954 cm),取上清液,浓缩至无醇味,加入相当量芳香水,加水调整体积至200 mL;得GY-06、GY-07、GY-08、GY-09 样品。
2.1.2 药效筛选试验 (1)分组、给药。 试验大鼠于检疫结束后测肛温2 次,选取体温波动小于0.5 ℃的健康SD 大鼠110 只,雌雄各半,体质量180.1~219.4 g,按性别、体质量随机分为5 组,每组10 只,分别为模型组、阿司匹林组(5.4 mL/kg)及GY-01、GY-02、GY-03、GY-04、GY-05、GY-06、GY-07、GY-08、GY-09 样品组。 每日给药前将阿司匹林片(研磨成粉末)及GY 样品用蒸馏水按剂量配制成相应浓度,现配现用。各给药组大鼠按10 mL/kg 灌胃给予相应浓度药液,1 次/d,连续7 d,模型对照组灌胃给予等体积蒸馏水。
(2)指标检测。 各组大鼠于给药第5、第6 天分别测定肛温1 次,使之适应。 于末次给药前禁食不禁水12 h,造模前测定基础肛温值,测定后各鼠背部皮下注射20%干酵母-生理盐水悬液10 mL/kg,于造模后4 h 按组别灌胃给予对应药物或蒸馏水,检测造模后1、2、4、5、6、8、10 h 肛温,并计算体温波动值△t=t基础体温-t造模后体温。
(3)试验结果。 各组大鼠造模前体温无明显差异。 与模型组比较,GY-07 组大鼠造模后5 h 体温波动值显著减小(P<0.05);阿司匹林组及GY-01、GY-02、GY-03、GY-04、GY-06、GY-07、GY-08、GY-09 组大鼠造模后6 h 体温波动值显著减小(P<0.05 或P<0.01);阿司匹林组及GY-01、GY-02、GY-06、GY-07、GY-08 组大鼠造模后8 h 及10 h 体温波动值显著减小(P<0.05 或P<0.01)。 详见表1。
表1 各组大鼠体温波动值比较(±s,n=10,℃)
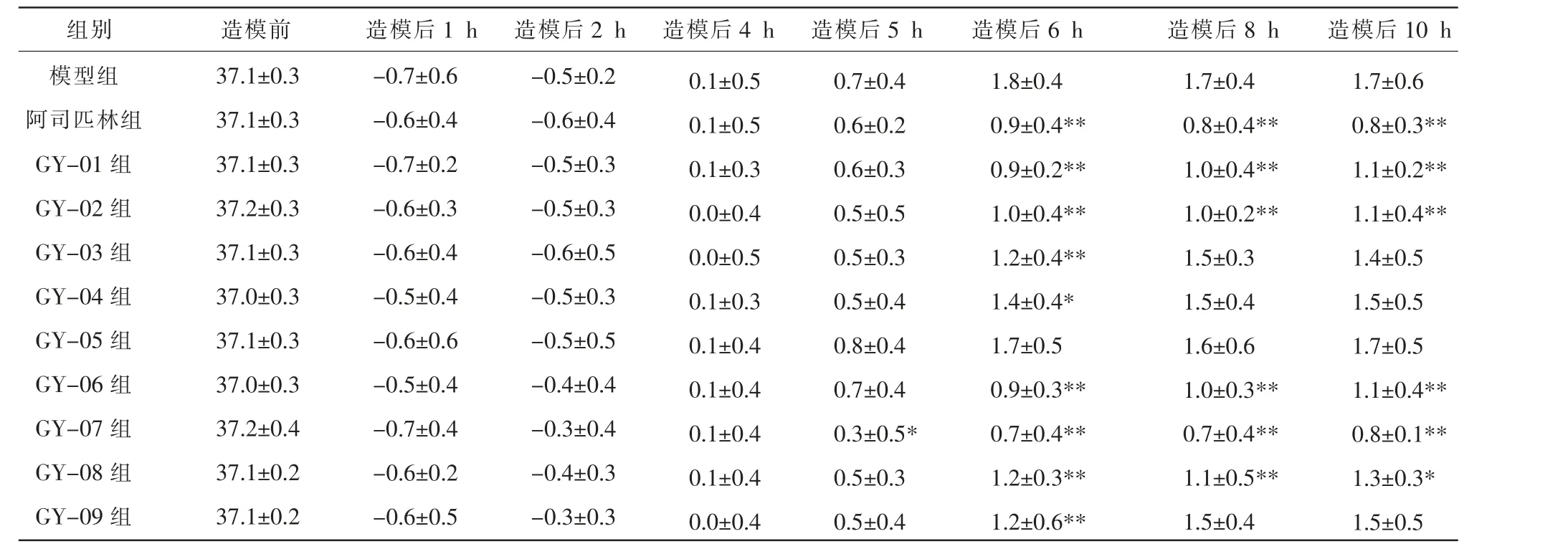
表1 各组大鼠体温波动值比较(±s,n=10,℃)
注:与模型组比较,*P<0.05,**P<0.01。
组别 造模前 造模后1 h 造模后2 h 造模后4 h 造模后5 h 造模后6 h 造模后8 h 造模后10 h模型组阿司匹林组GY-01 组GY-02 组GY-03 组GY-04 组GY-05 组GY-06 组GY-07 组GY-08 组GY-09 组37.1±0.3 37.1±0.3 37.1±0.3 37.2±0.3 37.1±0.3 37.0±0.3 37.1±0.3 37.0±0.3 37.2±0.4 37.1±0.2 37.1±0.2-0.7±0.6-0.6±0.4-0.7±0.2-0.6±0.3-0.6±0.4-0.5±0.4-0.6±0.6-0.5±0.4-0.7±0.4-0.6±0.2-0.6±0.5-0.5±0.2-0.6±0.4-0.5±0.3-0.5±0.3-0.6±0.5-0.5±0.3-0.5±0.5-0.4±0.4-0.3±0.4-0.4±0.3-0.3±0.3 0.1±0.5 0.1±0.5 0.1±0.3 0.0±0.4 0.0±0.5 0.1±0.3 0.1±0.4 0.1±0.4 0.1±0.4 0.1±0.4 0.0±0.4 0.7±0.4 0.6±0.2 0.6±0.3 0.5±0.5 0.5±0.3 0.5±0.4 0.8±0.4 0.7±0.4 0.3±0.5*0.5±0.3 0.5±0.4 1.8±0.4 0.9±0.4**0.9±0.2**1.0±0.4**1.2±0.4**1.4±0.4*1.7±0.5 0.9±0.3**0.7±0.4**1.2±0.3**1.2±0.6**1.7±0.4 0.8±0.4**1.0±0.4**1.0±0.2**1.5±0.3 1.5±0.4 1.6±0.6 1.0±0.3**0.7±0.4**1.1±0.5**1.5±0.4 1.7±0.6 0.8±0.3**1.1±0.2**1.1±0.4**1.4±0.5 1.5±0.5 1.7±0.5 1.1±0.4**0.8±0.1**1.3±0.3*1.5±0.5
结果显示,GY-01、GY-02、GY-03、GY-04、GY-06、GY-07、GY-08、GY-09 样品均能显著降低干酵母所致大鼠体温,其中GY-07 样品起效时间最早,体温波动值最小,效果最优。
鉴于上述试验结果,可确认GY-07 样品的制备工艺为初步提取纯化工艺:取处方量金银花、连翘、柴胡、荆芥,加10 倍量水,蒸馏法提取约400 mL 芳香水,备用;在上述药渣中加入处方量板蓝根、射干、甘草,补加水至总药材的10 倍量,加热提取2 h,滤过;第2 次加8 倍量提取1.5 h,过滤,合并两次提取液,减压浓缩至相对密度1.05~1.10 的清膏(60 ℃测),离心(2500 r/min,20 min,离心半径9.954 cm),上清液加乙醇至醇浓度为30%,醇沉纯化。 考虑在此基础上,通过正交试验进一步优选蓝金口服液的最佳提取工艺。
2.2 腺苷、绿原酸的含量测定
2.2.1 腺苷的含量测定[5-6](1)色谱条件。 COSMOSIL 亲水柱(250 mm×4.6 mm,5 μm);流动相:甲醇-水(10∶90);流速:1 mL·min-1;柱温:30 ℃;检测波长:260 nm;进样量:10 μL;理论板数按腺苷峰计算应不低于5000。
(2)对照品溶液的制备。 精密称取腺苷对照品16.78 mg,置100 mL 容量瓶中,加流动相溶解并稀释至刻度,摇匀,即得。
(3)供试品溶液的制备。按药效试验筛选的初步提取工艺制备提取液,摇匀,量取约8 mL 置于离心管中,以3000 r/min 离心15 min(离心半径10.58 cm),取上清液,即得。
(4)阴性样品溶液的制备。 按处方量称取除板蓝根外的6 味药材,按药效试验筛选的初步提取工艺制备缺板蓝根的阴性样品,按上述供试品溶液的制备方法制备,即得。
(5)专属性试验。 分别取对照品溶液、供试品溶液、缺板蓝根的阴性样品溶液,按“2.2.1(1)”项下色谱条件测定,结果如图1 所示。 阴性样品色谱图中,在与腺苷对照品相同保留时间处未见色谱峰,表明阴性无干扰,方法专属性良好。
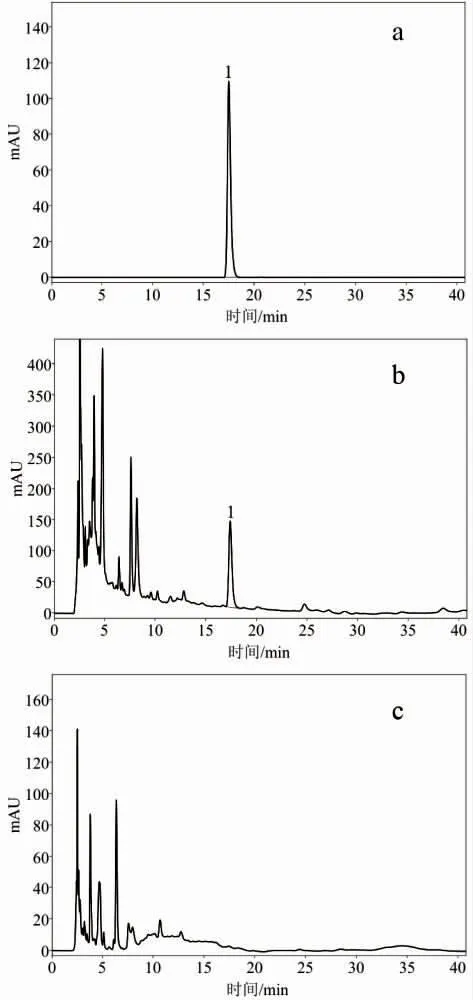
图1 蓝金口服液腺苷专属性试验色谱图
(6)线性关系考察。 分别精密吸取“2.2.1(2)”制备的对照品溶液0.5、1.0、2.0、4.0、8.0 mL 于10 mL容量瓶中,加流动相稀释成不同系列标准溶液,按“2.2.1(1)”项下色谱条件测定,记录色谱图,以质量为X 轴,峰面积为Y 轴,进行线性回归分析,得回归方程:Y=276.13X+10.9,R2=1.000 0。 结果表明,腺苷的质量在0.083 7~1.673 0 mg 的范围内,峰面积与质量呈现良好的线性关系。
(7)精密度试验。 取按“2.2.1(2)”项下方法制备的对照品溶液,按“2.2.1(1)”项下色谱条件连续进样6 次。测定腺苷峰面积,结果得峰面积RSD 为0.78%,表明仪器精密度良好。
(8)稳定性试验。 取按“2.2.1(3)”项下方法制备的供试品溶液,按“2.2.1(1)”项下色谱条件,分别于0、4、8、12、24、48 h 注入液相色谱仪,结果得峰面积RSD 为0.60%,表明供试品溶液放置48 h 内,溶液基本稳定。
(9)重复性试验。 取按“2.2.1(3)”项下方法制备的供试品溶液6 份,按“2.2.1(1)”项下色谱条件测定腺苷含量,结果得RSD 值为0.57%,表明方法重复性良好。
(10)加样回收率试验。称取腺苷对照品适量,精密称定,加流动相溶解并定容至刻度,摇匀,得约0.175 mg/mL 腺苷对照品溶液。 精密量取已测腺苷含量的供试品溶液5 mL 于10 mL 量瓶中,再分别精密量取上述腺苷对照品溶液1、2、2.4 mL(回收率50% S1、回收率100% S2、回收率120% S3),混合,摇匀,加流动相定容至刻度。量取约8 mL 置于离心管中,以3000 r/min 离心15 min(离心半径10.58 cm),取上清液,即得。 每种浓度分别制备3 份供试品溶液,用9 份样品的测定结果进行评价,结果见表2。可知,腺苷平均回收率为94.58%,RSD 为2.64%,表明该法的回收率良好。
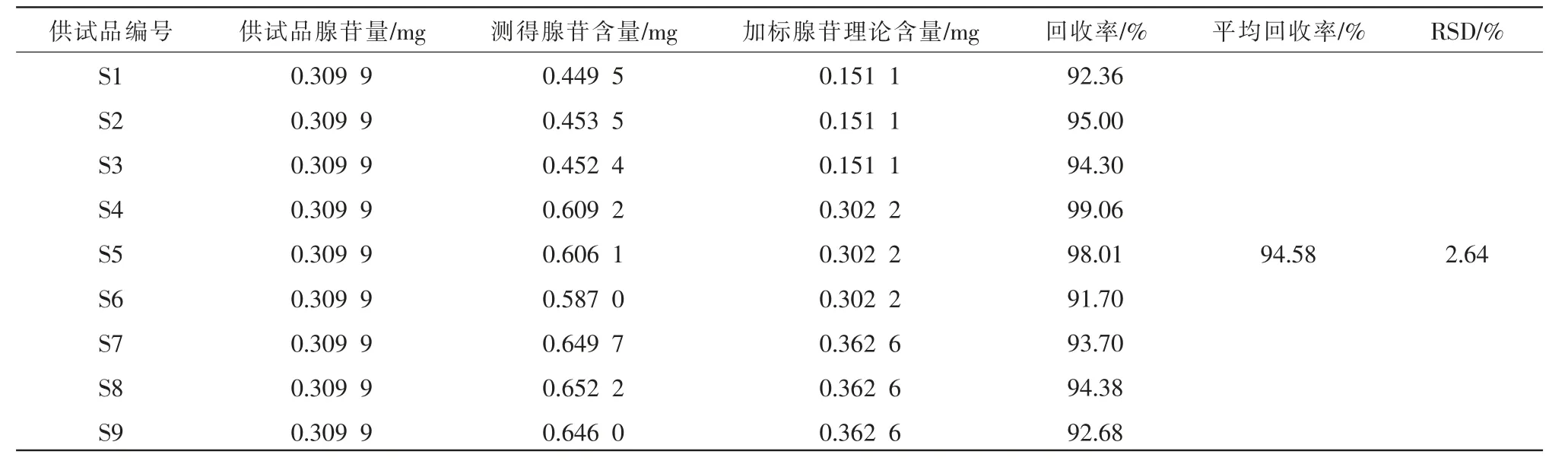
表2 腺苷加样回收率试验结果(n=9)
2.2.2 绿原酸的含量测定[4]230-232(1)色谱条件。 Agilent Eclipse C18色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈-0.4%磷酸(10∶90);流速:1 mL·min-1;柱温:30 ℃;检测波长:327 nm;进样量:10 μL;理论板数按绿原酸峰计算应不低于5000。
(2)对照品溶液的制备。精密称取绿原酸对照品10.73 mg,置100 mL 容量瓶中,加流动相溶解并稀释至刻度,摇匀,即得。
(3)供试品溶液的制备。按药效试验筛选的初步提取工艺制备提取液,摇匀,量取约8 mL 置于离心管中,以3000 r/min 离心15 min(离心半径10.58 cm),取上清液,即得。
(4)阴性样品溶液的制备。按处方量称取除金银花外的6 味药材,按药效试验筛选的初步提取工艺制备缺金银花的阴性样品,按“2.2.2(3)”供试品溶液的制备方法制备,即得。
(5)专属性试验。 分别取对照品溶液、供试品溶液、缺金银花的阴性样品溶液,按“2.2.2(1)”项下色谱条件测定,结果如图2 所示。 阴性样品色谱图中,在与绿原酸对照品相同保留时间处未见色谱峰,表明阴性无干扰,方法专属性良好。

图2 蓝金口服液绿原酸专属性试验色谱图
(6)线性关系考察。 分别精密吸取“2.2.2(2)”制备的对照品溶液0.5、1.0、2.0、4.0、8.0 mL 于10 mL容量瓶中,加流动相稀释成不同系列标准溶液,按“2.2.2(1)”项下色谱条件测定,记录色谱图,以质量为X 轴,峰面积为Y 轴,进行线性回归分析,得回归方程为:Y=2 812.8X+6.356 2,R2=0.999 9。 结果表明绿原酸的质量在0.051 6~1.031 0 mg 的范围内,峰面积与质量呈现良好的线性关系。
(7)精密度试验。 取按“2.2.2(2)”项下方法制备的对照品溶液连续进样6 次。 测定绿原酸峰面积,结果得峰面积RSD 为0.16%,表明仪器精密度良好。
(8)稳定性试验。 取按“2.2.2(3)”项下方法制备的供试品溶液6 份,按“2.2.2(1)”项下色谱条件,分别于0、4、8、12、24、48 h 注入液相色谱仪,结果得峰面积RSD 为0.54%, 表明供试品溶液放置48 h 内,溶液基本稳定。
(9)重复性试验。 取按“2.2.2(3)”项下方法制备的供试品溶液6 份,按“2.2.2(1)”项下色谱条件测定绿原酸含量,结果得RSD 值为1.71%,表明方法重复性良好。
(10)加样回收率试验。称取绿原酸对照品适量,精密称定,加流动相溶解并定容至刻度,摇匀,得约2 mg/mL 绿原酸对照品溶液。 精密量取已测绿原酸含量的供试品溶液5 mL 于10 mL 量瓶中,再分别精密量取上述绿原酸对照品溶液1、2、2.4 mL(回收率50% S1、回收率100% S2、回收率120% S3),混合,摇匀,加流动相定容至刻度。 量取约8 mL 置于离心管中,以3000 r/min离心15 min(离心半径10.58 cm),取上清液,即得。 每种浓度分别制备3 份供试品溶液进行测定,用9 份样品的测定结果进行评价,结果见表3。 可知,绿原酸平均回收率为102.37%,RSD为1.88%,表明该法的回收率良好。
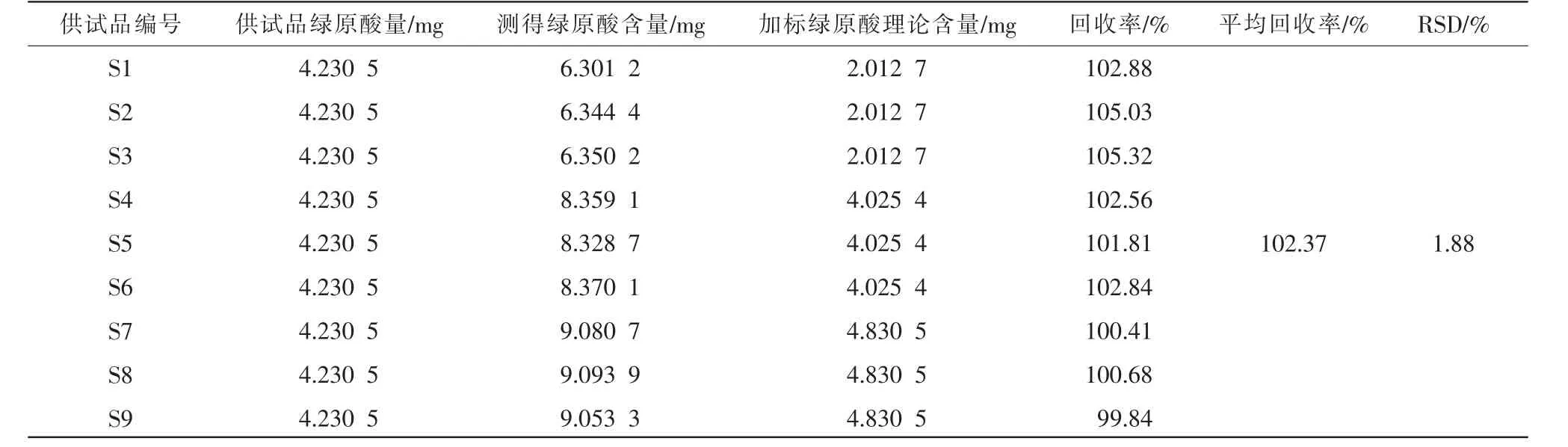
表3 绿原酸加样回收率试验结果(n=9)
2.3 提取工艺考察
君药板蓝根水煎剂具有抗细菌、抗病毒及免疫调节作用,在体外能抑制多种细菌生长,其代表性成分为腺苷,有抗炎、抗菌、抗病毒作用[7-9];臣药金银花含绿原酸、异绿原酸等,其煎剂对金黄色葡萄球菌、大肠埃希菌、志贺菌属、霍乱弧菌、伤寒沙门菌等致病菌有一定的抑制作用,对肺炎链球菌、脑膜炎奈瑟菌、铜绿假单胞菌、结核分枝杆菌亦有效[10-12]。 因此,测定绿原酸、腺苷的提取量和浸膏得率[浸膏得率=干膏质量×稀释倍数/药材质量×100%]能反映和控制该提取液的内在质量,可以作为提取工艺的评价指标。
正交试验及结果,根据药效试验确定的初步提取工艺,选取药材浸泡时间(A)、料液比(B)、提取时间(C)、空白(D)为试验因素,每个因素选取3 个水平,设计正交试验(见表4),优选最佳提取工艺。 先将处方量比例的荆芥、金银花、柴胡、连翘提取芳香水,药渣和其他处方量比例的板蓝根、射干、甘草3味药材共同进行提取。以提取液浸膏得率、绿原酸及腺苷提取量为评价指标,采用综合评分法进行数据处理[13],权重系数浸膏得率为0.4,腺苷提取量和绿原酸提取量均为0.3。 正交试验结果见表5,方差分析见表6。

表6 提取工艺方差分析表
综合评分=(浸膏得率/浸膏得率最大值)×0.4+(腺苷提取量/腺苷提取量最大值)×0.3+(绿原酸提取量/绿原酸提取量最大值)×0.3。
由表5-6 可知,综合评分的影响大小顺序为B>C>A,其中B 对提取结果有显著性影响(P<0.05),综合直观分析和方差分析结果,A2B2C2组合为最优提取工艺;但C 因素影响无显著性(P>0.05),从大生产中节能考虑,C 因素选择C3,以A2B2C3组合为宜,即药材加水浸泡30 min 后,提取2 次,第1 次加10 倍量水提取1.5 h,第2 次加8 倍量水提取1.0 h。 另外,A2B2C3组合为正交实验实施例之一,其试验结果表明,该组合的评价指标浸膏得率、腺苷提取量和绿原酸提取量均为正交实验实施例中最优,故不考虑最佳提取工艺验证试验。

表5 正交试验表及结果
2.4 醇沉工艺考察
药效试验研究中发现,药液经低浓度醇沉(30%),活性没有减弱,且醇沉有部分沉淀析出。 因此,拟对提取液进行醇沉工艺考察,同时,需要综合考察醇沉工艺对后续口服液稀配、冷藏、过滤等工艺的影响。本研究考虑以醇沉液沉降、过滤情况,沉淀质量,制剂澄清度及绿原酸,腺苷转移率为评价指标,采用单因素考察方法,优选最佳醇沉浓度、醇沉时间,以获得最佳醇沉工艺。
2.4.1 醇沉样品制备 按最佳提取工艺制备提取液,减压浓缩至相对密度1.05~1.10 的清膏(60 ℃测),离心(2500 r/min,20 min,离心半径9.954 cm),取上清液300 mL,均分成3 份,分别加入乙醇至醇浓度为20%、30%、40%,搅拌均匀,静置冷藏(5~10 ℃),即得。
2.4.2 醇沉试验结果 于3、6、12 h 分别观察并记录各醇沉浓度溶液沉降情况,12 h 后取出,离心出沉淀,并干燥、称重。 离心液回收乙醇至无醇味,分别加入蔗糖25 g 使溶解,加入100 mL 芳香水,加水调整体积至250 mL,0.8 μm 微孔滤膜过滤,观察过滤效果,滤液置冰箱中冷藏48 h(5~10 ℃),观察澄清情况。 详见表7。
同时,取上清液按“2.2.1”和“2.2.2”项下方法测定腺苷和绿原酸含量,测定醇沉12 h 和稀配后冷藏48 h 溶液中腺苷和绿原酸含量,计算醇沉工艺过程中腺苷和绿原酸的转移率。 详见表7。

表7 醇沉浓度考察结果
结果显示,不同浓度乙醇在醇沉工艺中腺苷和绿原酸转移率差别不大,但样品经30%、40%醇沉能除掉部分大极性杂质,有助制剂澄清,30%、40%醇沉12 h,均可保证后续制剂的澄清;但从大生产中节能考虑,结合药效筛选结果,药液经30%醇沉活性最强;优选出醇沉工艺为醇沉前药液的相对密度为1.05~1.10(60 ℃测),离心(2500 r/min,20 min,离心半径9.954 cm),取上清液加入乙醇至醇浓度为30%,醇沉12 h。
2.5 工艺验证试验
根据蓝金口服液处方量称取各味药材共计3份,采用优选的最佳提取纯化工艺条件制备3 批蓝金口服液样品,测定浸膏得率[浸膏得率=干膏质量×稀释倍数/药材质量×100%],按“2.2.1”和“2.2.2”项下方法测定腺苷和绿原酸含量,并计算得到绿原酸及腺苷提取量,结果见表8。3 批样品所得浸膏得率、绿原酸及腺苷提取量RSD 值较小,表明该提取纯化工艺稳定可行。
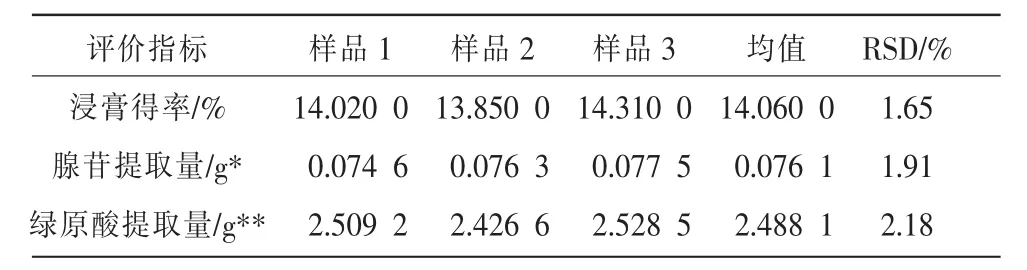
表8 工艺验证试验结果
3 讨论
开发高效、安全的中药复方制剂已经成为药学研究者们关注的重点。其中,中药复方制剂提取纯化工艺研究尤为重要,中药有效成分的提取纯化效率往往受到多种因素的影响,使得对提取纯化效果的评估较为困难,因此,运用科学的评价方法对中药有效成分的提取纯化工艺进行研究显得尤为关键。
蓝金口服液作为治疗风热表证型上呼吸道感染的中药复方制剂,处方中荆芥的挥发油类成分具有明显的抗炎、抗病毒活性[14-15],与其他适合水煎药材一起水煎易造成挥发油成分损失,因此,进行水煎之前需对荆芥挥发油先行水蒸气蒸馏提取。同时,处方中金银花、连翘、柴胡中也含有挥发油类成分,均为抗炎、抗病毒活性成分[16-18],也需考虑进行挥发油成分的水蒸气蒸馏提取。 因此,拟设计两种工艺条件:(1)荆芥单独提取挥发油;(2)荆芥、金银花、连翘、柴胡合并提取挥发油;再与其余诸药一起水提,并考虑提取药液的醇沉。
本研究采用干酵母致热大鼠模型对上述两种工艺进行了药效筛选,最终确定第2 种工艺所得样品的药物效应强度最优。 在药效筛选试验确定的提取工艺基础上,设计以腺苷、绿原酸的提取量和浸膏得率为评价指标,采用综合评分法进行数据处理,通过正交试验进一步优选蓝金口服液的最佳提取工艺。 基于药效筛选工艺确定提取次数为2 次,故选择浸泡时间、料液比、提取时间作为正交试验的考察因素。
醇沉工艺研究中,在药效筛选试验确定的纯化工艺基础上,以醇沉液沉降、过滤情况,沉淀质量,制剂澄清度及绿原酸,腺苷转移率为评价指标,采用单因素考察方法,进一步优选最佳醇沉工艺,同时综合考察了醇沉工艺对后续口服液稀配、冷藏、过滤等工艺的影响。 在后续的研究中,应补充考察醇沉温度、搅拌速度等因素对醇沉工艺的影响。
蓝金口服液处方中板蓝根为君药,应首选其有效成分作为工艺研究评价指标,《中华人民共和国药典》2020 年版一部板蓝根[4]214-215质量标准项下的含量测定指标为(R,S)-告依春,本实验发现,其水溶性差,很难转移到口服液中,不适合作为口服液的工艺评价指标。 现有研究表明,板蓝根的主要有效成分之一腺苷,具有抗炎、抗病毒作用,且具有较好的水溶性,能较好地转移到口服液中,故选取其作为工艺研究评价指标[19-20]。 金银花为臣药,《中华人民共和国药典》2020 年版一部金银花[4]230-232质量标准项下的含量测定指标之一为绿原酸,是其抗菌、抗病毒作用的主要有效成分,其具有较好的水溶性,能较好地转移到口服液中,故选取其作为另一工艺评价指标。上述评价指标结合浸膏得率,能较为全面地反映和控制提取液的内在质量。
本研究基于中药药理和中药化学相结合的中药研究思路,进行了提取纯化工艺条件的选择,避免仅以化学成分为评价指标造成的提取纯化工艺研究的片面性和局限性。 此工艺可行、稳定,为蓝金口服液的后续开发提供了可靠的实验依据。
