盐酸羟考酮负调控LncRNA LINC01857抑制宫颈癌细胞Siha增殖、迁移及侵袭
2020-11-09张秀双徐铭军车向明曹秀玲李晓光
张秀双 徐铭军 车向明 曹秀玲 李晓光
宫颈癌是威胁女性生命安全的恶性肿瘤之一,近年来,我国宫颈癌发病率逐年上升,已严重影响患者生活质量,临床常采用手术、放化疗结合等方式进行治疗[1]。丙泊酚可通过EGFR/JAK2/STAT3 途径增强顺铂诱导的宫颈癌细胞凋亡,可作为治疗宫颈癌的潜在药物[2]。丙泊酚通过抑制HOTAIR 而抑制宫颈癌细胞活力并促进细胞凋亡[3]。盐酸羟考酮是一种半合成的蒂巴因衍生物,属于麻醉药物,可明显减轻肿瘤患者疼痛感[4]。但盐酸羟考酮对宫颈癌细胞生物学行为的影响尚未阐明。特定的长链非编码RNA(LncRNA)在宫颈癌中表达异常,可调节细胞增殖、迁移及侵袭等生物学行为[5]。长链非编码RNA LINC01857(LncRNA LINC01857)在乳腺癌中表达水平升高,并可能发挥类癌基因作用[6]。但LINC01857 是否可作为盐酸羟考酮治疗宫颈癌的潜在靶点尚未阐明。因此,本研究主要探讨盐酸羟考酮联合LINC01857 对宫颈癌细胞Siha 增殖、迁移及侵袭的影响及其潜在作用机制,为进一步阐释盐酸羟考酮治疗宫颈癌的分子机制奠定实验基础。
1 材料与方法
1.1 材料与试剂
盐酸羟考酮购自北京华素制药股份有限公司;人宫颈癌细胞Siha 购自上海信裕生物科技有限公司;DMEM 培养基购自北京迈瑞达科技有限公司;胎牛血清购自上海传秋生物科技有限公司;Lipofectamine2000 购自上海北诺生物科技有限公司;si-NC、si-LINC01857 购自广州锐博生物科技有限公司;pcDNA、pcDNA-LINC01857 购自武汉淼灵生物科技有限公司;Trizol 试剂购自北京全式金生物技术有限公司;cDNA 合成试剂盒与qRT-PCR试剂盒购自北京天根生化科技有限公司;MTT 试剂购自北京索莱宝科技有限公司;Transwell 小室、Matrigel 基质胶购自上海泽迈生物技术有限公司;兔抗人E-cadherin、N-cadherin 抗体购自美国CST公司;HRP 标记的山羊抗兔二抗购自美国Abcam公司。
1.2 方法
1.2.1 实验分组Siha 细胞接种于96 孔板(5×103个/孔),分别加入含有不同浓度(20、40、60 μg/mL)的盐酸羟考酮的培养液培养24 h[7],分别记作盐酸羟考酮低剂量组、盐酸羟考酮中剂量组、盐酸羟考酮高剂量组。同时将正常培养的细胞作为对照组。参照Lipofectamine2000 试剂盒说明书分别将si-NC、si-LINC01857 转染至Siha 细胞,分别记作si-NC组、si-LINC01857组。分别将pcDNA、pcDNALINC01857 转染至Siha 细胞,加入含有60 μg/mL盐酸羟考酮的培养液培养24 h,分别记作盐酸羟考酮高剂量+pcDNA 组、盐酸羟考酮高剂量+pcDNA-LINC01857 组。
1.2.2 qRT-PCR检测细胞中LINC01857的表达水平采用Trizol 法提取Siha 细胞总RNA,应用Nanodrop2000c 超微量分光光度计检测RNA 浓度后置于-80℃超低温冰箱内保存,按照cDNA 合成试剂盒将总RNA 逆转录为cDNA,以cDNA 为模板进行qRT-PCR 反应,反应体系:10×PCR Buffer 2.5 μL,MgSO42.5 μL,dNTPs 2.5 μL,正反向引物各0.5 μL,cDNA 2 μL,RNase-Free ddH2O 补足体系至25 μL;反应条件:95℃2 min,95℃30 s,59℃30 s,72℃30 s,共36 次 循 环。应 用 罗 氏LightCycler480 荧光定量PCR 仪检测LINC01857(内参GAPDH)相对表达量。
1.2.3 MTT 检测细胞增殖
取对数生长期Siha 细胞(2.5×105个/mL)接种于96 孔板(100 μL/孔),按照“1.2.1”分组处理后加入MTT 溶液(20 μL/孔),继续培养4 h 后弃上清,加入DMSO(150 μL/孔),室温振荡孵育5 min 后应用酶标仪检测各孔光密度值(OD 值)。
1.2.4 平板克隆形成实验
取各组Siha 细胞接种于6 孔板(1×103个/孔),继续培养14 d 后弃旧培养基,加入预冷PBS 洗涤后加入甲醇(500 μL/孔),置于-20℃冰箱内孵育20 min,弃甲醇,加入1%结晶紫染色液染色(400 μL/孔,15 min),蒸馏水洗涤后晾干,观察克隆形成数。
1.2.5 Transwell 实验检测细胞迁移与侵袭
各组Siha 细胞(2.5×105个/mL)接种于上室(200 μL/孔),下室加入含有10%胎牛血清的培养液(600 μL/孔),继续培养24 h 后使用PBS 洗涤,分别加入多聚甲醛(20 min)与结晶紫染液(10 min),观察迁移细胞数。预冷培养基被用于稀释Matrigel 基质胶后加入上室(40 μL/孔),继续培养5 h,后续实验步骤同细胞迁移实验,观察侵袭细胞数。
1.2.6 Western blot 检测E-cadherin、N-cadherin 蛋白表达
各组Siha 细胞加入RIPA 裂解液提取细胞总蛋白(500 μL),使用BCA 试剂盒检测蛋白浓度,取蛋白样品进行SDS-PAGE,转膜、封闭,分别孵育一抗稀释液(1∶1 000,4℃孵育24 h)与二抗稀释液(1∶5 000,室温孵育1 h)后应用ImageJ 软件分析各条带灰度值。
1.3 统计学处理
采用SPSS 21.0 统计学软件分析数据,计量资料以(±s)表示且均符合正态分布,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,以P<0.05 为差异具有统计学意义。
2 结果
2.1 盐酸羟考酮对Siha 增殖及LINC01857 表达的影响
4 组LINC01857 的表达水平、OD 值、克隆形成数的比较结果显示:盐酸羟考酮低剂量组>盐酸羟考酮中剂量组>盐酸羟考酮高剂量组,差异有统计学意义(P<0.05)。见表1。
2.2 盐酸羟考酮对Siha 迁移、侵袭的影响
4 组N-cadherin、迁移细胞数(个)、侵袭细胞数(个)比较结果:盐酸羟考酮低剂量组>盐酸羟考酮中剂量组>盐酸羟考酮高剂量组;E-cadherin 结果比较:盐酸羟考酮低剂量组<盐酸羟考酮中剂量组<盐酸羟考酮高剂量组,差异有统计学意义(P<0.05)。见图1、表2。
表1 盐酸羟考酮对Siha 细胞活性、克隆形成及LINC01857 表达的影响(±s,n=3)Table 1 Effects of oxycodone hydrochloride on the activity,clone formation and LINC01857 expression of SiHa cells(±s,n=3)
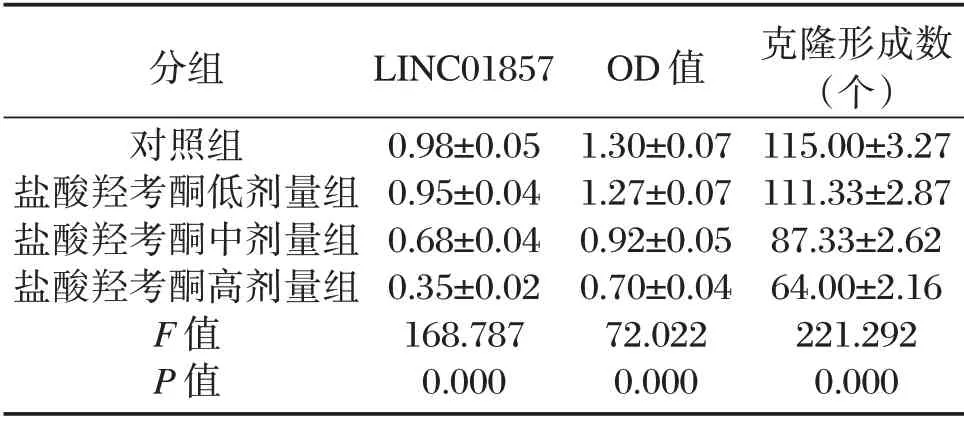
表1 盐酸羟考酮对Siha 细胞活性、克隆形成及LINC01857 表达的影响(±s,n=3)Table 1 Effects of oxycodone hydrochloride on the activity,clone formation and LINC01857 expression of SiHa cells(±s,n=3)
分组对照组盐酸羟考酮低剂量组盐酸羟考酮中剂量组盐酸羟考酮高剂量组F 值P 值LINC01857 0.98±0.05 0.95±0.04 0.68±0.04 0.35±0.02 168.787 0.000 OD 值1.30±0.07 1.27±0.07 0.92±0.05 0.70±0.04 72.022 0.000克隆形成数(个)115.00±3.27 111.33±2.87 87.33±2.62 64.00±2.16 221.292 0.000
2.3 干扰LINC01857 对Siha 增殖、迁移、侵袭的影响
与si-NC 组比较,si-LINC01857 组OD 值降低,克隆形成数减少,迁移及侵袭细胞数减少,N-cadherin 蛋白水平降低,差异有统计学意义(P<0.05),E-cadherin 蛋白水平升高差异有统计学意义(P<0.05),见表3、图2。
表2 盐酸羟考酮对Siha 迁移侵袭的影响(±s)Table 2 Effect of oxycodone hydrochloride on migration and invasion of SiHa(±s)

表2 盐酸羟考酮对Siha 迁移侵袭的影响(±s)Table 2 Effect of oxycodone hydrochloride on migration and invasion of SiHa(±s)
分组对照组盐酸羟考酮低剂量组盐酸羟考酮中剂量组盐酸羟考酮高剂量组F 值P 值n3333 E-cadherin 0.18±0.01 0.19±0.01 0.37±0.02 0.64±0.04 252.545 0.000 N-cadherin 0.68±0.04 0.66±0.04 0.39±0.03 0.25±0.02 117.778 0.000迁移细胞数(个)235.33±4.19 230.67±4.71 194.33±3.86 152.00±3.27 274.717 0.000侵袭细胞数(个)135.33±4.19 131.67±3.77 98.00±2.45 70.67±2.05 266.580 0.000
表3 干扰LINC01857 对Siha 增殖迁移侵袭的影响(±s)Table 3 Effects of interference with LINC01857 on proliferation,migration and invasion of SiHa(±s)

表3 干扰LINC01857 对Siha 增殖迁移侵袭的影响(±s)Table 3 Effects of interference with LINC01857 on proliferation,migration and invasion of SiHa(±s)
分组si-NC si-LINC01857 t 值P 值n33 LINC01857 0.99±0.05 0.19±0.02 25.731 0.000 E-cadherin 0.17±0.01 0.73±0.04 23.525 0.000 N-cadherin 0.69±0.04 0.14±0.01 23.105 0.000 OD 值1.32±0.08 0.54±0.03 15.812 0.000克隆形成数(个)117.00±3.27 54.33±2.05 28.125 0.000迁移细胞数(个)236.33±4.03 127.67±2.49 39.729 0.000侵袭细胞数(个)137.33±4.11 61.33±2.87 26.260 0.000
2.4 过表达LINC01857 能减轻盐酸羟考酮对Siha增殖的影响
与盐酸羟考酮高剂量+pcDNA 组比较,盐酸羟考酮高剂量+pcDNA-LINC01857 组OD 值升高,克隆形成数增多,差异有统计学意义(P<0.05),见表4。
2.5 过表达LINC01857 能减轻盐酸羟考酮对Siha迁移、侵袭的影响
与盐酸羟考酮高剂量+pcDNA 组比较,盐酸羟考酮高剂量+pcDNA-LINC01857 组迁移及侵袭细胞数增多,E-cadherin 蛋白水平降低,N-cadherin蛋白水平升高,差异有统计学意义(P<0.05),见图3、表5。
3 讨论
丙泊酚通过激活AMPK 及促进内质网应激而抑制宫颈癌细胞增殖及促进细胞凋亡[8]。利多卡因通过调节LncRNA-MEG3/miR-421/BTG1 途径抑制宫颈癌细胞增殖并诱导细胞凋亡[9]。麻醉药物可调控宫颈癌等肿瘤细胞增殖、分化等生物学过程,但关于其作用机制尚未阐明[10]。因而本研究积极探寻麻醉药物对宫颈癌细胞生物学行为的影响及其可能作用机制,为提高宫颈癌治疗效果及改善患者预后提供新方向。
表4 过表达LINC01857 能减轻盐酸羟考酮对Siha 增殖的抑制作用(±s,n=3)Table 4 Overexpression of LINC01857 can reduce the inhibitory effect of oxycodone hydrochloride on the proliferation of SiHa(±s,n=3)

表4 过表达LINC01857 能减轻盐酸羟考酮对Siha 增殖的抑制作用(±s,n=3)Table 4 Overexpression of LINC01857 can reduce the inhibitory effect of oxycodone hydrochloride on the proliferation of SiHa(±s,n=3)
分组盐酸羟考酮高剂量+pcDNA盐酸羟考酮高剂量+pcDNA-LINC01857 t 值P 值LINC01857 0.34±0.02 0.89±0.05 17.690 0.000 OD 值0.71±0.03 1.13±0.07 9.552 0.000克隆形成数(个)65.00±2.45 104.67±3.30 16.718 0.000
表5 过表达LINC01857 能减轻盐酸羟考酮对Siha 迁移、侵袭的抑制作用(±s)Table 5 overexpression of LINC01857 can reduce the inhibition of oxycodone hydrochloride on migration and invasion of SiHa(±s)

表5 过表达LINC01857 能减轻盐酸羟考酮对Siha 迁移、侵袭的抑制作用(±s)Table 5 overexpression of LINC01857 can reduce the inhibition of oxycodone hydrochloride on migration and invasion of SiHa(±s)
分组盐酸羟考酮高剂量+pcDNA盐酸羟考酮高剂量+pcDNA-LINC01857 t 值P 值n33 E-cadherin 0.62±0.04 0.26±0.02 13.943 0.000 N-cadherin 0.25±0.02 0.53±0.04 10.844 0.000迁移细胞数(个)151.33±3.86 221.67±4.19 21.385 0.000侵袭细胞数(个)71.00±2.16 118.67±3.86 18.667 0.000
羟考酮是一种阿片类药物,用于治疗癌症患者的疼痛,关于羟考酮对癌细胞的作用知之甚少[11-13]。本研究结果显示,不同剂量的盐酸羟考酮处理后可降低宫颈癌细胞活力,减少克隆形成数、迁移及侵袭细胞数,并可促进E-cadherin 的表达及抑制N-cadherin 的表达,且呈剂量依赖性。研究表明E-cadherin 与N-cadherin 属于上皮-间质转化(EMT)的标志物,E-cadherin 表达水平升高可抑制EMT 转化,而N-cadherin 表达水平升高可促进EMT 转化,EMT 转化后可促进肿瘤细胞转移[14]。提示盐酸羟考酮可抑制宫颈癌细胞增殖、迁移及侵袭,其作用机制可能与调控EMT 转化有关。
本研究结果显示,不同剂量的盐酸羟考酮处理后可明显降低LINC01857 的表达水平,且呈剂量依赖性。研究表明LINC01857 在胰腺癌中表达水平升高,并可能作为诊断胰腺癌的潜在生物标志物[15]。LINC01857 通过调节miR-1281/TRIM65 轴促进神经胶质瘤的生长、迁移和侵袭[16]。LINC01857 通过调节miR-200b 促进胃癌的发展[17]。提示盐酸羟考酮可能通过下调LINC01857 的表达从而发挥作用。本研究结果提示干扰LINC01857 表达可降低宫颈癌细胞增殖、迁移及侵袭能力。
综上所述,盐酸羟考酮通过下调LINC01857的表达从而抑制宫颈癌细胞增殖、迁移及侵袭,LINC01857 可能作为宫颈癌治疗的潜在靶点,还可为进一步揭示盐酸羟考酮抗宫颈癌的分子机制奠定实验基础。