一测多评法同时测定青皮中5 种成分的含量
2022-12-25邝敏贤潘弟仪陈用年刘少君
邝敏贤,潘弟仪,陈用年,刘少君
广州中医药大学第三附属医院,广东 广州 510360
青皮为芸香科植物橘Citrus reticulataBlanco 及其栽培变种的干燥幼果或未成熟果实的果皮。《中国药典》2020 年版将青皮分为“个青皮”和“四花青皮”两种不同的规格[1-2]。自然掉落于5~6 月的幼果,采集晾干后,俗称“个青皮”;采摘于7~8月份未成熟的果实,在果皮上纵剖成4 瓣至基部,切去瓤,干燥后,被称为“四花青皮”。青皮味苦、辛,性温,具有破气行痰、消痞除满、理气健脾、燥湿化痰等功效,用于治疗胸胁胀痛、疝气疼痛、乳癖、乳痈、食积气滞、脘腹胀痛等病症[3]。如广州中医药大学第三附属医院(以下简称我院)中医外科,医师多利用青皮破气、消痞等功效来治疗妇人乳腺方面的疾病。现代药理研究表明,青皮具有去痰平喘、利胆、调节肠胃功能、抗休克、抗病毒、抗肿瘤及抗氧化等活性[4-6]。青皮主要含有挥发油、黄酮类和生物碱类等成分,其中黄酮类成分主要为橙皮苷、芸香柚皮苷、橘皮素等,是其有效成分。2020 年版《中国药典》一部青皮项下只将橙皮苷作为指标成分,用于对其进行品质的控制[1]。目前国家公示的青皮配方颗粒国家标准中,在特征图谱项下规定了辛弗林、芸香柚皮苷、橘皮素等7个特征峰。说明青皮中至少含有这7 个成分。
一测多评法(QAMS)确定其他成分与内参照物间的相对校正因子(RCF),利用内参照物含量和RCF 可以通过计算得到其他成分的含量,实现对中药材中多个成分的含量结果的同时测定,QAMS 已逐渐应用于中药材和中成药制剂的质量控制中[7-9]。本研究通过建立QAMS,以橙皮苷为内参照物,同时测定青皮中辛弗林、芸香柚皮苷、川陈皮素、橘皮素5 种化学成分的含量,以期进一步优化青皮药材的质量标准,为我院采购和验收青皮药材或饮片及后续院内制剂研究提供参考。
1 仪器与试药
1.1 仪器
Agilent 1260 型超高效液相色谱仪(安捷伦);Waters Acquity 型超高效液相色谱仪(沃特世);Eco-S15 实验室纯水系统(上海和泰仪器);Quintix系列分析天平(赛多利斯科学仪器);SHZ-D(III)型循环水式真空泵;HH-S2 型数显恒温水浴锅。
1.2 试药
橙皮苷(批号:110721-201818,纯度96.2%),辛弗林(批号:110727-201809,纯度99.5%)购自中国食品药品检定研究院。芸香柚皮苷(批号:wkq19041908,纯度≥98%),川陈皮素(批号:wkq20031701,纯度≥98%)购自四川维克奇生物科技有限公司。橘皮素(批号:151021,纯度98%以上)来自成都普菲德生物技术。甲醇、乙腈等纯度为色谱纯(Merck 公司);甲酸购自天津市科密欧化学试剂有限公司,色谱纯;水使用超纯水,其他试剂纯度为分析纯。10 批青皮药材均符合2020 年版《中国药典》一部青皮项下相关规定。
2 方法与结果
2.1 色谱条件[3]
色谱柱:Agilent ZORBAX SB-C18(100 mm×2.1 mm,1.8 μm);以乙腈(A)-0.1%甲酸溶液(B)梯度洗脱(0~2 min,1%→8% A;2~5 min,8%→13% A;5~12 min,13%→19% A;12~13 min,19%→22% A;13~20 min,22%→35% A;20~21 min,35%→51% A;21~30 min,51%→54% A;30~31 min,54%→1% A;31~35 min,1% A);流速:0.3 mL/min;柱温:40 ℃;检测波长:275 nm;进样量:1 μL。
2.2 对照品溶液的配制
精密称取辛弗林、芸香柚皮苷、橙皮苷、川陈皮素和橘皮素对照品适量,置20 mL 量瓶中,加10%甲醇溶解并定容,摇匀,配制成质量浓度分别为540.261 6、23.417 6、53.277 5、21.196 3、17.751 2 μg/mL 的混合对照品溶液。
2.3 供试品溶液的制备
取青皮药材细粉约0.2 g,精密称定,置具塞锥形瓶中,精密加入10%甲醇50 mL,称定重量,加热回流30 min,取出,放冷,再次称定重量,用10%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.4 方法学考察
2.4.1 专属性试验 分别精密吸取空白溶剂、混合对照品溶液及供试品溶液,按“2.1”项下色谱条件进样测定。结果显示,供试品溶液色谱中,在与混合对照品溶液色谱相同保留时间处有相应色谱峰,且空白溶剂无干扰,表明该方法专属性良好。
2.4.2 线性关系考察 精密吸取“2.2”项下混合对照品溶液,加10%甲醇稀释成系列质量浓度的混合对照品溶液,按“2.1”项下色谱条件依次进样测定,记录色谱图。以对照品的质量浓度(μg/mL)为横坐标(X),以峰面积为纵坐标(Y),绘制标准曲线,进行线性回归,得到各待测组分的回归方程及线性范围见表1。可知5 个成分于相应质量浓度范围内线性关系良好。
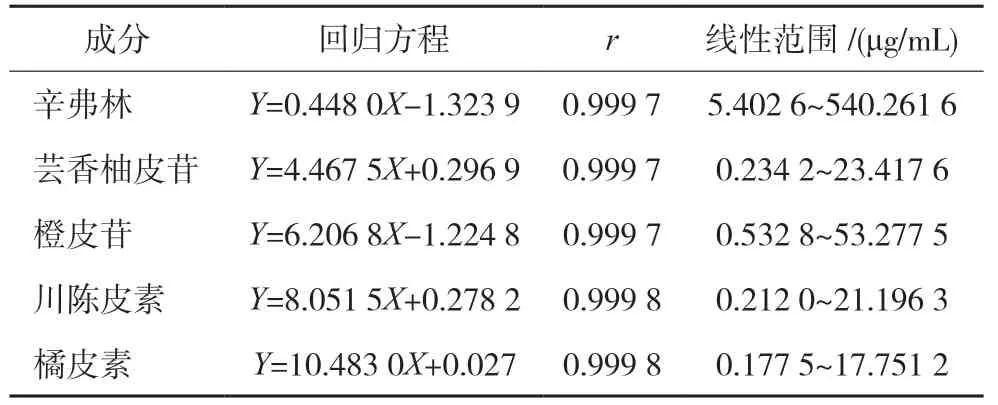
表1 线性关系考察结果
2.4.3 精密度试验 精密吸取“2.2”项下混合对照品溶液,按“2.1”项下的色谱条件连续进样6 次,计算得辛弗林、芸香柚皮苷、橙皮苷、川陈皮素、橘皮素色谱峰峰面积的RSD 分别为0.73%、0.76%、0.46%、0.32%、0.30%,表明仪器的精密度良好。

图1 专属性考察UPLC色谱图:A.空白溶剂;B.供试品溶液;C.混合对照品溶液
2.4.4 重复性试验 取青皮样品适量,精密称定,按“2.3”项下方法平行制备6 份供试品溶液,按“2.1”项下的色谱条件进样测定,计算得辛弗林、芸香柚皮苷、橙皮苷、川陈皮素、橘皮素色谱峰峰面积的RSD 分别为1.28%、1.40%、0.46%、1.74%、2.06%,表明该方法的重复性良好。
2.4.5 稳定性试验 取青皮样品适量,精密称定,按“2.3”项下方法制备供试品溶液,按“2.1”项下的色谱条件,分别在0、2 h、4 h、8 h、12 h、24 h 进样进行测定,计算得辛弗林、芸香柚皮苷、橙皮苷、川陈皮素、橘皮素色谱峰峰面积的RSD 分别为1.75%、2.48%、1.00%、1.50%、1.08%,表明供试品溶液在24 h 内稳定性。
2.4.6 加样回收率试验 取同一批次成分含量已知的青皮样品9 份,每份取约0.1 g,分为3 组,每组分别按高、中、低浓度精密加入混合对照品溶液。按“2.3”项下的方法制备得到供试品溶液,按“2.1”项下的色谱条件进样进行测定,记录各自峰面积,计算各成分的加样回收率及对应的RSD。结果见表2,辛弗林、芸香柚皮苷、橙皮苷、川陈皮素、橘皮素的平均回收率及RSD 分别为101.05%(RSD 2.82%)、96.01%(RSD 2.92%)、96.93%(RSD 1.73%)、94.01%(RSD 2.78%)、103.86%(RSD 2.00%)。表明该方法准确度良好。

表2 青皮中5种成分的加样回收率试验结果

表2 (续)
2.5 相对校正因子的确定[10-11]
精密吸取“2.4.2”项下的混合对照品溶液,按“2.1”项下的色谱条件进样进行测定,以橙皮苷为内参照物,以各自的峰面积和质量浓度,代入公式计算,得其余4 种成分的相对校正因子(fs/k),公式为fs/k=fs/fk=(As×Ck)/(Ak×Cs),其中As为 内参照物峰面积,Cs为内参照物质量浓度,Ak为待测成分峰面积,Ck为待测成分质量浓度,结果见表3。

表3 各成分相对校正因子
2.6 耐用性和系统适应性研究
2.6.1 不同品牌色谱仪器及色谱柱对相对校正因子的影响[12]以橙皮苷为内参照物,考察其他4 种成分在Agilent 1260 型、Waters Acquity 型两种高效液相色谱系统,以及沃特世ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm),安捷伦ZORBAX SB-C18(2.1 mm×100 mm,1.8 μm),YMC Triart C18(2.1 mm×100 mm,1.9 μm)等三种色谱柱下的相对校正因子(RCF),结果见表4,表明不同色谱系统和色谱柱对各成分RCF 无显著影响。
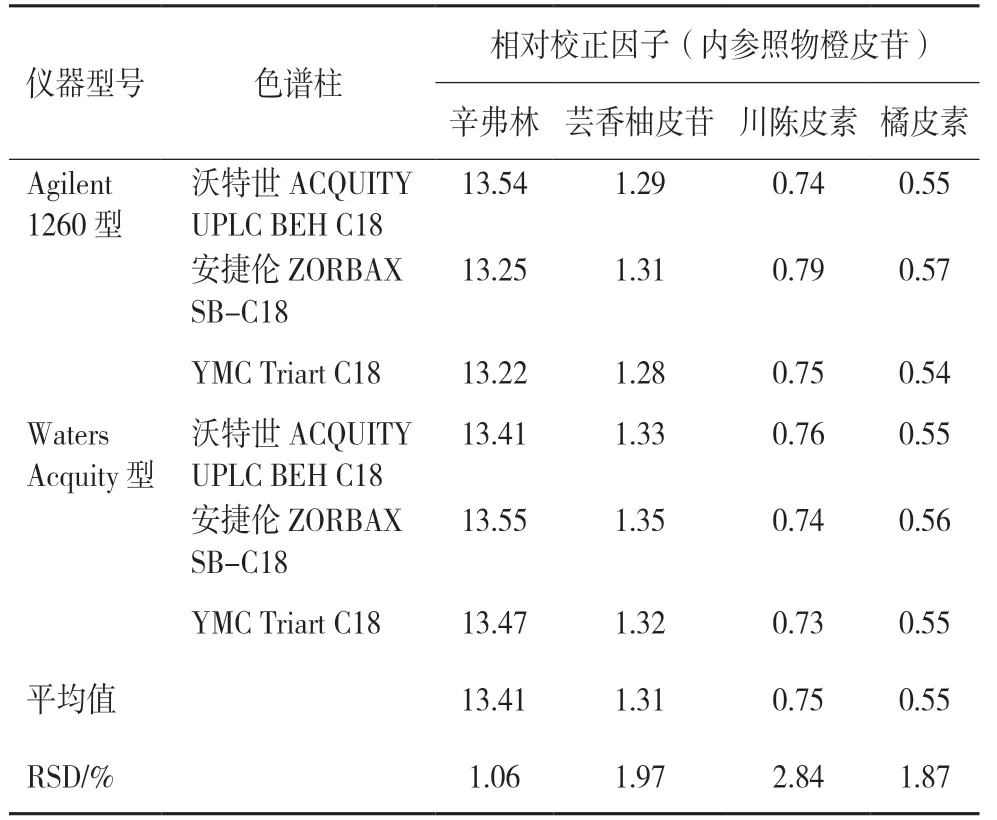
表4 不同品牌色谱仪、色谱柱对相对校正因子的影响
2.6.2 不同柱温对相对校正因子的影响[12]采用Agilent 1260 型高效液相色谱仪、安捷伦ZORBAX SB-C18 色谱柱,考察柱温设定为25、30、35、40 ℃下对每种成分的相对校正因子的影响,结果见表5,不同柱温条件下4 种成分的RSD 分别为1.48%、1.70%、2.54%、2.62%,均小于3%,表明柱温对4 种成分相对校正因子无显著影响。

表5 不同柱温对相对校正因子的影响
2.6.3 不同流速对相对校正因子的影响[12]采用Agilent 1260 型高效液相色谱仪、安捷伦 ZORBAX SB-C18 色谱柱,考察流速0.2、0.3、0.4 mL/min 对4 种成分相对校正因子的影响,结果见表6,不同流速条件下4 种成分的RSD 分别为0.94%、1.17%、1.32%、2.76%,表明不同流速对各成分相对校正因子无显著影响。

表6 不同流速对相对校正因子的影响
2.6.4 不同进样体积对相对校正因子的影响[12]采用Agilent 1260 型高效液相色谱仪、安捷伦 ZORBAX SB-C18色谱柱,考察进样体积0.5、1.0、1.5、2.0、2.5、3.0 μL 对4 种成分相对校正因子的影响,结果见表7,各成分的RSD 分别为0.88%、2.35%、2.55%、1.80%,表明进样体积的波动对各成分相对校正因子无显著影响。

表7 不同进样体积对相对校正因子的影响
2.7 待测成分色谱峰的定位[13]
在一测多评的运用中,能否在不同色谱体系中对待测组分的色谱峰进行准确定位是关键,目前常用的色谱峰定位方法有相对保留值法、保留时间差法、时间校正法等。相对保留值法计算公式:ti/s=ti/ts。ti为待测组分保留时间,ts为内参照物保留时间。本实验采用相对保留时间进行待测组分色谱峰的定位,以橙皮苷为内参照物,考察其他4 种成分在Agilent 1260 型和Waters Acquity 型两种高效液相色谱系统,以及3 根不同厂家的色谱柱(Waters ACQUITY UPLC BEH C18、Agilent ZORBAX SBC18、YMC Triart C18)的相对保留时间。结果见表8,采用相对保留值法各成分的RSD 均小于3%,表明采用相对保留值法对待测成分的定位是可行的。
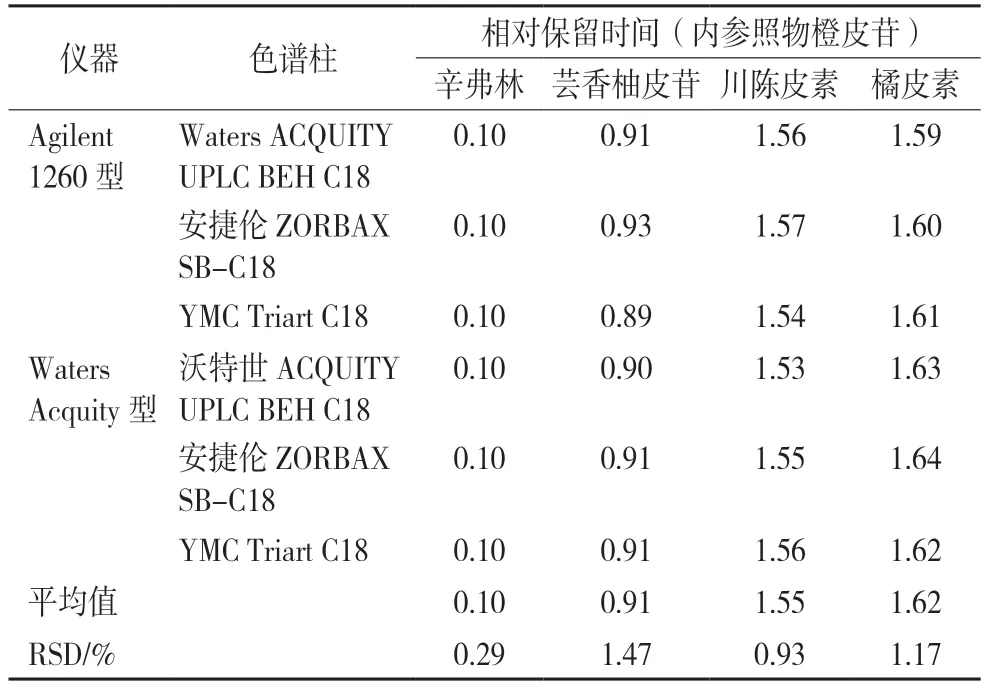
表8 各成分相对保留时间
2.8 一测多评法与外标法测定结果比较
取10 批青皮适量,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,分别采用外标法(ESM)和QAMS 测定5 种成分的含量,利用SPSS 26.0 软件对两组检测结果进行配对t 检验及Pearson 相关性分析。结果见表9,两种方法之间的相关系数r均为1.00,表明两种方法测定结果具有高相关性,且两种方法测定结果无显著性差异(P>0.05),建立的一测多评法具有较好的可信度。

表9 外标法与一测多评测定结果比较
3 讨论
本研究对供试品溶液的提取方式(超声法、回流法),提取溶剂(10%乙醇、20%乙醇、50%乙醇、10%甲醇、20%甲醇、50%甲醇),提取时间(30、45、60 min)和稀释体积(20、50、100 mL)进行了考察。结果表明,按“2.3”项下的方法制备得到供试品溶液时色谱峰的峰面积和分离度均较好。在210~400 nm 内对供试品溶液进行扫描,发现在275 nm 时色谱图基线平稳、噪声小,各组分的响应值较高,因此,选择275 nm 作为检测波长。
目前,对青皮的研究主要集中于不同产地、不同规格等方面[3,14-15]。本次实验以我院的常用药材青皮为研究对象,希望能同时测定青皮含有的5 种黄酮类成分。引入一测多评法,实验过程中对测定方法进行方法学考察,比较不同成分的峰面积和质量浓度得到4 种成分与橙皮苷的相对校正因子,还使用外标法来验证了本实验建立的一测多评法的准确性,从而考察一测多评法在青皮5 种黄酮类成分的含量测定上是否具有可行性和可操作性。
结果表明,使用QAMS 测得的青皮5 种黄酮类成分的含量与外标法测定结果没有明显差异,证明建立的一测多评法可行,具有较好的稳定性和准确性。此方法的建立,可使青皮药材从单一成分测定升级为更多成分测定,为更全面地评价青皮药材质量提供了方法。该方法的建立,能大大提高测定速度和降低测定成本,为我院在采购及验收青皮药材或饮片质量控制提供参考。
