小麦茎基腐病生防菌HB-081的鉴定及抑菌活性
2022-12-23张强王胜光吴利民姜志龙孟洁陆宁海
张强,王胜光,吴利民,姜志龙,孟洁,陆宁海
(河南科技学院 资源与环境学院,河南 新乡 453003)
由假禾谷镰刀菌(Fusarium pseudograminearum)为主要病原侵染引起的小麦茎基腐病,在我国河南、陕西等小麦产区普遍发生,已成为严重威胁我国小麦生产的重要病害[1-4].病原菌在小麦的不同生长阶段都能产生危害,可以使茎基部变褐坏死,严重时导致死苗或后期出现白穗[5].小麦茎基腐病在造成产量损失的同时,病原菌产生的镰刀菌毒素还可以在小麦中积累,严重影响粮食及饲料品质[6-7].
目前,小麦茎基腐病主要采用农业和化学相结合的防治策略[3,7].与化学防治相比,对环境友好的生物防治也成为防治小麦茎基腐病的重要措施[8].隋丽娜[9]研究发现深绿木霉(Trichoderma atroviride)HB20111对假禾谷镰刀菌有较强的抑制作用,并且进行拌种后可以有效降低小麦茎基腐病的发生.灰略红链霉菌(Streptomyces griseorubens 21-3)对假禾谷镰刀菌的生长具有一定的拮抗作用[10].张洁等[11]发现枯草芽孢杆菌(Bacillus subtilis)YB-05 不仅能够抑制假禾谷镰刀菌,而且与申嗪霉素复配可以起到更好的防病效果.解淀粉芽孢杆菌(Bacillus amyloliquefaciens)YB-161 对小麦茎基腐病也具有良好的防治效果[12].但是,对小麦茎基腐病生物防治的相关研究依然较少.本研究以假禾谷镰刀菌为靶标菌,从女贞叶片中分离筛选出具有较好拮抗能力的内生细菌,对优良拮抗菌株进行鉴定的同时,评价其对小麦茎基腐病的防治效果,以期为小麦茎基腐病的生物防治提供菌种资源及理论基础.
1 材料与方法
1.1 试验材料
菌株:链格孢菌(Alternaria alternata)、果生炭疽菌(Colletotrichum fructicola)、胶孢炭疽菌(C. gloeosporioides)、甜樱间座壳菌(Diaporthe eres)、大斑突脐蠕孢菌(Exserohilum turcicum)、禾谷镰刀菌(Fusarium graminearum)、尖孢镰刀菌(F. oxysporum)、层出镰刀菌(F. proliferatum)、假禾谷镰刀菌(F. pseudograminearum)、美澳型核果褐腐菌(Monilinia fructicola)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)HB-081 均由河南科技学院资源与环境学院植物病理学实验室分离、保存.
小麦:百农4199,河南科技学院小麦研究中心提供.
PDA 培养基:马铃薯200.0 g、葡萄糖20.0 g、琼脂粉15.0 g、蒸馏水1 L.
LB 液体培养基:胰蛋白胨10.0 g、酵母粉5.0 g、NaCl 10.0 g、蒸馏水1 L.
LB 液体培养基中加入15.0 g/L 琼脂粉为LB 固体培养基.
CMC 培养基:羟甲基纤维素钠15.0 g、酵母提取物1.0 g、MgSO4·7H2O0.5 g、NH4NO31.0 g、KH2PO41.0 g、蒸馏水1 L.
YEPD 液体培养基:酵母提取物3.0 g、葡萄糖20.0 g、蛋白胨10.0 g、蒸馏水1 L.
1.2 生防细菌的分离与筛选
2021年9 月于河南科技学院校园内采集女贞叶片,用自来水冲洗干净,称取2.0 g 后剪成2~3 cm 大小,浸入体积分数为75%的酒精中2 min,取出后再用质量分数为10%次氯酸钠浸泡1 min.无菌水冲洗3次后,用无菌剪刀剪碎并加入10 mL 无菌水研磨至匀浆.静置15 min 后,取上清液按10-1~10-5梯度稀释,各取0.1 mL 涂布于LB 固体培养基,每个浓度设置3 个重复,28 ℃培养3~5 d 后,挑取单菌落纯化培养.
以假禾谷镰刀菌为靶标, 用直径5 mm 打孔器在培养3 d 的假禾谷镰刀菌的菌落边缘打取菌饼,接于PDA 平板中央,采用平板对峙法将分离获得的细菌4 点对称接种在距平板中心2.5 cm 处,以只接种假禾谷镰刀菌为对照,每个处理重复3 次.28 ℃下培养5 d 左右,待对照即将长满培养皿时,计算抑菌率
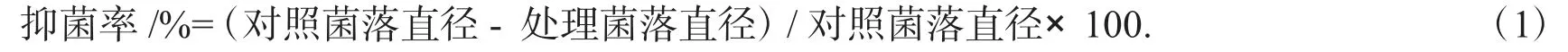
1.3 菌株HB-081 的鉴定
1.3.1 形态学鉴定将菌株HB-081 划线接种于LB 培养基,28 ℃下培养2 d,对菌落形态进行观察.经革兰氏染色后,在光学显微镜下对菌体形态进行观察.
1.3.2 生理生化鉴定参考《常见细菌系统鉴定手册》[13],对菌株HB-081 进行碳源利用、淀粉水解、纤维素利用、明胶液化、V-P、H2S、耐盐性等试验,每个试验重复3 次.
1.3.3 分子生物学鉴定利用细菌基因组DNA 提取试剂盒提取菌株HB-081 的基因组DNA.采用通用引物27 F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492 R(5'-GGCTACCTTGTTACGACTT-3')、7237 F(5'-CAGTCAGGAAATGCGTACGTCC-3')和8261 R(5'-CAAGGTAATGCTCCAGGCATTG-3')分别对16S rRNA 及gyrA 基因序列进行PCR 扩增[14-15].PCR 反应体系为:2×Taq PCR Mix 12.5 μL、27 F/7237 F(10 μmol/L)1.0 μL、1492 R/8261 R(10 μmol/L)1.0 μL,DNA 模板1.0 μL,ddH2O 9.5 μL.PCR 反应条件为:95 ℃预变性3 min;94 ℃变性30 s,57 ℃退火30 s,72℃延伸2 min,30 个循环;72 ℃终延伸5 min.PCR 扩增产物在质量分数为1%琼脂糖凝胶中进行电泳检测, 扩增成功后的产物送生工生物工程(上海)股份有限公司进行纯化测序.将所得序列在NCBI 数据库中进行BLAST 比对,并提交GenBank 以获取登录号.利用Mega 7.0 软件采用邻接法构建系统发育树,1 000 次重复检验,以确定菌株的分类地位.
1.4 对假禾谷镰刀菌菌落生长的抑制作用
挑取菌株HB-081 菌体于LB 液体培养基中,28 ℃、180 r/min 条件下培养24 h,再按照2%接种量置于新的LB 液体培养基中,28 ℃、180 r/min 条件下培养48 h,以获得发酵液.收集发酵液后,于12 000 r/min离心20 min,再将上清液用0.22 μm 微孔滤膜过滤,进而获得无菌发酵液.
将菌株HB-081 无菌发酵液,按照10%体积分数处理并冷却至60 ℃的PDA 培养基混合倒板,培养基凝固后在平板中心接入5 mm 的假禾谷镰刀菌菌饼,以不加无菌发酵液的PDA 培养基为对照,每个处理重复3 次.28 ℃下培养5 d 左右,待对照即将长满培养皿时,按照1.2.2 的方法计算抑菌率.
1.5 对假禾谷镰刀菌菌丝形态及孢子萌发的抑制作用
挑取适量新鲜假禾谷镰刀菌菌丝体于YEPD 培养基中,同时分别按照10%、20%及50%体积分数加入菌株HB-081 无菌发酵液,以只接种假禾谷镰刀菌为对照,每个处理重复3 次.28 ℃、150 r/min 条件下培养12 h,然后在光学显微镜下对假禾谷镰刀菌的菌丝形态进行观察.
将假禾谷镰刀菌菌块接种于CMC 培养基中,28 ℃、150 r/min 条件下培养3~5 d,用双层滤布过滤以去除菌丝,滤液3 500 r/min 离心10 min 后收集孢子,用YEPD 液体培养基重悬浮,并调整孢子悬浮液浓度为1×106个/mL.在孢子悬浮液中,分别按照10%、20%及50%体积分数加入菌株HB-081 无菌发酵液,以不加无菌发酵液为对照,每个处理重复3 次.28 ℃、150 r/min 条件下培养12 h,利用光学显微镜对孢子萌发情况进行观察与统计,计算萌发率和抑制率

1.6 对假禾谷镰刀菌的抑制作用
分别将菌株HB-081 发酵液及无菌发酵液各0.1 mL 均匀涂布于PDA 培养基,再将5 mm 的假禾谷镰刀菌菌饼接种于PDA 培养皿中心,然后将2 个培养皿对扣.以只接种假禾谷镰刀菌为对照,每个处理重复3 次.28 ℃下培养5 d 左右,待对照即将长满培养皿时,按照1.2.2 的方法计算抑菌率.
1.7 对小麦茎基腐病防效的测定
小麦种子加水浸泡过夜后,121 ℃灭菌30 min, 然后接入新鲜的假禾谷镰刀菌菌块,28 ℃下培养7~10 d,期间每天摇瓶一次,从而获得接种用病麦粒.挑选颗粒饱满的小麦种子,表面消毒后用菌株HB-081发酵液浸种12 h,之后播种到塑料盆钵中(口径为15 cm),每盆20 粒种子,以清水和12.5%质量分数的烯唑醇可湿性粉剂(江苏剑牌农化股份有限公司)拌种为对照,每处理重复3 次.光周期为14 L∶10 D,25 ℃条件下培养.待小麦长到1 叶1 心时,在小麦茎基部埋入病麦粒,每株一粒并覆土,30 d 后参照潘娅梅等[16]的方法对小麦茎基腐病的发病情况进行调查,并计算病情指数和防治效果

1.8 抑菌谱的测定
参考1.2.2 的方法,采用平板对峙的方式分析菌株HB-081 对链格孢菌、果生炭疽菌、胶孢炭疽菌、甜樱间座壳菌、大斑突脐蠕孢菌、禾谷镰刀菌、尖孢镰刀菌、层出镰刀菌、美澳型核果褐腐菌等9 种植物病原真菌的拮抗作用,每个处理重复3 次.28 ℃培养5 d 左右,按照1.2.2 的方法计算抑菌率.
1.9 数据分析
采用Excel 2016 和SPSS 软件对试验数据进行统计分析,用Duncan 氏新复极差法进行差异显著性检验.
2 结果与分析
2.1 对假禾谷镰刀菌的抑制作用
菌株HB-081 对假禾谷镰刀菌的抑制作用如图1所示.

图1 菌株HB-081 对假禾谷镰刀菌的抑制作用Fig.1 Inhibitory effects of strain HB-081 against Fusarium pseudograminearum
由图1中1-b 可以看出,菌株HB-081 能够明显抑制假禾谷镰刀菌的菌落生长,抑菌率为61.86%±0.56%.由图1-c 可以看出,菌株HB-081 在LB 培养基中培养后,获得的无菌发酵液对假禾谷镰刀菌的生长同样具有明显的抑制能力,抑菌率为41.81%±0.94%.
2.2 菌株HB-081 的鉴定
2.2.1 形态学及生理生化特征菌株HB-081 在LB 培养基上的形态特征如图2所示.

图2 菌株HB-081 的形态学特征Fig.2 Morphological characteristics of strain HB-081
由图2可以看出,菌株HB-081 菌落为白色,表面粗糙,边缘不整齐.菌体杆状,革兰氏染色阳性.菌株HB-081 的生理生化特征见表1.
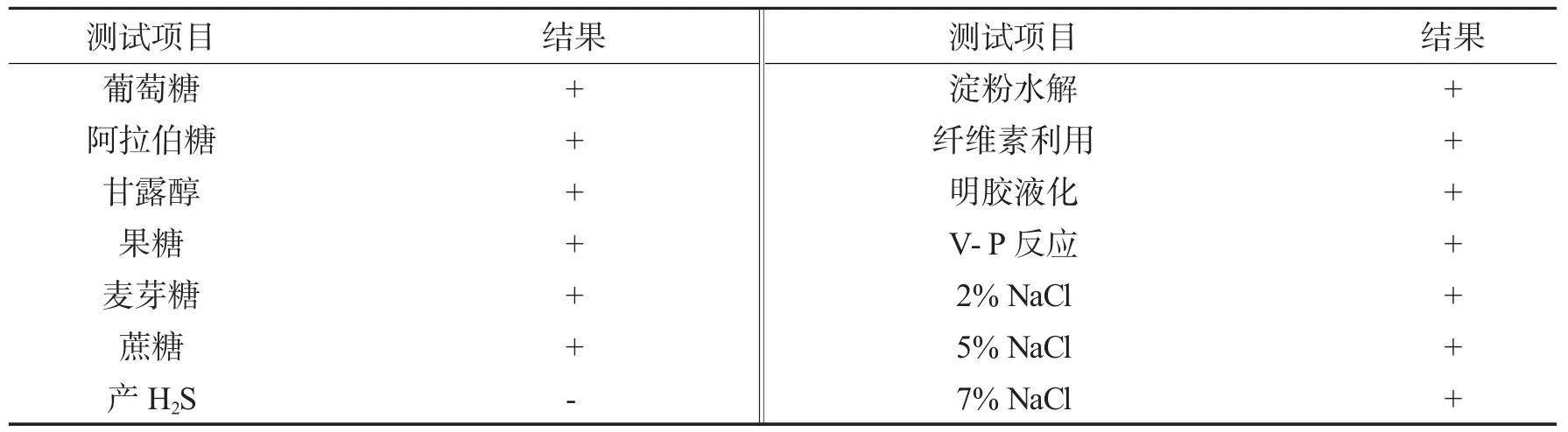
表1 菌株hb-081 的生理生化特征Tab.1 Physiological and biochemical characteristics of strain HB-081
由表1可知,菌株HB-081 能够利用葡萄糖、阿拉伯糖、甘露醇、果糖、麦芽糖和蔗糖,可以水解淀粉,液化明胶,利用纤维素,V-P 反应阳性,不能产生H2S,在质量分数为2%、5%、7%的NaCl 条件下都可以正常生长.
2.2.2 分子生物学鉴定 以菌株HB-081 基因组DNA 为模板,利用通用引物对该菌株的16S rRNA 基因序列进行扩增和测序,获得长度为1403 bp 的序列(登录号:ON573379).在NCBI 数据库中进行BLAST比对后, 发现菌株HB-081 的16S rRNA 基因序列与芽孢杆菌属内多个种的16S rRNA 基因序列相似性达到100%.进一步选择菌株HB-081 的gyrA 基因序列(登录号:ON603980)进行BLAST 比对,选择相关菌株的gyrA 基因序列,利用MEGA 7.0 软件中的邻接法构建系统发育树如图3所示.

图3 基于gyrA 基因序列构建的菌株HB-081 及相关菌株的系统发育树Fig.3 Phylogenetic tree of strain HB-081 and related strains based on gyrA gene sequence
由图3可以看出,菌株HB-081 与解淀粉芽孢杆菌KCTC 1660T、NRRL B-14393 处于一个分支.结合形态学、生理生化特征、16S rRNA 及gyrA 基因序列分析,最终将菌株HB-081 鉴定为解淀粉芽孢杆菌.
2.3 对假禾谷镰刀菌菌丝形态及孢子萌发过程的抑制作用
为了分析菌株HB-081 无菌发酵液对假禾谷镰刀菌菌丝形态及孢子萌发的抑制作用,分别用不同体积分数的无菌发酵液对假禾谷镰刀菌的菌丝及孢子进行处理.菌株HB-081 无菌发酵液对假禾谷镰刀菌菌丝形态的影响如图4所示.

图4 菌株HB-081 无菌发酵液对假禾谷镰刀菌菌丝生长的抑制作用Fig.4 Inhibitory effects of strain HB-081 cell-free fermentation liquid on mycelial growth of F.pseudograminearum
由图4可以看出,不同体积分数的无菌发酵液都能够影响假禾谷镰刀菌菌丝的生长,无菌发酵液体积分数为10%及20%时,假禾谷镰刀菌菌丝生长变慢,且分支增多.当体积分数增大到50%时,假禾谷镰刀菌菌丝出现畸形,部分细胞液泡化.
菌株HB-081 无菌发酵液对假禾谷镰刀菌孢子萌发的抑制作用如表2所示.
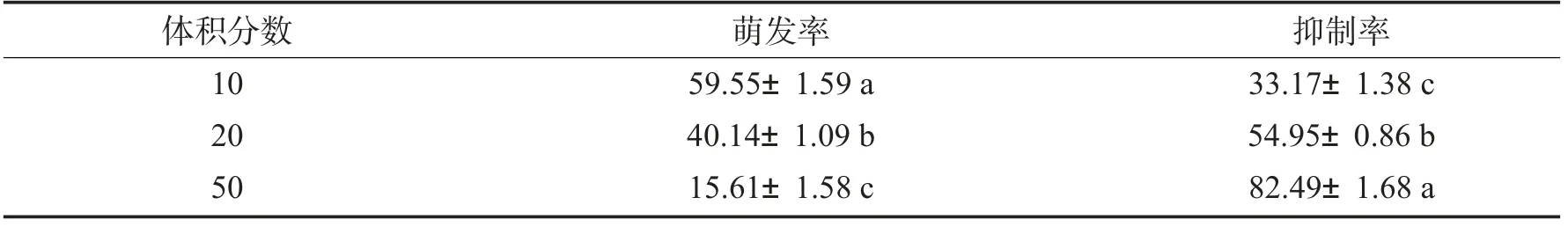
表2 菌株HB-081 对假禾谷镰刀菌孢子萌发的抑制作用Tab.2 Inhibitory effects of strain HB-081 on conidiospores germination of F. pseudograminearum %
由表2可以看出,不同体积分数的无菌发酵液都能够抑制假禾谷镰刀菌孢子萌发过程,体积分数越高,抑制效果越强.50%体积分数时,孢子萌发率仅有15.61%,抑制率达到82.49%.
2.4 对假禾谷镰刀菌的抑制作用
为了分析菌株HB-081 挥发性物质对假禾谷镰刀菌的抑制作用, 分别将涂布有菌株HB-081 发酵液和无菌发酵液的平板与接种假禾谷镰刀菌的平板进行对扣培养.挥发性物质对假禾谷镰刀菌菌落生长的抑制作用如图5所示.
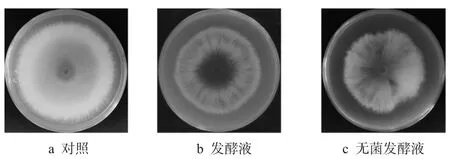
图5 菌株HB-081 挥发性物质对假禾谷镰刀菌的抑制作用Fig.5 Inhibitory effects of volatiles from strain HB-081 against F. pseudograminearum
由图5可以看出,菌株HB-081 发酵液和无菌发酵液的存在都可以影响假禾谷镰刀菌的生长,抑菌率分别为19.39%±3.27%和18.68%±1.25%,此结果说明,菌株HB-081 能够产生抑制假禾谷镰刀菌的挥发性气体.
2.5 对小麦茎基腐病的防病效果
利用盆栽试验分析菌株HB-081 发酵液对小麦茎基腐病的防病效果如表3所示.

表3 菌株HB-081 发酵液对小麦茎基腐病的防病效果Tab.3 Effect of strain HB-081 fermentation liquid against wheat crown rot
由表3可以看出,对照组小麦茎基腐病的病情指数为19.34,菌株HB-081 发酵液处理后,病情指数降低到6.46,防治效果达到66.69%.另外,12.5%烯唑醇可湿性粉剂的防治效果为81.13%.由此说明,菌株HB-081 具有一定的防病能力.
2.6 菌株HB-081 的抑菌谱
利用平板对峙的方法分析菌株HB-081 对不同植物病原真菌的拮抗能力结果见表4.

表4 菌株HB-081 对9 种不同植物病原真菌的拮抗作用Tab.4 The inhibitory effects of strain HB-081 against nine plant pathogens
由表4可知,菌株HB-081 对供试的9 种植物病原真菌都有不同程度的拮抗能力,其中对美澳型核果褐腐菌的抑制作用最强,抑菌率为65.58%.对禾谷镰刀菌及层出镰刀菌的抑菌率相对较低,分别为48.08%和48.76%.由此表明,菌株HB-081 具有一定的抑菌谱.
3 结论与讨论
大量研究表明,解淀粉芽孢杆菌可作为重要的生防资源,能够对多种植物病害起到生防作用,如黄瓜灰霉病[17]、烟草青枯病[18]、马铃薯黑痣病[19]、水稻基腐病[20]、人参灰霉病[21]及苜蓿炭疽病[22]等.本研究从女贞叶片中分离筛选到1 株对假禾谷镰刀菌具有较好抑制效果的菌株HB-081,经形态学、生理生化特征、16S rRNA 及gyrA 基因序列分析后,将其鉴定为解淀粉芽孢杆菌.此外,通过抗菌谱分析发现该菌株对链格孢菌等9 种植物病原真菌具有拮抗效果.
在抑菌机制方面的研究表明,解淀粉芽胞杆菌主要利用其产生的脂肽类物质、聚酮类物质等多种活性物质发挥其生物防治效果[23].本研究发现,菌株HB-081 的无菌发酵液可以导致假禾谷镰刀菌的菌丝出现畸形,并影响孢子的萌发过程.解淀粉芽胞杆菌HRH317 发酵上清液能够破坏串珠镰孢菌的细胞膜通透性,进而抑制串珠镰孢菌菌丝体的生长[24].解淀粉芽孢杆菌HMB33604 可以产生泛革素和伊枯草菌素等抑菌活性物质,从而实现对立枯丝核菌的抑制作用,并导致病原菌菌丝出现畸形[20].此外,芽孢杆菌可以产生多种挥发性物质,能够在不同程度上抑制植物病原菌的生长[25].例如解淀粉芽孢杆菌CPA-8 产生的噻吩等物质可以对甜樱桃3 种采后病害起到抑制作用[26].解淀粉芽孢杆菌BEB17 产生的挥发性物质能够破坏香蕉枯萎病菌的细胞膜,并对孢子萌发过程具有抑制作用[27].于此类似,菌株HB-081 也能够产生抑制假禾谷镰刀菌菌落生长的挥发性物质.所以下一步还需对菌株HB-081 的抑菌活性物质组成及抑菌机理进行深入研究.
本研究通过盆栽试验发现菌株HB-081 发酵液处理后,能够降低小麦茎基腐病的病情指数,防病效果为66.69%.林琪童等[12]发现,解淀粉芽孢杆菌YB-161 对小麦茎基腐病的盆栽防治效果为68.15%,田间防治效果高于52.35%.本研究只进行了盆栽试验,该菌株在田间条件下是否也能实现其生防效果有待后续研究.芽孢杆菌不仅能够防治植物病害,而且对植物还具有促生作用.例如解淀粉芽孢杆菌LY79 不仅能够防治烟草根黑腐病,而且对烟草具有较好的促生效果[28].枯草芽孢杆菌Y-10 具有固氮及产生铁载体的能力,从而对黄瓜的生长起到促进作用[29].因此,后续还将开展菌株HB-081 促生作用相关的研究.
