基于理性设计提高假交替单胞菌κ-卡拉胶酶热稳定性
2022-12-22龙柳妃陈艳红姜泽东李清彪朱艳冰
龙柳妃,苏 羽,陈艳红,2,姜泽东,2,倪 辉,2,李清彪,2,朱艳冰,2,*
(1.集美大学海洋食品与生物工程学院,福建 厦门 361021;2.福建省食品微生物与酶工程重点实验室,厦门市食品生物工程技术研究中心,福建 厦门 361021)
卡拉胶是从海洋红藻中提取的一类线性硫酸化多糖[1]。根据结构内是否含有3,6-脱水-D-半乳糖,以及半乳糖上硫酸基团的位置和数量,卡拉胶主要分为3 类:κ-、ι-和λ-卡拉胶[2]。研究表明,κ-卡拉胶降解得到的低分子质量卡拉胶寡糖具有更显著的生物活性[1],包括抗肿瘤[3]、抗病毒[4]、抗氧化[5]、植物保护[6]、抗炎[7]等。卡拉胶寡糖制备方法主要包括化学法和生物酶法,反应条件温和、特异性强的酶解法由于工艺和产物易于控制,降低环境污染,同时保留糖上的硫酸基团,具有更好的应用性[2,8]。
κ-卡拉胶酶属于糖苷水解酶家族,是一种通过水解κ-卡拉胶内部的β-1,4-糖苷键降解卡拉胶的酶[9]。κ-卡拉胶酶主要来源于海洋动物和海洋微生物[2],其中微生物来源包括假单胞菌、假交替单胞菌、噬细胞菌、弧菌、坦拉氏菌和芽孢杆菌等[10]。κ-卡拉胶酶除用于制备卡拉胶寡糖,还可以用于藻类原生质体制备、用作洗涤剂添加剂、用作生物乙醇燃料的生物催化剂、解析卡拉胶多糖的结构等,广泛应用于食品、医药、生物燃料等领域[9-10]。
大多数κ-卡拉胶酶在30~40 ℃范围内显示出良好的酶活力和温度稳定性[9],热稳定性不高。在前期研究中克隆、表达和鉴定了假交替单胞菌JMUZ2的κ-卡拉胶酶[11],发现该酶的热稳定性不高。κ-卡拉胶具有热可逆凝胶化性能,当温度在55 ℃以下时,κ-卡拉胶溶液具有很强的黏度,而当温度在55 ℃以上时,黏度随温度升高而降低[12]。因此,在κ-卡拉胶酶的应用中,为了提高水解效率,需要κ-卡拉胶酶具有良好的热稳定性。研究具有良好热稳定性的κ-卡拉胶酶对κ-卡拉胶的高值化利用具有重要意义。
蛋白质折叠自由能是蛋白质热稳定性的重要指标[13],一些计算机算法用于预测突变对蛋白质折叠自由能的影响[14-17]。不同酶之间的结构差异使酶结构与功能构效关系复杂,需要针对酶的特性进行研究。目前尚鲜见改良κ-卡拉胶酶热稳定性的分子改造研究报道。本研究拟利用基于折叠自由能分析的PoPMuSiC在线服务器,通过理性设计以提高假交替单胞菌JMUZ2的κ-卡拉胶酶热稳定性,以期扩大该酶的应用范围。
1 材料与方法
1.1 材料与试剂
大肠杆菌DH5α、大肠杆菌BL21(DE3)以及pET-28a载体均由本实验室保存。
质粒小提取试剂盒 北京天根生化科技有限公司;蛋白质分子质量标准、核酸分子质量标准、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)、卡那霉素 生工生物工程(上海)股份有限公司;定点突变试剂盒Mut ExpressII Fast Mutagenesis Kit V2 南京诺唯赞生物科技股份有限公司;Ni Sepharose 6 Fast Flow美国GE Healthcare Life Sciences公司;κ-卡拉胶 深圳恒生生物科技有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
双层全温度恒温摇床 上海智城分析仪器制造有限公司;9700聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;GEAI 600多色荧光凝胶成像仪 美国GE公司;Avanti™J-25冷冻离心机 美国Beckman公司;Epoch2T微量酶标仪 美国伯腾仪器有限公司。
1.3 方法
1.3.1κ-卡拉胶酶的同源建模及突变位点选取
将假交替单胞菌κ-卡拉胶酶蛋白序列利用SWISSMODEL(http://swissmodel.expasy.org/)进行同源建模,模板为来自Pseudoalteromonas carrageenovora的κ-卡拉胶酶晶体结构(PDB登录号5ocq.1.A),覆盖范围为2~272位氨基酸,覆盖率达68%。将κ-卡拉胶酶的三维结构提交至在线软件PoPMuSiC[18],预测κ-卡拉胶酶每个突变氨基酸的去折叠自由能变化(ΔΔG),选择ΔΔG为负值并且变化显著的氨基酸残基作为突变位点。经分析,选择G113Y、G113C、G113F、G113I、G113W、K155A、K155C、K155I、K155L、K155V作为突变位点。参照Mut ExpressII Fast Mutagenesis Kit V2定点突变试剂盒的说明书,依据选定的拟突变氨基酸位点,设计的引物序列如表1所示。

表1 突变引物Table 1 Primer sequences used for amplification of mutant genes
1.3.2 突变酶重组表达工程菌株的构建
在前期研究中,构建了野生型(WT)假交替单胞菌κ-卡拉胶酶重组质粒pET-28a-car。利用PCR分别扩增得到包含载体序列和突变基因序列的线性片段,PCR扩增条件为:95 ℃预变性30 s,95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸90 s,30次循环,72 ℃延伸5 min。扩增产物经DpnI酶处理后进行消化,消化产物在重组酶催化下将突变位点进行重组反应,重组产物转化至大肠杆菌DH5α,利用卡那霉素抗性平板筛选转化子,经测序鉴定突变酶基因序列。将含有突变酶序列的重组质粒分别转到大肠杆菌BL21感受态细胞中,获得突变酶重组表达工程菌株。
1.3.3κ-卡拉胶酶的表达与纯化
分别取WT和突变型κ-卡拉胶酶重组表达工程菌株的单菌落,37 ℃过夜培养,再转接至含有卡那霉素的LB液体培养基中,培养至OD600nm达到0.8后加入IPTG诱导剂至终浓度为0.5 mmol/L,16 ℃诱导表达18 h。将诱导表达的菌液于4 ℃、5 000 r/min离心15 min,弃上清液,菌体用预冷的缓冲液(50 mmol/L NaH2PO4、300 mmol/L NaCl、15 mmol/L咪唑,pH 8.0)悬浮。在冰浴条件下利用超声波破碎菌体,将裂解液于4 ℃、12 000 r/min离心20 min,获得的上清液即为粗酶液。参照Ni Sepharose 6 Fast Flow使用说明书,利用亲和层析对κ-卡拉胶酶进行分离纯化。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析蛋白样品的纯度和分子质量。在后续的酶学性质比较分析中,WT和突变型κ-卡拉胶酶的质量浓度保持一致。
1.3.4κ-卡拉胶酶活力测定
参照张成昊等[11]方法进行κ-卡拉胶酶活力测定。每分钟释放1 μmoL半乳糖所需的酶量为1个酶活力单位(U)。
1.3.5 温度对κ-卡拉胶酶活力和稳定性的影响
分别在不同温度(40、45、50、55、60 ℃)下测定酶活力,以最高酶活力为100%,研究酶的最适反应温度。将酶分别置于不同温度(40、45、50、55、60 ℃)下处理40 min后,测定酶的残余活力,以未经处理的酶活力为100%,研究酶的热稳定性。
1.3.6 pH值对κ-卡拉胶酶活力和稳定性的影响
分别在不同pH值条件下测定κ-卡拉胶酶活力,研究酶的最适反应pH值,所用缓冲液为50 mmol/L的Na2HPO4-柠檬酸缓冲液(pH 3.0~6.0)、磷酸钠缓冲液(pH 6.0~8.0)、Tris-HCl缓冲液(pH 8.0~9.0)、甘氨酸-NaOH缓冲液(pH 9.0~11.0)。将酶分别置于pH 8.0~11.0的缓冲液中,25 ℃放置1 h后,测定酶的残余活力,以未经处理的酶活力为100%,研究酶的pH值稳定性。
1.3.7 金属离子对κ-卡拉胶酶活力的影响
分别添加终浓度为1 mmol/L和10 mmol/L的不同金属离子,25 ℃温浴1 h后,测定突变κ-卡拉胶酶的活力,以不加金属离子的酶活力为100%,研究金属离子对突变酶活力的影响。
1.3.8κ-卡拉胶酶的动力学参数测定
分别配制不同质量浓度的κ-卡拉胶溶液(0.5、1.5、2.5、3.5、4.5、5.0 mg/mL),测定酶在不同底物质量浓度下的酶活力。利用Lineweaver-Burk双倒数作图法,计算酶的动力学参数,包括米氏常数(Km)和最大反应速率(Vmax)。
1.3.9κ-卡拉胶酶的结构分析
κ-卡拉胶酶的三维结构使用PyMOL软件显示和分析。利用AutoDock Vina软件进行κ-卡拉胶酶与κ-卡拉胶四糖底物的分子对接。利用Discovery Studio软件显示分子对接后的相互作用力。通过Ligplot软件统计显示κ-卡拉胶酶与κ-卡拉胶四糖结合状态下的疏水氨基酸残基。利用蛋白质相互作用计算器(Protein Interaction Calculator,PIC,http://pic.mbu.iisc.ernet.in/job.html)分析κ-卡拉胶酶的分子内相互作用。
1.3.10κ-卡拉胶酶的分子动力学模拟
采用软件Gromacs进行分子动力学模拟分析。使用CHARMM27全原子力场,先进行100 ps的NVT平衡和100 ps的NPT平衡,最后进行温度323 K、时长20 ns的自由分子动力学模拟。蛋白的均方根偏差(root mean square deviation,RMSD)和轨迹中原子位置的均方根涨落(root mean square fluctuation,RMSF)分别采用gmx rmsd和gmx rmsf程序计算,分子的回旋半径(radius gyration,Rg)则通过gmx gyrate程序计算。
1.4 数据处理
2 结果与分析
2.1 κ-卡拉胶酶突变体的构建与筛选
将同源建模后的κ-卡拉胶酶结构提交至在线软件PoPMuSiC,计算κ-卡拉胶酶每个突变氨基酸的去折叠自由能变化(ΔΔG)辅助设计酶蛋白的定点突变。一般认为,ΔΔG为负值表示突变后能量下降,预测酶的稳定性提高。根据突变后每个突变点ΔΔG的变化,选择Gly113Try(ΔΔG:-1.35 kcal/mol)、Gly113Cys(ΔΔG:-1.31 kcal/mol)、Gly113Phe(ΔΔG:-1.30 kcal/mol)、Gly113Ile(ΔΔG:-1.00 kcal/mol)、Gly113Trp(ΔΔG:-1.20 kcal/mol)、Lys155Ala(ΔΔG:-0.95 kcal/mol)、Lys155Cys(ΔΔG:-0.92 kcal/mol)、Lys155Ile(ΔΔG:-0.98 kcal/mol)、Lys155Leu(ΔΔG:-1.04 kcal/mol)、Lys155Val(ΔΔG:-1.09 kcal/mol)作为突变位点。将所设计的突变体全部进行诱导表达后,突变体和WT的SDS-PAGE分析结果如图1所示,可以看出蛋白条带清晰且单一,突变体大小为48.8 kDa,与WT一致。测定κ-卡拉胶酶活力,发现大部分突变体的酶活力都有不同程度下降,突变体K155A的酶活力与WT相当(图2)。选择突变体K155A进行进一步的酶学性质研究。
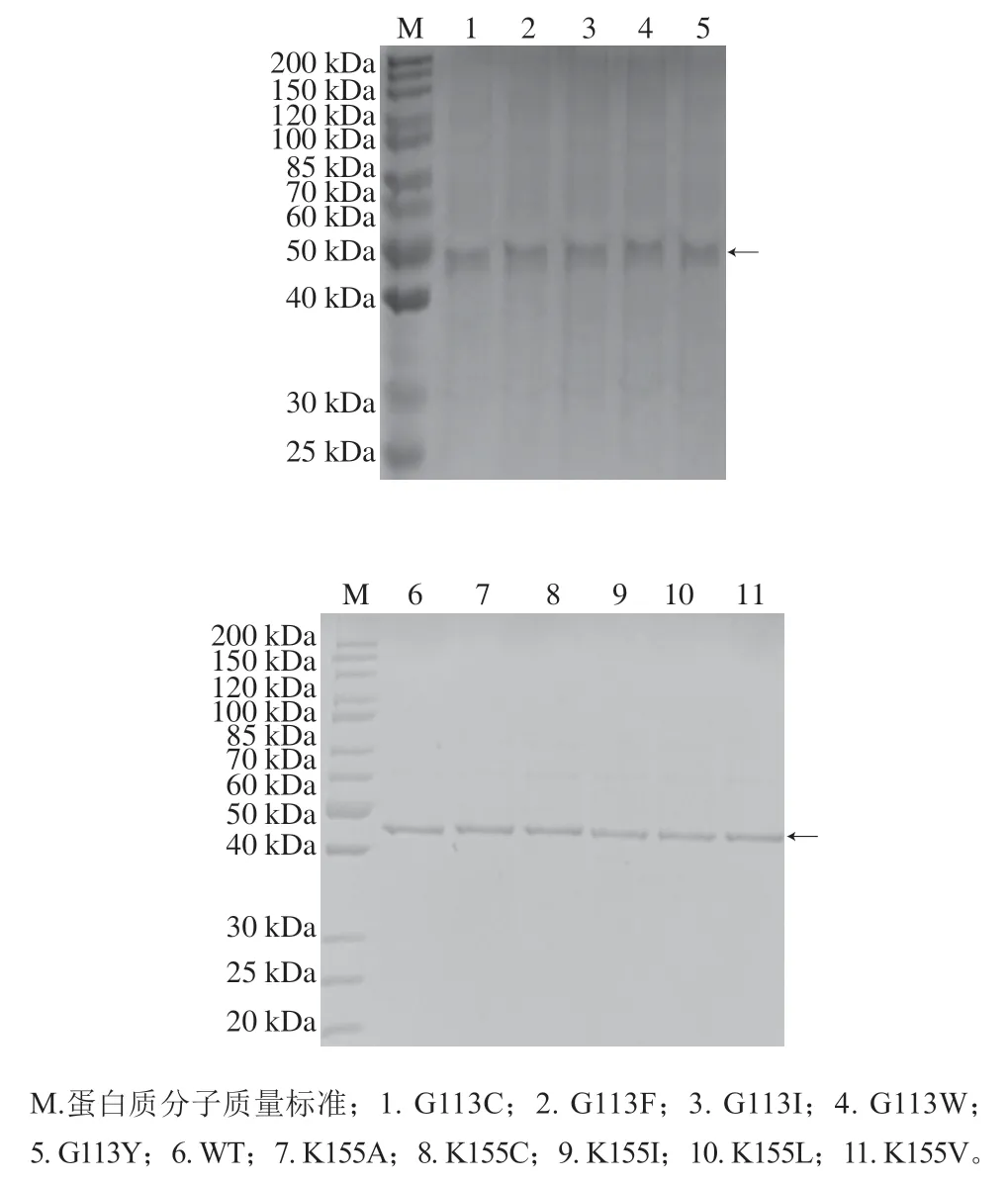
图1 突变体和WT的SDS-PAGE分析Fig. 1 SDS-PAGE analysis of mutants and WT κ-carrageenase

图2 κ-卡拉胶酶突变体的酶活力Fig. 2 Activities of mutant κ-carrageenases
2.2 温度对酶活力和稳定性的影响
分别测定WT和K155A的最适温度,结果见图3A。WT的最适温度为50 ℃,突变体K155A的最适温度没有发生变化。在所有检测温度下,K155A酶活力均不低于WT。酶的热稳定性分析显示,在40、45、50、55、60 ℃处理40 min后,K155A分别保留了80%、49%、46%、41%、18%的残余酶活力,而WT分别保留了74%、41%、25%、15%、4%的残余酶活力,在50、55 ℃和60 ℃处理后,K155A的残余酶活力分别是WT的1.8、2.7 倍和4.5 倍(图3B),这些结果表明,K155A比WT具有更好的热稳定性。通过PoPMuSiC计算自由能变化辅助设计的突变体可能改变酶分子局部区域氨基酸残基之间的相互作用,已成为提高蛋白质稳定性或酶活力的有效方法[19]。
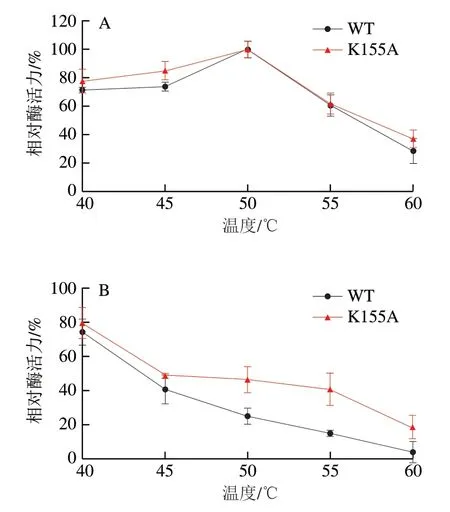
图3 温度对K155A和WT κ-卡拉胶酶活力(A)和稳定性(B)的影响Fig. 3 Effect of temperature on the activity (A) and stability (B) of K155A and WT κ-carrageenase
2.3 pH值对酶活力和稳定性的影响
不同pH值下K155A和WT的酶活力呈现相似的变化趋势,在pH 8.0时活力均为最高,为最适反应pH值,当pH值高于8.0时,K155A和WT的酶活力均急剧降低(图4A)。酶的pH值稳定性分析显示,在不同pH值条件下处理后,K155A和WT在pH 8.0~11.0范围内残余酶活力保留在30%以上(图4B)。


图4 pH值对K155A和WT κ-卡拉胶酶活力(A)和稳定性(B)的影响Fig. 4 Effect of pH on the activity (A) and stability (B) of K155A and WT κ-carrageenase
2.4 金属离子对酶活力的影响
如图5所示,高浓度的Na+和K+对酶活力有促进作用。Ca2+在低浓度下对酶活力没有影响,在高浓度下有抑制作用。Mn2+、Mg2+、Al3+、Ba2+、Cu2+、Fe3+、Zn2+、Ni2+和Co2+对突变酶具有不同程度的抑制作用,其中高浓度的Cu2+对K155A的抑制作用最显著。

图5 金属离子对突变κ-卡拉胶酶K155A活力的影响Fig. 5 Effects of metal ions on the activity of mutant κ-carrageenase K155A
2.5 突变酶的动力学参数
以κ-卡拉胶为底物测定酶的动力学参数,对WT和突变体K155A,Km分别为1.3 mg/mL和1.9 mg/mL,Vmax分别为64.5 U/mg和65.2 U/mg,说明突变导致酶对κ-卡拉胶的亲和力略有下降,Vmax基本没有差异。
2.6 突变酶的结构分析
将K155A与κ-卡拉胶四糖进行分子对接,分析酶与底物的相互作用机理。结果显示,K155A与κ-卡拉胶四糖的结合自由能为-13.4 kcal/mol,突变酶的整体结构类似于弯曲的β-三明治,其中β-折叠片两两反向堆积形成催化腔,隧道状结构镶嵌在三明治状的结构中,在催化中心位置的隧道内裂缝处即为酶的底物结合处;该突变位点距离活性中心远,这可能是该突变体不影响酶活力的原因(图6A)。催化腔中起催化作用的氨基酸预测为E163、D165和E168,其中E163起亲核催化作用,E168起酸碱催化作用,D165促进中间转换状态的解体,催化腔中的精氨酸残基R260能够特异性结合κ-卡拉胶上的硫酸酯基,起着底物识别的功能[20]。酸碱催化残基Glu168和亲核催化残基Glu163分布于糖环两侧(图6B、C),Arg151、Trp194、Asn269、Arg196、Ser256、Asp165和His183与κ-卡拉胶四糖形成氢键,Tyr64与κ-卡拉胶四糖形成Pi-Sigma型作用力,Try64、Trp67和Trp194与κ-卡拉胶四糖形成Pi-硫型作用力,Arg151和Arg260与κ-卡拉胶四糖形成盐桥,Tyr161与κ-卡拉胶四糖形成Pi-烷基型作用力(图6B)。
通过Ligplot软件统计κ-卡拉胶四糖与突变酶结合状态下的疏水氨基酸残基,发现Trp95、Ile149、Tyr146、Glu163、Tyr64、Trp67、Trp144、Ala142、Glu168、His183、Tyr161残基与κ-卡拉胶四糖形成了疏水相互作用(图6D)。将这些残基对应于三维空间模型,可以发现它们在β右旋隧道催化结构域底部形成了一个疏水性口袋,底物被包裹在该口袋中(图6E)。为了进一步探索突变酶的结构变化,利用PIC分析了酶的分子内相互作用,κ-卡拉胶酶突变后引入额外的疏水相互作用(表2)。突变体K155A用暴露在溶剂中的疏水残基Ala取代了WT中的极性残基Lys,突变后κ-卡拉胶酶表现出更强的疏水相互作用。突变体K155A的热稳定性提高可能归因于酶分子内疏水相互作用的增强。中温型和热稳定型蛋白质结构研究表明,蛋白质结构与热稳定性之间存在重要关系。在蛋白质一级结构水平,热稳定蛋白质中存在大量的疏水残基、带电残基、脯氨酸[21-23]。疏水相互作用在蛋白质折叠和空间结构稳定中起着重要作用[24-25],是蛋白质热稳定性的关键因素之一,研究表明通过增加蛋白质的疏水相互作用提高酶的热稳定性是一种可行的策略[26-27]。


图6 突变酶K155A与κ-卡拉胶四糖的分子对接Fig. 6 Molecular docking of K155A with κ-neocarratetraose

表2 K155A和WT κ-卡拉胶酶的分子内相互作用Table 2 Intramolecular interactions of K155A and WT κ-carrageenase
2.7 突变酶的分子动力学模拟
对WT和突变酶进行分子动力学模拟,RMSD反映出两个分子结构相同原子间的距离以及模拟轨迹中蛋白构象的变化,用来评价体系稳定性,若RMSD随时间的变化较小,则表明体系达到平衡状态。图7A显示了在20 ns模拟过程中RMSD随时间变化的结果,K155A在17.0 ns左右达到了平衡状态,并且维持在0.35 nm左右进行波动。WT在15.0 ns左右达到了平衡状态,并且维持在0.3 nm左右进行波动。进一步计算整个轨迹的RMSF变化,RMSF是指每个氨基酸残基在整个分子动力学模拟过程中的偏振,残基的位置偏移越大,说明该区域的构象越不稳定。如图7B所示,WT和突变体的大部分残基RMSF值都小于0.3 nm,而WT 150~250位氨基酸大部分高于突变体,说明突变减小了这些位置的氨基酸柔性,表明突变后酶蛋白的刚性增加,突变酶的刚性增加可能有助于其热稳定性的提高[13]。Rg值可以研究蛋白质结构在模拟过程中密实度的波动变化,Rg值与蛋白质密实度呈反比关系。如图7C所示,κ-卡拉胶酶整体结构的密实度在突变前后变化不大,说明突变未对酶的结构造成太大的影响。
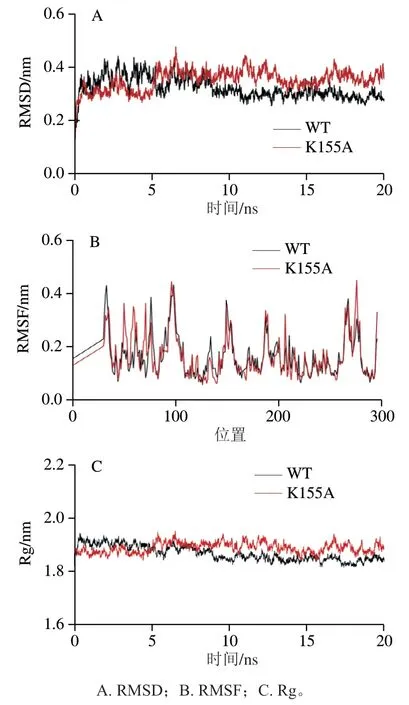
图7 K155A和WT在20 ns的运动轨迹和结构变化Fig. 7 Motion trajectory and structure changes of K155A and WT within 20 ns
3 结 论
通过在线预测软件PoPMuSiC成功筛选到假交替单胞菌κ-卡拉胶酶热稳定性提高突变体K155A。该突变酶的最适反应温度和最适反应pH值与WT相同,K155A对κ-卡拉胶的亲和力略有下降,在pH 8.0~11.0范围内稳定,在40~60 ℃,突变体K155A的热稳定性优于WT酶。酶的结构及动力学模拟分析显示,突变酶疏水相互作用和刚性的增强可能是其热稳定提高的原因。热稳定性改良提高了该突变κ-卡拉胶酶在工业应用上的价值。
