假交替单胞菌JMUZ2重组κ-卡拉胶酶的异源表达和酶学性质
2021-07-24张成昊朱艳冰陈艳红姜泽东倪辉李清彪
张成昊,朱艳冰,陈艳红,姜泽东,倪辉,李清彪,2
(1 集美大学食品与生物工程学院,福建厦门361021; 2 厦门大学化学化工学院,福建厦门361005)
引 言
卡拉胶(carrageenans)是从麒麟菜、石花菜、鹿角菜等红藻类海草中提炼出来的水溶性硫酸化多糖,具有β-D-半乳糖和α-D-半乳糖通过β-1,4 糖苷键和α-1,3 糖苷键交替连接形成的骨架结构[1]。卡拉胶因1,4-连接残留物中存在或不存在3,6-脱水-D-半乳糖,以及硫酸盐基团的数量和位置不同[2],被分为kappa(κ-)、lambda(λ-)、iota(ι-)三种[3],其中κ-卡拉胶是食品工业中常用的胶凝剂、增稠剂和稳定剂。
天然κ-卡拉胶分子量大,黏度高,溶解性差,不易吸收。研究表明,κ-卡拉胶的降解产物κ-卡拉胶寡糖分子量和黏度降低,溶解性好,易吸收,并且具有多种有益生物活性,包括免疫调节[4]、抗肿瘤[5]、抑制血管生成[6]、抗氧化[7]、抗病毒[8]等。目前,卡拉胶的降解方式主要有化学降解法[9-10]、物理降解法[11-12]和生物降解法[13-15]。其中,利用卡拉胶酶的酶解法制备卡拉胶寡糖具有专一性强、反应条件温和、反应过程易于控制等优点,具有更强的应用优势[16-17]。
κ-卡拉胶酶主要由海洋细菌产生,主要包括弧菌属[18]、溶解噬纤维菌[19]、伸长假单胞菌[20]、食鹿角菜假交替单胞菌[21]和微泡菌属[22]等。Liu等[23]从黄海腐烂海藻中分离到一株产κ-卡拉胶酶的细菌Pseudoalteromonas porphyraeLL1,对该菌株的胞外κ-卡拉胶酶进行纯化,获得分子量为40×103的κ-卡拉胶酶,该酶的最适温度和最适pH 分别为55℃和8.0。Zhou 等[24]报道了假交替单胞菌WZUC10 的κ-卡拉胶酶,该酶的分子量为45×103,最适温度和最适pH 分别为30℃和7.5。本研究将假交替单胞菌JMUZ2 κ-卡拉胶酶基因进行异源表达和纯化,研究重组酶的酶学性质及酶解产物,为该κ-卡拉胶酶的工业化应用奠定理论基础。
1 实验材料和方法
1.1 材料
菌株和质粒:假交替单胞菌菌株JMUZ2 和大肠杆菌(E. coli)BL21(DE3)以及pET-28a 载体均由本实验室保存。
主要试剂:T4 DNA 连接酶、Primer STAR®HS DNA Polymerase、EcoRI 和HindⅢ,TaKaRa 公司;金属镍螯合琼脂糖凝胶6FF,GE Healthcare Life Sciences 公司;κ-卡拉胶和ι-卡拉胶,深圳恒生生物科技有限公司;琼胶,青岛聚大藻业集团有限公司;海藻酸钠、羧甲基纤维素钠和岩藻聚糖,上海源叶生物科技有限公司;其余试剂均为国产分析纯产品。
1.2 κ-卡拉胶酶重组表达质粒的构建
卡拉胶酶基因的上游引物序列F: 5'-TATGAATTCTGCGAGTAGTGAGAGTTAGCTTAAC-3'(划线部分为EcoRI 酶切位点),下游引物序列R:5'-CCCAAGCTTTAACTTGCTCATT-GTCACTTGCTT G-3'(划线部分为HindIII 酶切位点)。以假交替单胞菌JMUZ2的基因组DNA为模板,进行卡拉胶酶基因扩增,反应程序:95℃预变性5 min,94℃变性45 s,50℃退火45 s,72℃延伸90 s,30 次循环;72℃延伸10 min。
PCR 产物利用1%琼脂糖凝胶电泳进行检测,待大小正确后,用DNA 纯化试剂盒进行纯化回收。运用限制性内切酶分别对目的基因和表达载体进行酶切反应,琼脂糖凝胶电泳后使用胶回收试剂盒纯化回收PCR 产物后连接pET-28a 载体后转化大肠杆菌DH5α 感受态细胞中,在含卡那霉素抗性培养基上培养,挑取阳性克隆进行菌液PCR 和测序验证,从而获得含有κ-卡拉胶酶表达载体pET-28acar。
1.3 κ-卡拉胶酶的诱导表达和纯化
将含有重组质粒pET-28a-car 的菌液按照1%的接种量接种于50 ml LB 液体培养基(含50 µg/ml卡那霉素),37℃、180 r/min 培养12 h,进行菌种的活化,按照1%的接种量转接到200 ml LB 液体培养基(含50 µg/ml 卡那霉素)中,37℃、180 r/min 培养至OD600达到0.6~0.8。加入IPTG 至终浓度为0.5 mmol/L,16℃低温诱导表达18 ~ 24 h。将诱导表达的菌液于5000 r/min,4℃下冷冻离心15 min,舍去上清,菌体沉淀用15 ml 预冷的溶解缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,15 mmol/L 咪唑,pH 8.0)重新溶解。在冰浴条件下,进行超声破碎,将破碎后的裂解液4℃、12000 r/min 离心25 min,获得上清液,即为粗酶液。参照GE Healthcare Life Sciences公司的金属镍螯合琼脂糖凝胶6FF 使用说明书,利用亲和层析对重组蛋白进行分离纯化。采用SDSPAGE分析测定蛋白的分子量。
1.4 κ-卡拉胶酶的活力测定
利用DNS 法[25]测定酶的活力。取490 µl 含有κ-卡拉胶的50 mmol/L NaH2PO4-Na2HPO4缓冲液(pH 8.0),加入10µl 重组酶,50℃反应15 min 后,加入500 µl DNS 试剂,沸水浴10 min 后室温冷却,于波长520 nm 处测定吸光值。以上述条件下每分钟释放1 µmol 半乳糖所需的酶量为一个酶活力单位(U)。
1.5 κ-卡拉胶酶的酶学性质研究
1.5.1 底物专一性研究 将重组酶分别加入到含有0.5%(质量分数)的不同底物溶液(κ-卡拉胶、ι-卡拉胶、琼胶、羧甲基纤维素钠、岩藻聚糖和海藻酸钠)中,利用DNS 法测定酶的活力,研究酶的底物专一性。
1.5.2 温度对酶活性和稳定性的影响 在不同温度下测定重组κ-卡拉胶酶活力,研究酶的最适反应温度。将重组酶分别在不同温度下放置1 h 后,测定酶的残余活力,研究温度对酶稳定性的影响。
1.5.3 pH 对酶活性的影响 分别在不同pH 条件下测定κ-卡拉胶酶的活力,研究酶的最适反应pH,所用缓冲液为50 mmol/L 的Na2HPO4-柠檬酸缓冲液(pH 3.0~6.0),磷酸钠缓冲液(pH 6.0~8.0),Tris-HCl缓冲液(pH 8.0~9.0),甘氨酸-NaOH 缓冲液(pH 9.0~11.0)。
1.5.4 金属离子对酶活性的影响 参照银小倩等[26]方法进行金属离子对酶活性影响测定。
1.5.5 添加试剂对酶活性的影响 将重组酶分别置于终浓度为1 mmol/L 和10 mmol/L 抑制剂EDTA和还原试剂(β-巯基乙醇和DTT)、0.1%和1%(质量分数或体积分数)去垢剂(SDS、Tween 20、Tween 80、Triton X-100 和CTAB)、2.5 mol/L 和5 mol/L 变性剂(尿素和盐酸胍)中,25℃温浴30 min后,测定酶的残余活力,研究各种添加试剂对酶活性的影响,以未经添加试剂处理的酶活力为100%。
1.5.6 酶的动力学参数测定 测定重组酶在不同κ-卡拉胶底物浓度下的酶活力,利用Lineweaver-Burk双倒数作图法求出酶的Km和Vmax值。
1.6 κ-卡拉胶酶解终产物分析
重组酶(3 U)加入到10 ml 0.5%(质量浓度)κ-卡拉胶底物溶液中,40℃反应2 h 后,补加1.5 U κ-卡拉胶酶,继续反应12 h 后补加6 U 酶,24 h 后再补加3 U 重组酶,继续反应,并测定体系的还原糖含量,当还原糖含量稳定不再变化时,沸水浴灭活10 min,加入3 倍体积的无水乙醇,4℃静置过夜,离心取上清液,利用旋转蒸发仪将无水乙醇去除,再用冷冻干燥仪将样品冻干,获得κ-卡拉胶酶解终产物。配制1.0 mg/ml 酶解产物溶液,经0.22 µm 微孔膜过滤,进样量为5 µl 注入LC-MS 系统分析,LCMS条件参照Jiang等[25]的报道。
1.7 酶解产物的抗氧化活性测定
取1.6 节中的酶解产物,参照Zhu 等[27]的方法进行抗氧化活性测定。相同浓度条件下,以VC为阳性对照。
1.8 κ-卡拉胶酶的生物信息学分析
在碳水化合物活性酶(carbohydrate-active enzyme,CAZy)数据库中搜索、下载来自不同家族的典型κ-卡拉胶酶的基因序列,利用ClustalX2 和MEGA7.0 软件构建κ-卡拉胶酶的系统发育树。运用ESPript 3.0 进行κ-卡拉胶酶蛋白质多序列比对分析。采用SMART 工具预测κ-卡拉胶酶的蛋白质结构域。利用SWISS-MODEL 进行蛋白质结构的三维模建,采用Discovery Studio 2019 软件显示蛋白质的空间结构。
2 实验结果与讨论
2.1 重组κ-卡拉胶酶的生物信息学分析
从本实验室保存的假交替单胞菌JMUZ2 克隆得到κ-卡拉胶酶基因,该基因由1116 个碱基对组成(GenBank 登录号为MW265950),编码372个氨基酸残基的蛋白质,理论分子量为41.8×103。与序列相似性高的其他卡拉胶酶的多重序列比对表明,该重组κ-卡拉胶酶含有EIDVVELTQ 保守区[图1(a),黑色框区域]。将目的蛋白序列与NCBI蛋白数据库进行比对,结果表明,它与来源于Pseudoalteromonas tetraodonis的κ-卡拉胶酶(BAJ61957.1)有100%的相似性,与来源于Pseudoalteromonassp.P1-25 菌株的κ-卡拉胶酶(KPZ57234.1)有96.77%的相似性,与来源于Pseudoalteromonassp. QY203 的κ-卡拉胶酶(AFV39914.1)有96.51%的相似性。系统发育进化分析显示,假交替单胞菌JMUZ2 κ-卡拉胶酶与来自Pseudoalteromonascarrageenovora(WP 104644224.1)的卡拉胶酶和来自Pseudoalteromonas distincta(WP 149602722.1)的卡拉胶酶在同一分支[图1(b)],而它们属于GH16 家族代表成员,因此,假交替单胞菌JMUZ2的κ-卡拉胶酶属于GH16家族。
结构域分析显示,假交替单胞菌κ-卡拉胶酶包含编码GH16 家族κ-卡拉胶酶功能域(7~270 位氨基酸残基)和一个细菌免疫球蛋白结构域(294~371位氨基酸残基)。将假交替单胞菌κ-卡拉胶酶的蛋白质序列通过SWISS-MODEL 进行三维模型的构建,模板为来自Zobellia galactanivorans的κ-卡拉胶酶晶体结构(PDB 登录号5ocq.1.A),覆盖范围为2~272 位氨基酸,覆盖率达68%,序列相似性高达97.46%。三维建模结果显示,该结构覆盖了κ-卡拉胶酶的催化结构域,富含β-折叠,由多个反向平行的β-折叠组成,呈β-果冻卷状[图2(a)]。将假交替单胞菌κ-卡拉胶与模板结构进行叠合发现二者的结构在空间位置上高度重叠,靠近N 端的Glu138 和Asp140 预测为假交替单胞菌κ-卡拉胶酶活性中心的催化残基[图2(b)]。
2.2 重组κ-卡拉胶酶的表达纯化及底物特异性
利用Ni-NTA agarose 亲和纯化,得到重组κ-卡拉胶酶蛋白,SDS-PAGE 分析[图3(a)]显示,与对照(道2和道3)相比,诱导后阳性转化子的样品有明显的融合蛋白表达条带(道4),纯化后获得重组蛋白(道5),分子量大小为约48.8×103。以κ-卡拉胶为底物,该κ-卡拉胶酶的比活力达11.0 U/mg,略高于海洋细菌Pseudoalteromonas tetraodonisJAM-K142的κ-卡拉胶酶Cgk-K142 的比活力(8.1 U/mg)[28]。底物特异性分析结果如图3(b)所示,重组酶对κ-卡拉胶有很好的水解作用,对ι-卡拉胶有较低的水解能力,对琼胶、海藻酸钠、羧甲基纤维素钠和岩藻多糖几乎不降解,说明该酶对κ-卡拉胶具有良好的底物特异性,这与Kobayashi等[28]的κ-卡拉胶酶的底物特异性结果一致。
2.3 重组κ-卡拉胶酶的酶学性质

图2 假交替单胞菌JMUZ2 κ-卡拉胶酶的三维建模(黄色:模板5ocq;蓝色:所建模型)Fig.2 Three-dimensional modeling of κ-carrageenase from Pseudoalteromonas sp.JMUZ2

图3 重组κ-卡拉胶酶的SDS-PAGE分析(a)和底物特异性(b)Fig.3 SDS-PAGE analysis(a)and substrate specificity(b)of the recombinant κ-carrageenase

图4 温度对重组κ-卡拉胶酶活性(a)和稳定性(b)的影响Fig.4 Effects of temperature on the enzymatic activity(a)and the thermal stability(b)of the recombinant κ-carrageenase
2.3.1 重组κ-卡拉胶酶的最适反应温度和温度稳定性 在不同温度下测定重组κ-卡拉胶酶的活力,结果显示,该κ-卡拉胶酶的最适反应温度为50℃[图4(a)],高于来源于Pseudoalteromonassp. ZDY3 的κ-卡拉胶酶[29](45℃)。该酶的温度稳定性分析[图4(b)]显示,κ-卡拉胶酶在40℃处理1 h 后仍具有81.1% 的残余活力;在45℃处理15 min,酶保留51.6%的残余活力,继续处理1.5 h 后,酶活力基本丧失;在50℃处理5 min,酶活力就降低至48.2%,处理1.5 h 后酶活力基本丧失。本研究中的κ-卡拉胶酶的温度稳定性高于Pedobacter hainanensisNJ-02来源的κ-卡拉胶酶(在40℃放置1 h,保持70%酶活力)[30]、Zobelliasp.ZM-2来源的κ-卡拉胶酶(在45℃放置15 min,约有20%酶活力)[31]。
2.3.2 重组κ-卡拉胶酶的最适反应pH 在不同pH条件下测定重组κ-卡拉胶酶的活力,结果如图5 所示,重组酶在Na2HPO4-NaH2PO4缓冲液(pH 8.0)时活力最高,而且相同pH 时,在Na2HPO4-NaH2PO4缓冲液中的酶活力比Tris-HCl 缓冲液中高,这可能是因为Na+对酶活力有促进作用。另外,重组酶在pH 7.0~8.0 之间保持了较高的活力,而在pH 3.0 和11.0 时基本没有活力。 来源于海洋细菌Pseudoalteromonas porphyrae[23]和Vibriosp. CA-1004[32]的κ-卡拉胶酶的最适pH 均为8.0,与本研究中菌株JMUZ2的κ-卡拉胶酶的最适pH相同。
2.3.3 金属离子对重组κ-卡拉胶酶活性的影响
不同金属离子对κ-卡拉胶酶稳定性的影响见图6。从图中可以看出,K+对重组酶基本没有影响,低浓度的Na+对κ-卡拉胶酶也没有影响,但高浓度时有促进作用。Mn2+、Mg2+、Al3+、Ba2+、Ca2+、Cu2+、Fe2+、Fe3+和Zn2+对重组κ-卡拉胶酶表现出不同程度的抑制作用,高浓度的Cu2+、Fe2+和Fe3+对重组酶的抑制作用最显著。Liu等[31]的研究结果同样发现K+和Na+对来源于Zobelliasp. ZM-2 的κ-卡拉胶酶活性没有影响,而Cu2+对该酶的抑制作用很显著。
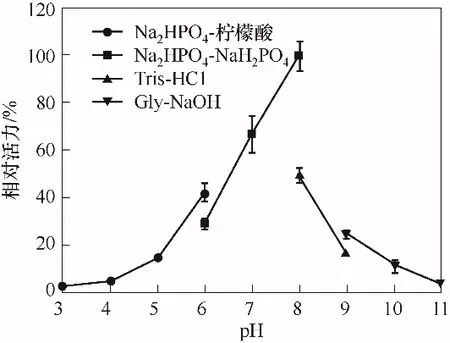
图5 pH对重组κ-卡拉胶酶活性的影响Fig.5 Effect of pH on the activity of the recombinant κ-carrageenase
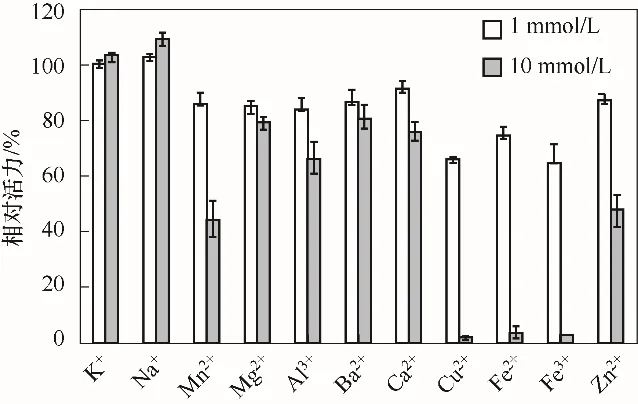
图6 金属离子对重组κ-卡拉胶酶活性的影响Fig.6 Effects of metal ions on the activity of the recombinant κ-carrageenase
2.3.4 添加试剂对重组κ-卡拉胶酶活性的影响
从表1 可以看出,EDTA 对κ-卡拉胶酶没有抑制作用。EDTA 是一种螯合剂,可以清除二价阳离子并使金属离子依赖性酶失活,因此,本文中的重组κ-卡拉胶酶不是金属离子依赖性酶。还原试剂β-巯基乙醇和DTT 对重组酶有抑制作用,硫醇还原剂可以作用于二硫键,改变酶的构象从而改变酶的活性。重组酶对Tween 20、Tween 80 和Triton X-100具有良好的抵抗能力,CTAB 和SDS 对κ-卡拉胶酶表现出强烈的抑制作用。另外,重组酶对2.5 mol/L的尿素和盐酸胍变性剂具有一定的抵抗能力,这些性质使该酶在工业应用中具有一定潜力。

表1 添加试剂对重组κ-卡拉胶酶活性的影响Table 1 Effects of additives on the activity of the recombinant κ-carrageenase

图7 重组κ-卡拉胶酶的双倒数图Fig.7 The Lineweaver-Burk of the recombinant κ-carrageenase
2.3.5 重组κ-卡拉胶酶的动力学参数 利用Lineweawer-Burk 双倒数法测定κ-卡拉胶酶的动力学参数,结果如图7 所示,计算获得酶的Km和Vmax分别为1.0 mg/ml和32.8 U/mg。
2.4 κ-卡拉胶的酶解终产物鉴定
利用LC-MS 在负离子模式下检测κ-卡拉胶的酶解产物,在2.85 min出现吸收峰[图8(a)],对该出峰时间物质进行MS 分析,结果如图8(b)所示,在质核比m/z=403.27 处有一个显著的信号峰,为κ-卡拉胶二糖([An-G4S]-),在β-D-半乳糖端带有一个硫酸基团;在m/z=394.30 有一个信号峰,为κ-卡拉胶四糖([An - G4S]2-2),携带两个硫酸基团。综上,假交替单胞菌JMUZ2 重组κ-卡拉胶酶水解κ-卡拉胶的终产物为二糖和四糖,与利用Zobelliasp.ZL-4卡拉胶酶降解κ-卡拉胶的产物一致[33]。
2.5 酶解产物的抗氧化活性
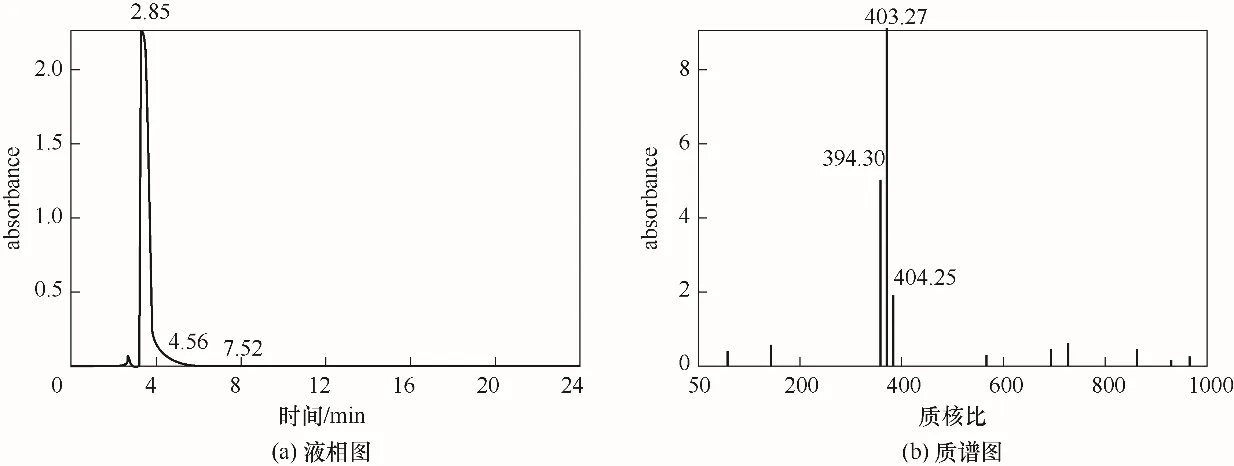
图8 酶解产物的LC-MS分析Fig.8 LC-MS analysis of the enzymatic hydrolysis products

图9 酶解产物的抗氧化活性分析Fig.9 Antioxidant activity analysis of the enzymatic hydrolysis products
对κ-卡拉胶的酶解产物进行抗氧化活性分析,酶解产物清除·OH 自由基的能力是浓度依赖性的,从1 mg/ml 到12.5 mg/ml,酶解产物的自由基清除率显著增加[图9(a)],当产物浓度为12.5 mg/ml 时,对·OH 自由基的清除率达到69%,接近于阳性对照VC的效果。由图9(b)可知,酶解产物对DPPH自由基的清除作用也随着浓度的增大而增强,产物浓度为12.5 mg/ml 时,对DPPH 自由基的清除率达到31%,阳性对照VC的清除率达到80%。由图9(c)可知,随着酶解产物浓度增加,其吸光值不断增大,因此,还原能力不断增强。由图9(d)可知,ABTS 自由基与酶解产物浓度基本呈线性关系。当酶解产物浓度为3.0 mg/ml 时,对ABTS 自由基的清除率达到54%,阳性对照VC的ABTS 自由基的清除率达到89%。酶解产物的抗氧化分析表明,酶解产物具有ABTS、DPPH 和·OH 自由基清除能力以及还原能力,有一定的抗氧化活性,具有作为抗氧化产品的潜力。
3 结 论
本研究将假交替单胞菌的κ-卡拉胶酶进行异源表达、纯化及酶学性质研究,并进行κ-卡拉胶酶解产物的抗氧化活性分析,得出以下结论。
(1)来源于假交替单胞菌JMUZ2的κ-卡拉胶酶属于GH16家族,能专一性降解κ-卡拉胶。
(2)重组κ-卡拉胶酶的最适温度和pH 分别为50℃和8.0,并具有较好的温度稳定性和pH稳定性。
(3)重组κ-卡拉胶酶酶解κ-卡拉胶产生二糖和四糖,酶解产物具有一定的抗氧化活性。
假交替单胞菌JMUZ2 重组κ-卡拉胶酶的酶学性质研究为该酶的进一步性能优化,以及作为工具酶用于κ-卡拉胶寡糖制备及功能研究奠定基础。
