鸡肉中盐酸硫利达嗪的高效液相色谱分析方法
2022-12-22韩晓利刘广兴李昳晴郑佳妍王庭欣
韩晓利,刘广兴,李昳晴,郑佳妍,王庭欣
(河北大学 质量技术监督学院,河北 保定 071002)
盐酸硫利达嗪,化学名称为10-[2-(1-甲基-2-哌啶基)乙基]-2-甲基硫代吩噻嗪盐酸盐,分子式C12H26N2S2·HCl,相对分子质量407.04.结构见图1.盐酸硫利达嗪是一种常见镇静剂,在临床上主要用于抑制中枢神经系统,减弱机体活动,从而消除躁动不安并恢复安静.有些养殖户将盐酸硫利达嗪非法用于畜禽以达催肥及缩短出栏时间,降低运输中死亡率的目的[1].镇静剂残留会造成中枢神经系统损伤,引起体位性低血压、运动障碍、肝损害等[2].农业部176号公告规定,饲料和动物饮用水中禁止使用盐酸氯丙嗪、盐酸异丙嗪、盐酸硫利达嗪、地西泮、苯巴比妥等镇静剂类药物.

图1 盐酸硫利达嗪分子结构式Fig.1 Thiolidazine hydrochloride molecular formula
目前有关镇静剂的检测方法有高效毛细管电泳法[3]、气相色谱-质谱法[4]、液相色谱串联质谱法[5]、免疫学[6]等检测方法.SN/T 2113—2008行业标准规定动物源性食品中镇静剂的检测方法为液相色谱-质谱法/质谱法.虽然液质联用方法检测灵敏度高,但是仪器昂贵,运行成本高,很难在一般实验室进行普及.NY/T 1458—2007规定了饲料中镇静剂的检测方法,对于鸡肉中的镇静剂检测没有相关规定.目前鸡肉中氯丙嗪、氟哌啶醇、阿扎哌醇等的残留及检测方法已有报道[7].鸡肉中镇静剂的检测研究大多集中在样品前处理中,利利[8]以固相萃取技术为前处理方法,测定尿液中苯二氮卓类药物.刘杨[9]论述了液液萃取技术和固相萃取技术的萃取效果,液液萃取技术对药品的提取效率相对较低,而且灵敏度和选择性较低.固相萃取技术具有对环境污染小、试剂量消耗少、乳化少、操作简便等特点[10].本实验采用HLB固相萃取柱净化提取液,结合HPLC法分析鸡肉中盐酸硫利达嗪的含量.建立了一种液相色谱技术检测鸡肉中盐酸硫利达嗪的方法.本方法自动化水平较高,净化水平较好,准确度也较高,可高效地测定鸡肉中盐酸硫利达嗪的含量.
1 仪器与试剂
1.1 仪器
高效液相色谱仪(1260 Infinity Ⅱ,Agilent Technologies);冷冻离心机(FC5718R,奥豪斯仪器有限公司);超声波清洗机(SB25-12DTD,宁波新芝生物科技公司);氮吹仪(TTL-DC,北京同泰联科技公司);固相萃取装置(C18固相萃取柱:500 mg/3 mL,江苏杰岛高新材料科技公司);高通量组织研磨器(SCIENTZ-48,宁波新芝生物科技股份有限公司).
1.2 材料
甲醇、乙腈、甲酸(色谱纯,天津市科密欧化学试剂有限公司);盐酸硫利达嗪(质量分数98.0%,上海源叶生物科技有限公司);乙酸乙酯、正己烷(分析纯,天津市科密欧化学试剂有限公司);水为一级超纯水;鸡肉样品购于保定市惠友超市军校店.
1.3 溶液配制
1.3.1 标准溶液的配制
标准储备液:准确称取盐酸硫利达嗪100 mg,用甲醇溶解至质量浓度为1.0 mg/mL,4 ℃冷藏.
标准工作液:移取适量标准储备液,用中性洗脱液依次稀释配制成标准工作液,质量浓度分别为0.1、0.2、0.5、1.0、2.0、5.0、10.0 μg/mL,现用现配.
1.3.2 其他溶液的配制
体积分数为0.1%的甲酸溶液:将1 mL无水甲酸用超纯水溶解,通过0.22 μm滤膜,超声15 min,现用现配.
洗脱液:体积分数2%氨水的甲醇溶液,将2 mL氨水用甲醇定容至100 mL.
中性洗脱液:取洗脱液97.5 mL,加入2.5 mL无水甲酸混匀,现用现配.
1.4 数据处理
应用Origin 分析软件.
2 实验方法
2.1 仪器条件
色谱条件:Poroshell 120 EC-C18色谱柱(4.6 mm×150 mm,4 μm);流动相:A为0.1%甲酸溶液,B为乙腈,B与A体积比为35∶65;流速:1.0 mL/min;柱温:25 ℃;检测器:二级管阵列检测器;进样量:20 μL;检测波长:262 nm;
2.2 最佳检测波长选择
参考国家标准NY/T 1458—2007,结合文献[11],将液相色谱连接二极管阵列检测器初步确定盐酸硫利达嗪的特征波长262、256、313 nm,分别测定3个特征波长下的峰面积确定最终检测波长.
2.3 流动相的确定
在确定流动相比例时,采取流动相V(乙腈)∶V(甲酸溶液)=28∶72,V(乙腈)∶V(甲酸溶液)=35∶65时进行对比.根据峰型和是否有杂峰确定最佳的流动相比例.
2.4 出峰时间、检测时间的确定
将质量浓度分别为0.2、0.5、2.0 μg/mL的标准工作溶液依次进样,观察出峰时间及峰面积的变化,确定出峰时间及检测时间.
2.5 提取溶剂选择
查阅相关文献[12-13],本实验的前处理中分别用乙酸乙酯和乙腈对相同添加水平的盐酸硫利达嗪鸡肉样品进行提取,观察比较谱图和峰面积,确定最佳提取溶剂.
2.6 样品前处理
样品的提取:将新鲜的鸡肉组织研碎,称取2 000 mg,加入8.0 mL乙酸乙酯,旋涡搅拌,超声提取15 min,9 400 r/min离心,上清液加入2.0 mL正己烷,磁力搅拌5 min,以9 400 r/min离心,吸出正己烷层.向提取后的鸡肉残渣加入8.0 mL乙酸乙酯,按上述操作重复提取2.0次,合并3次提取液,在40 ℃下氮吹至近干,2.0 mL乙腈溶解,超声震荡5 min,加入2.0 mL正己烷涡旋1 min,6 000 r/min 离心 5 min,弃去正己烷层,浓缩液待净化.
样品的净化:将HLB固相萃取柱依次用5.0 mL甲醇和5.0 mL水活化,将提取液转移至HLB固相萃取柱中,流速约为1 mL/min,待提取液全部通过后,保持较强压力抽气2 min.用15 mL酸性乙腈洗脱,将洗脱液40 ℃下氮吹至0.5 mL,加入1.5 mL水,涡旋10 s,过0.22 μm滤膜,供液相色谱测定.
2.7 线性范围和标准曲线
将标准工作液依次从低质量浓度到高质量浓度按确定的色谱条件进样,每个质量浓度测定3次,记录每次的峰面积.以质量浓度为横坐标,以峰面积为纵坐标,利用Origin 2018软件进行拟合,绘制标准曲线,得到线性方程和相关系数.
2.8 检出限和定量限的确定
最低检出限是指在对目标物进行定性时所能检出的目标物的最低含量,最低定量限是指仪器对目标物进行定量时所能定量的最低含量,两者通常用信噪比来衡量.当信噪比(RSN)为3时,盐酸硫利达嗪质量分数为最低检出限,当信噪比(RSN)为10时,盐酸硫利达嗪质量分数为最低定量限[14].
2.9 回收率
在3份相同鸡肉样品中添加盐酸硫利达嗪(添加水平分别为5.0、10.0、20.0 μg/kg),经过相同前处理,进样分析,每个样进6次,得相应峰面积,计算回收率.
回收率=(加标样品测定值-空白样品测定值)×100%.
2.10 精密度
3个添加水平分别为5.0、10.0、20.0 μg/kg的样品,每个样品按已经确定的色谱条件重复进样 6 次,记录峰面积数值,算得精密度.
精密度(RSD)=标准偏差(SD)/计算结果的算术平均值×100%.
2.11 样品中盐酸硫利达嗪含量分析
将2.6小节中处理样品在已确定液相色谱条件下进样3次,观察进样结果.
3 结果
3.1 最佳检测波长的确定
待测样品质量浓度相同条件下,在高效液相色谱测定时检测波长分别设定为262、313、256 nm,在262 nm处检测所得吸收峰面积最大(见表1),最终确定262 nm为盐酸硫利达嗪的检测波长.

表1 盐酸硫利达嗪不同吸收波长和峰面积
3.2 流动相的确定
本实验采用乙腈-甲酸溶液为流动相.2个不同的比例作为流动相进样后得到的谱图如图2所示.由图2可知V(乙腈)∶V(甲酸溶液)=28∶72 作为流动相时,在待测物吸收波长处出现双肩峰,接着出现明显倒峰,峰形较差,信号响应基线不能保持稳定,经优化,在V(乙腈)∶V(甲酸溶液)=35∶65时,待测物峰型较好,附近杂峰较少.最终确定流动相为V(乙腈)∶V(甲酸溶液)=35∶65.
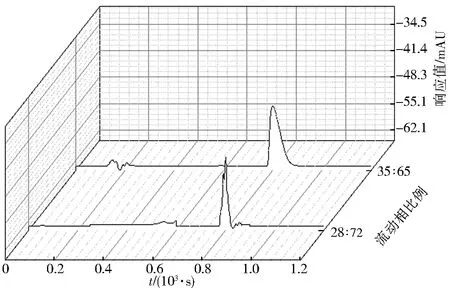
图2 2种流动相比例吸收谱线Fig.2 Absorption spectrum of two mobile phases
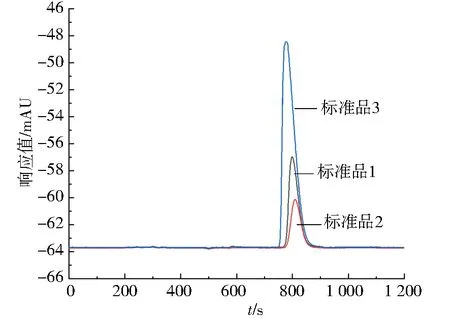
标准品1:0.5 μg/mL;标准品2:0.2 μg/mL;标准品3:2.0 μg/mL图3 3个质量浓度标准品吸收谱线Fig.3 Absorption spectra of three mass concentrations of standard substances
3.3 出峰时间、检测时间的确定
将3个不同质量浓度的标准工作液进样后得到谱图,如图3.将不同质量浓度工作液由低到高依次进样检测.随着标准品质量浓度的增大,待测物峰面积在800 s处随之增大,可得盐酸硫利达嗪检测最佳时间为20 min.
3.4 提取溶剂的确定
将乙酸乙酯和乙腈对相同浓度的盐酸硫利达嗪进行提取,乙酸乙酯提取所得的峰面积(4.325 mAU·s)大于乙腈提取所得峰面积(2.535 mAU·s),提取效果较好,因此选取乙酸乙酯作为盐酸硫利达嗪的提取溶剂.
3.5 线性范围和标准曲线
将标准工作液按已确定的条件进行高效液相色谱分析,每个质量浓度测定3次,得峰面积结果如表2.以不同质量浓度对应的峰面积为纵坐标,质量浓度作为横坐标,绘制标准曲线.经拟合,得线性方程为y=224.5x-0.009 5,相关系数r2=0.999 9,在0.1~10.0 μg/mL内相关性良好,灵敏度为224.5,标准曲线拟合较好.

表2 不同质量浓度下的峰面积数据
3.6 回收率和精密度
3份相同空白鸡肉样品中添加等量不同添加水平的盐酸硫利达嗪,经过相同处理,进样分析,每个添加水平进样6次,得峰面积,计算回收率.见表3.由表3可知3个不同质量浓度加标回收率为89.84%~96.54%,回收率较好,结果满足GB/T 27404—2008的要求,满足实际检测要求.
分析精密度时,采用3个不同添加水平的样品,每个样品重复进样 6 次,记录峰面积数值.计算得盐酸硫利达嗪峰面积的 RSD 为 0.82%、1.05%、1.11%,精密度为0.82%~1.11%,符合含量测定的要求.
3.7 检出限与定量限
当信噪比RSN=3时,计算出盐酸硫利达嗪最低检出限为1.20 μg/kg,当信噪比RSN=10时,计算出盐酸硫利达嗪的最低定量限为4.0 μg/kg.
3.8 样品中盐酸硫利达嗪含量分析
将2 000 mg鸡肉样品进行样品前处理操作,在已确定液相色谱条件下进样3次,得到谱图(图4),由图4可知,鸡肉样品中盐酸硫利达嗪未检出.
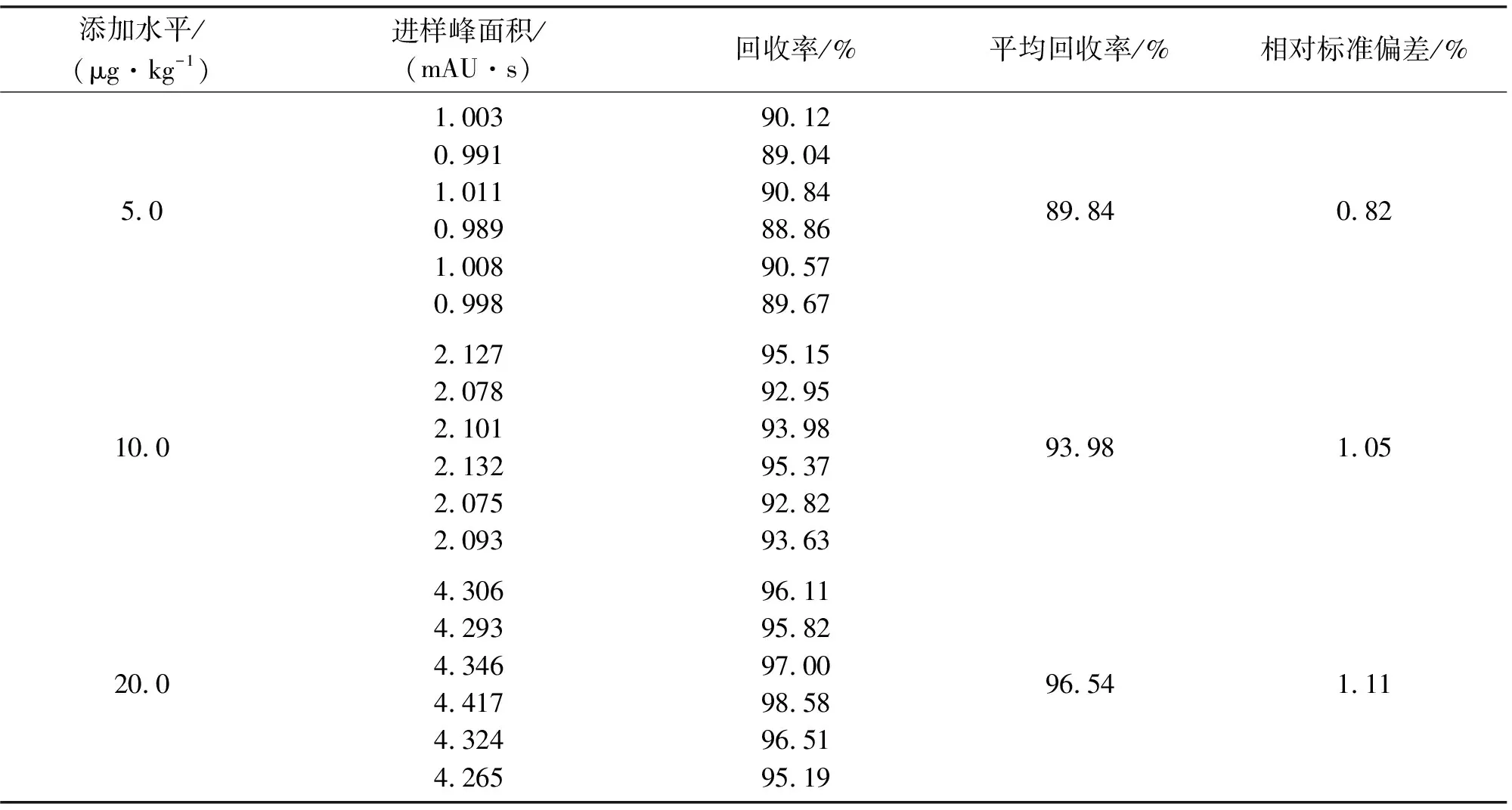
表3 样品不同添加水平的回收率结果
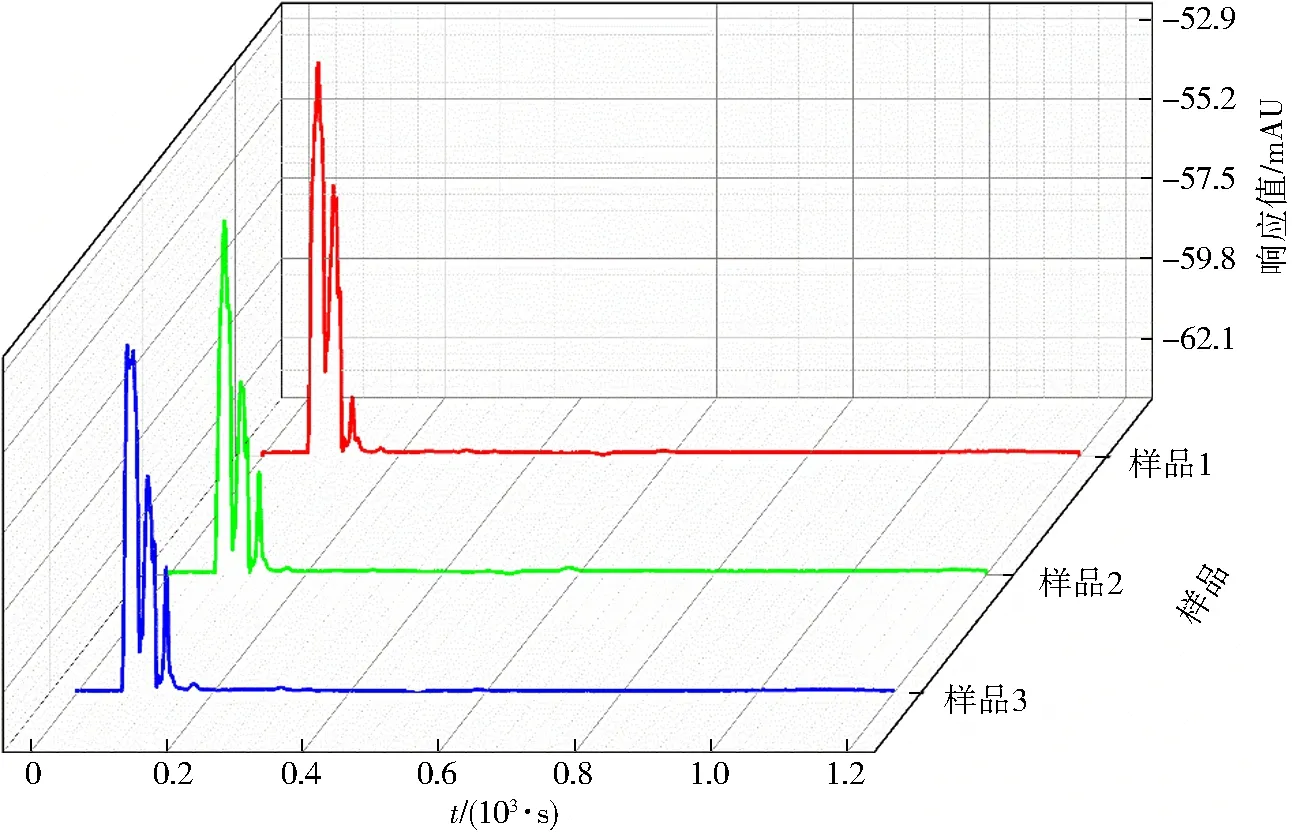
图4 鸡肉样品检测色谱Fig.4 Chromatogram of chicken samples
4 讨论
本研究选择固相萃取结合高效液相色谱技术研究了鸡肉中盐酸硫利达嗪含量的分析方法.在确定盐酸硫利达嗪最佳检测波长时,NY/T 1458—2007标准中,液相色谱条件规定同步测定多种镇静剂时的检测波长为251 nm,并非盐酸硫利达嗪的最佳吸收波长,因此本研究对检测波长进行优化,对比3个特征波长的峰面积,确定最佳检测波长为262 nm;流动相比例的改变会影响出峰效果,优化结果可知,在V(乙腈)∶V(甲酸溶液)=28∶72时,待测物峰出现双肩峰和倒峰现象,峰形较差,在V(乙腈)∶V(甲酸溶液)=35∶65时,峰形对称性好.
对样品前处理条件优化:用乙酸乙酯和乙腈分别提取含有相同含量的盐酸硫利达嗪鸡肉样品,结果发现,样品经乙酸乙酯提取后,进样测得的峰面积更大,即提取效果更好,所以确定乙酸乙酯为最佳提取剂,与许世富[15]提取猪肉中氯丙嗪方法中的提取效果具有一致性.固相萃取技术具有简单方便、样品净化效果好、回收率高等优点,经萃取净化后可直接用于液相色谱检测[16-17].
在最佳前处理和色谱条件下,选择更简单准确的外标定量分析方法[18]进行测定.通过外标法建立的盐酸硫利达嗪高效液相色谱检测方法,标准曲线线性关系良好,灵敏度高,精密度为0.82%~1.11%,加标回收率为89.84%~96.54%,回收率满足GB/T 27404—2008的要求.此实验方法成本低,且操作简单,易实现,可作为小型实验室检测鸡肉中盐酸硫利达嗪残留量的方法推广应用.
