免疫性肝损伤大鼠肠道菌群的变化及肠黏膜屏障损伤研究*
2022-12-21陈建芳赵利美贾彦彬
闫 艳,陈建芳,赵利美,贾彦彬,顾 丽
(内蒙古科技大学包头医学院,内蒙古 包头 014040)
免疫性肝损伤是指由机体的免疫应答所导致的肝细胞病变,引发免疫性肝损伤的原因中最常见的是乙型肝炎病毒(Hepatitis B virus,HBV)的感染,由乙型肝炎病毒感染引起的乙型肝炎是一种传染性强、分布广、发病率高的传染性疾病,严重危害着人类的健康。
肠道菌群是宿主微生物群的重要组成部分,肠道定植的细菌数量约占人体总微生物数量的78 %,不仅在宿主营养、免疫、抗衰老等诸多方面发挥着极为重要的作用,而且具有生物拮抗作用,能抵御外来致病菌的入侵与定植。近年来,由于对肠-肝轴认识的逐步深入,肠道菌群在慢性肝病发病过程中的作用备受关注。研究人员发现并证实了酒精性肝损伤肠道菌群的变化及益生菌的保护作用,但对于免疫性肝损伤后肠道菌群和肠黏膜屏障是否受到影响报道甚少。
本实验通过16S rDNA测序分析方法探讨免疫性肝损伤大鼠肠道菌群及肠黏膜屏障的变化,分析免疫性肝损伤对肠道菌群及肠黏膜屏障的影响,为乙型肝炎的辅助治疗提供思路和依据。
1 材料与方法
1.1动物 雄性SD大鼠16只,体质量180~210 g(购于北京生物制品检定研究所,动物合格证号:SLB112018100909162330),适应性饲养1周,5只为1笼,喂饲普通颗粒饲料,每日傍晚定时投食、加水均不限量,垫料每3 d更换1次。自然采光,恒定室温23 ℃。
1.2试剂 BCG冻干粉(每支50 mg)活菌数为100万/mg(上海瑞楚生物);二胺氧化酶DAO检测试剂盒及D-乳酸(D-LA)检测试剂盒(南京建成生物工程研究所)。
1.3主要仪器 SW-CG-1FD超净台(上海新苗医疗器械制造有限公司);L-530离心机(长沙湘仪离心机仪器有限公司);752N型紫外可见分光光度计(上海精密科学仪器有限公司);DNM-9602酶标仪(北京普朗医疗设备有限公司);全自动生化分析仪(日本日立)。
1.4动物分组及模型建立 大鼠在清洁条件下适应性喂养1周,自由饮水进食,将大鼠随机分为免疫性肝损伤模型组(M组)和正常对照组(C组),每组8只。M组经尾静脉注射卡介苗125 mg/kg(BCG,含活菌5×107),对照组为静脉注射等量生理盐水。正常饲养14 d,制备免疫性肝损伤大鼠模型。
1.5样本采集 实验过程中观察各组大鼠存活状态,包括大鼠的状态、活动、毛色、摄食等方面情况变化,每周称重1次。通过按摩大鼠腹部,刺激大鼠排便,用灭菌镊子夹取大鼠粪便,迅速转移至干燥无菌瓶中,-80 ℃冰箱保存。戊巴比妥钠30 mg/kg麻醉大鼠,沿腹中线打开腹腔,腹主动脉采血5 mL,静置30 min,3 500 r/min离心10 min,分离血清,分装于无菌EP管中,冻存于-80 ℃冰箱中。剖取肝脏、脾脏,称重,将部分肝组织浸泡于事先配好的固定液中。计算肝脏指数和脾脏指数。公式为:肝脏指数( %)=肝脏重量(g)/体重(g)×100 %,脾脏指数( %)=脾脏重量(g)/体重(g)×100 %。
1.6肝组织病理学观察 取肝组织1 cm×1 cm×0.5 cm,10 %甲醛固定,常规石蜡包埋,切片、染色,光学显微镜观察。取上述各组大鼠血清,使用自动生化分析仪进行血清肝功能谷丙转氨酶(Alanine transaminase,ALT)、谷草转氨酶(Aspartate transferase,AST)检测。
1.7肠黏膜屏障功能检测 利用DAO检测试剂盒,D-乳酸检测试剂盒检测血清DAO、D-LA水平。操作步骤严格按说明书进行。
1.8粪便肠道菌群高通量测序 采集的粪便标本集中干冰运输至杭州联川生物公司,对16S rDNA V3~V4区域进行高通量测序,利用测序平台Illumina Miseq 2×300,进行大鼠肠道菌群测序及生物信息学分析。
2 结果
2.1动物存活状态 正常对照组大鼠食欲旺盛,活动正常,毛色洁白有光泽,体质量增加;模型组大鼠给药后5~7 d,开始出现活动迟缓,精神萎靡,容易激惹,毛色无光泽蓬松、竖立,呈现病态。
2.2动物体重、肝脏指数、脾脏指数、肝功能及肠黏膜损伤指标变化 结果显示,与正常对照组比较,免疫性肝损伤大鼠体重变化不明显(P=0.119),肝脏系数和脾脏系数增加,血清AST和ALT数值上升(P<0.01);模型组血清DAO、D-LA水平高于对照组(P<0.01)。见表1。
表1 两组大鼠体重、肝脏指数、脾脏指数、AST、ALT、DAO、D-LA比较
2.3病理组织学检查 对照组大鼠肝组织细胞大小一致,排列有序,以中央静脉为中心呈放射性、条索状排列,肝窦结构正常无狭窄,小叶及汇管区未见炎性细胞浸润(图1);注射BCG 2周后,大鼠肝脏轻度肿胀,镜下见部分肝细胞排列紊乱,部分肝细胞变性、坏死,肝实质及汇管区有炎症细胞浸润及纤维组织增生,形成以肉芽肿团块为特征的肝损伤改变(图1)。
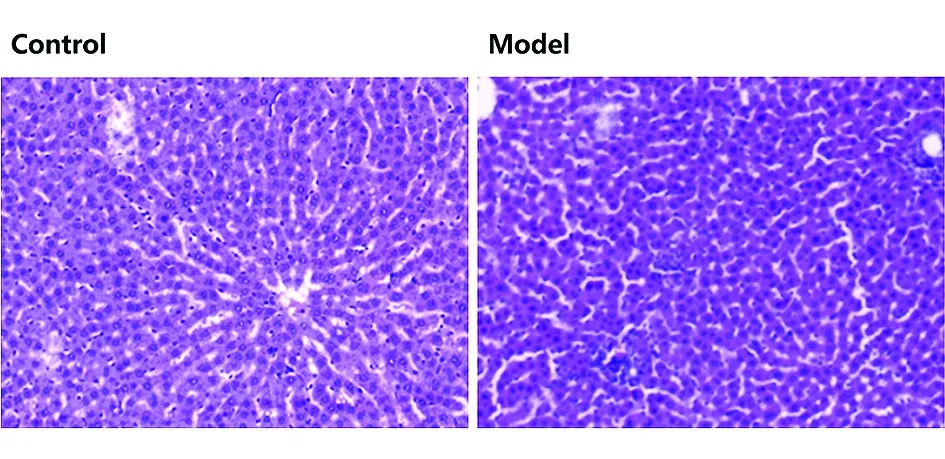
图1 肝脏病理学(HE×200)
2.4粪便肠道菌群16S rDNA高通量测序分析
2.4.1肠道菌群丰度和样本文库覆盖率分析 小提琴图(Violin Plot)显示数据分布及其概率密度(图2),Chao1指数主要反映样本的物种丰富度信息;从结果可以看出免疫性肝损伤大鼠与正常对照组肠道菌群丰富度差异无统计学意义(P=0.8)。样本文库覆盖率评估Goods_coverage反映样本的低丰度OTU覆盖情况,衡量样本取样深度,结果表明两组样本的Goods_coverage都接近98 %(P=0.96),提示测序深度能够覆盖该微生物群落中绝大多数细菌。

图2 alpha多样性分析Chao1、Goods_coverage小提琴图
2.4.2肠道菌群多样性分析 Shannon、Simpson指数评估各组样本间的菌群的多样性(图3),结果显示,免疫性肝损伤大鼠肠道菌群多样性增加,各组间差异有统计学意义(ShannonP=0.0011,SimpsonP=0.0016)。
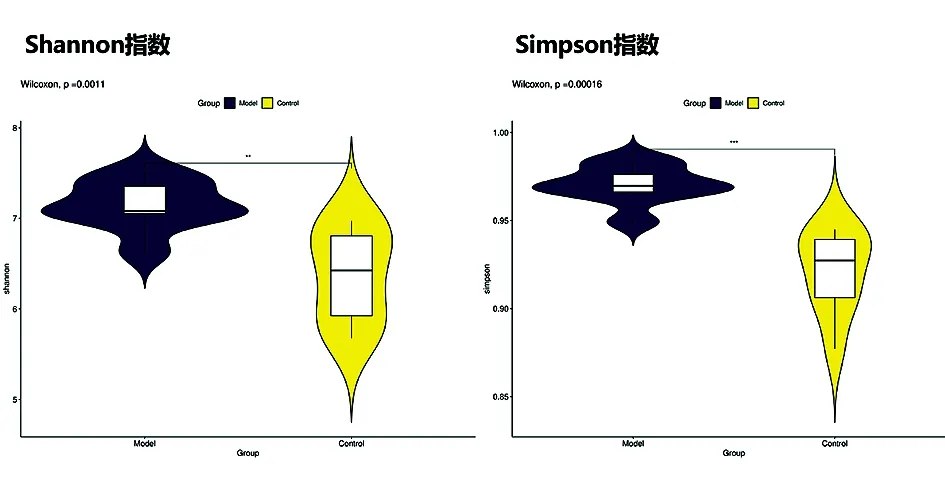
图3 alpha多样性分析Shannon、Simpson小提琴图
2.4.3肠道菌群在门分类水平上构成差异比较 研究发现,两组大鼠肠道菌群在门分类水平上分属11个菌门,优势菌门主要为厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)。与正常对照组比较,模型组肠道菌群中厚壁菌门丰度下降(P<0.05),而变形菌门(Proteobacteria)和放线菌门(Actinobacteria)丰度增加(P<0.05)。见表2。门水平各样本细菌丰度见图4。

图4 门水平各样本大鼠肠道菌群丰度分布
2.4.4肠道菌群在属分类水平上构成差异比较 研究结果显示,正常组和对照组共检测到167个菌属,其中模型组检测到146个菌属,模型组共检测到163个菌属,共有组分142菌属,两组的优势菌属主要包括乳酸杆菌属(Lactobacillus)、普雷沃菌属(Prevotella)以及紫菜科(Porphyromonadaceae_unclassified)菌属,与正常对照组比较,占比在前20个菌属中,模型组有4个菌属细菌丰度增加(P<0.05),包括瘤胃球菌属(Ruminococcaceae)、拟普雷沃菌属(Alloprevotella)、布劳特氏菌(Blautia)、帕拉普氏菌属(Paraprevotella),2个菌属丰度下降(P<0.05),包括乳酸杆菌属(Lactobacillus)、毛螺旋菌属(Lachnospiraceae),差异具有统计学意义。见表3。属水平两组样本细菌丰度见图5。
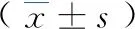
表2 肠道菌群门水平丰度分析
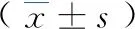
表3 肠道菌群属水平丰度分析
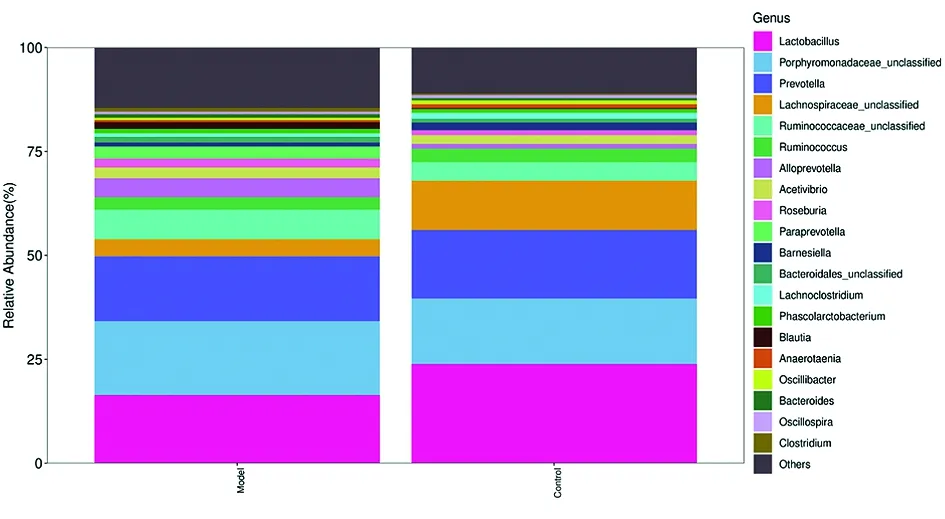
图5 属水平两组大鼠肠道菌群丰度分布
3 讨论
免疫性肝损伤是由多种因素引发的机体免疫应答介导的炎症反应及其引起的肝实质和肝功能的损伤。研究表明,在自身免疫性肝病、病毒性肝炎、酒精性及非酒精性肝病及药物性肝损害等病理过程中,均存在不同程度的免疫性肝损伤[1]。其中最常见的诱因是由乙型肝炎病毒(Hepatitis B virus,HBV)感染后引起的肝细胞病变。随着病程的迁延慢性乙型肝炎常常导致肝纤维化、肝硬化、肝癌等严重疾病,成为我国突出的公共卫生问题。
肠道充满微生物,包括细菌、真菌、原生动物、古细菌和病毒。而在这些微生物中,占据了绝大部分数量的是细菌。肠道菌群与宿主的消化、吸收、代谢、神经内分泌调节以及肠免疫功能形成密切相关。
肝脏和肠道具有非常密切的关系,Marshall在1998年第一次提出了“肠-肝轴”的概念,肝脏和肠道共同起源于胚胎结构,肝脏70 %的血液供应来源于肠道,肠-肝轴之间相互作用和相互影响,越来越多的研究表明肠道菌群在肝脏疾病的发病中起重要作用[2-3]。
本研究按照文献报道采用卡介苗诱导免疫性肝损伤模型[4],结果发现与正常对照组相比,免疫性肝损伤大鼠模型组ALT和AST均显著升高。ALT和AST可以反映肝细胞膜稳定性,其在血清中的含量与肝细胞受损程度密切相关。肝脏组织病理学改变显示模型组出现以炎性细胞浸润、炎性肉芽肿形成、肝细胞索结构破坏为特征的改变。该模型稳定,重现性良好,为免疫性肝损伤提供理想的实验动物模型[5]。
DAO的变化反映肠黏膜屏障完整性和受损程度,DAO是一种存在于小肠黏膜上层绒毛中的细胞酶,当小肠黏膜组织结构受损时,可大量进入血液。D-LA是肠道细菌的酵解产物,因感染、缺血及创伤性休克引起肠道功能障碍均导致其血中浓度升高,是反映肠道通透性并可预测感染性休克的发生的一项指标[6]。本研究发现免疫性肝损伤大鼠血清DAO和D-LA升高,提示模型组肠黏膜屏障受损,肠道通透性升高。
高通量测序可同时对几百万个DNA进行测序,在短时间能获得大量数据。可以把粪便标本中用常规方法不能培养出来的肠道微生物鉴定出来。有利于对肠道微生物群整体多样性、复杂性和动态性进行观察[7]。本研究通过对正常对照组和模型组大鼠粪便菌群检测,发现模型组大鼠粪便的菌群组成结构与正常组有明显的差异性。通过Shannon、Simpson指数评估各组样本间的菌群的多样性,结果显示,免疫性肝损伤大鼠肠道菌群多样性增加,提示模型组细菌过度生长。此结果与王春妍等[8]采用硫代乙酰胺所致急性肝损伤大鼠肠道菌群的变化报道一致。从门水平分析,与正常组比较,模型组大鼠肠道菌群中厚壁菌门丰度下降,而变形菌门(Proteobacteria)和放线菌门(Actinobacteria)丰度增加。有研究表明厚壁菌门是肠道菌群的重要组成部分,大多为革兰氏阳性菌,在调节和维持宿主免疫系统稳定方面发挥重要作用;变形菌门是细菌中最大的一门,为革兰氏阴性细菌,包括多种病原菌,如大肠埃希菌、伤寒沙门氏菌、霍乱弧菌等。实验证实肠道菌群中变形菌门增加提示宿主肠道微生物群落的不稳定性。基于两者之间的关系,有学者提出以变形菌门增加作为衡量肠道菌群失调的生物性标志[8]。本研究中模型组大鼠肠道菌群放线菌门增高,此结果与范银银等[9]在四氯化碳诱导的小鼠肝纤维化肠道菌群的变化报道一致。
从属水平分析大鼠肠道菌群组成,居于前20位的菌属中,模型组大鼠乳酸杆菌属(Lactobacillus)、毛螺旋菌属(Lachnospiraceae)丰度低于正常对照组。而瘤胃球菌属(Ruminococcaceae)、拟普雷沃菌属(Alloprevotella)、布劳特氏菌(Blautia)、帕拉普氏菌属(Paraprevotella)丰度高于正常对照组。乳杆菌属属于厚壁菌门,是存在于人体内的重要益生菌。毛螺旋菌的丰度变化与肠道菌群失衡有密切关系,在对比肝硬化患者与健康人肠道菌群的研究中发现毛螺旋菌属(Lachnospiraceae)减少,研究者认为这可能影响了疾病的临床表现及预后[10]。多项研究表明瘤胃球菌属(Ruminococcus gnavus)与多种肠道炎症相关,活跃期炎症性肠病(IBD)通常伴随着瘤胃球菌的增加。非酒精性脂肪性肝炎患者瘤胃球菌属丰度亦升高[11]。拟普雷沃菌属(Alloprevotella)以及帕拉普氏菌属(Paraprevotella)是近期发现的细菌种类,其在肝损伤的作用报道甚少,对其作用需进一步研究。布劳特氏菌(Blautia)大量研究集中在该属的益生菌作用上,认为其是一类具有益生菌特性的厌氧菌,广泛存在于哺乳动物的粪便和肠道中。模型组该菌数量增加,此结果与严宝飞团队[12]研究非酒精性脂肪性肝大鼠肠道菌群中布劳特氏菌(Blautia)菌属丰度低于正常对照组的结果不一致,是否为代偿性增加或模型差异,值得进一步探讨。
现代研究认为肠道与肝脏相互作用,相互影响。居于肠道中的菌群产生的多种活性代谢产物及营养物质如维生素、叶酸、烟酸等,经由肝脏代谢,从而合成人体所需的诸多物质;同时肝脏具有强大的解毒功能,将肠道细菌产生的有害物质进行代谢清除。当正常的肝脏结构和功能遭到破坏时很可能造成肠道功能障碍、肠道菌群失衡。而当肠黏膜屏障受损时,肠源性内毒素通过血流进入肝脏,加重了对肝脏损害。因此肠道微生态和肝脏二者相互作用,互为因果。
本研究结果显示,采用卡介苗诱导的免疫性肝损伤大鼠存在黏膜屏障受损,肠道菌群失调,革兰阴性杆菌过度生长现象,提示肝脏损伤会引发肠道菌群和肠黏膜屏障发生改变,为深入研究利用益生菌或其他方法改善肠道微生物群的结构和组成,从而改善因免疫性肝损伤造成的疾病的进展提供理论和实验支持。
