g-C3N4/Cu-TiO2纳米球的制备及在紫外辅助芬顿中的催化性能表征
2022-12-19孟汝浩班新星左宏森栗正新邵俊永孙冠男郝素叶韩少星张国威周少杰
孟汝浩,班新星,左宏森,李 跃,栗正新,邵俊永,孙冠男,郝素叶,韩少星,张 霖,张国威,周少杰
(1. 河南工业大学 材料科学与工程学院,郑州 450001;2. 郑州磨料磨具磨削研究所有限公司,郑州 450001;3. 白鸽磨料磨具有限公司,郑州 450001)
0 引 言
芬顿反应作为高级氧化反应(AOPs)中的一种,常常用于污水处理、降解废物等环境工程领域。近些年来随着电子科技的进一步发展,有研究[1]表明,羟基自由基可以在第三代半导体SiC的超精密抛光中发挥作用,其可以与SiC晶圆表面反应产生氧化反应生成较软的SiO2,从而提高加工速率与抛光精度。但其只能在较窄pH范围内进行高效的反应效率,并且氧化剂H2O2在传统的芬顿反应过程中产生大量的超氧自由基(·O2-)和氧气,导致难以选择性生成羟基自由基,导致氧化效率变低。近年来,针对如何提高芬顿效应反应速率,研究人员开发了超声芬顿、电助芬顿、光助芬顿等辅助芬顿反应方式。其中光助芬顿因其操作简单且反应过程中没有其他有毒有害物质生成,应用最广泛。
TiO2因其无毒性、耐腐蚀性以及良好的光催化稳定性被认为是近代最有潜力的光催化材料,大量广泛应用在光助芬顿反应过程中,起催化剂作用,但因为其带隙较宽(3.0~3.2 eV)且光生电子与空穴复合速度过快,导致单一的TiO2在光催化过程中效率不高[2-3]。研究人员通过在TiO2上负载贵金属[4-5](Pt,Pd,Au等)、非贵金属[6-7](Cu,Ni,Co等)、窄带隙半导体[8-9]和非金属物质[10-11]来减弱单一TiO2光催化过程中光生载流子的重组,以此来提高光催化效率。其中Cu因其价格低廉,且催化效率高,是光催化过程中最理想的催化助剂之一。同时有研究[12]表明,Cu2+/Cu+之间的相互转化可以催化H2O2分解产生大量的羟基自由基,以此来提高芬顿反应过程中的催化效率。
近些年来,石墨相氮化碳因其良好的光学性能受到研究人员的广泛研究,其具有类似于石墨的层片状结构,且在较大pH范围内具有良好稳定性。其基本结构为三嗪环与3-s-三嗪相互堆叠构成,其C与N之间sp2轨道杂化,类似于苯环的π键共轭结构,在此共轭结构下,g-C3N4具有良好的导电性,成为修饰光催化材料的优良载体[13-14]。基于此,本文从提高紫外辅助芬顿效应效率出发,利用一步法与水热法制备g-C3N4/Cu-TiO2类芬顿催化剂,并在紫外光条件与芬顿体系共同作用催化降解罗丹明B与亚甲基蓝。同时通过扫描电子显微镜(SEM)、X射线衍射仪(XRD)、漫反射光谱(UV-Vis)、电阻抗能谱(EIS)等手段对g-C3N4/Cu-TiO2进行表征。分别考察了初始pH、H2O2添加量、催化剂用量、Cu的掺杂量、g-C3N4的掺杂量对催化降解的影响,并优化反应条件;评价催化剂的重复使用性能;通过自由基猝灭,表征催化反应过程中其主要氧化作用的物质;探讨g-C3N4/Cu-TiO2类芬顿催化剂在紫外光条件下催化反应的机理。
1 实 验
1.1 主要试剂
钛酸四丁酯(TBOT,>99%)、三水合硝酸铜(Cu(NO3)2·3H2O,99%)、十八胺(ODA,≥97%)、三聚氰胺(C3H6N6,99%)、罗丹明B(RhB,>99%)、对苯醌(PBQ,97%)、异丙醇(IPA,>99%)、乙二胺四乙酸二钠(EDTA-2Na)、溴酸钾(KBrO3,99.99%)、无水乙醇,试剂均购于阿拉丁。试验用水为实验室自制去离子水。
1.2 主要试验仪器
MINIFLEX600型X射线衍射仪(XRD,日本株式会社理学,辐射源为Cu Kα,步长为0.02°/min,2θ=10°~90°);PHENOM PROX型扫描电子显微镜(SEM,FEI公司);IS20型傅里叶变换红外光谱分析仪(FT-IR,美国赛默飞世尔科技有限公司,以KBr做参比物);UV2550型紫外-可见漫反射光谱仪(UV-Vis DRS,日本岛津公司,BaSO4为参比物)。电化学工作站(CHI660D,上海辰华仪器有限公司),荧光光谱仪(F-7000,日立公司)。
1.3 g-C3N4/Cu-TiO2的制备
1.3.1 g-C3N4的制备
取一定量的三聚氰胺,置于带盖的刚玉坩埚内。将坩埚半敞口放置在马弗炉内,5 ℃/min升温至550 ℃煅烧3 h,随炉冷却至室温。取出在玛瑙研钵内研磨30 min,得到淡黄色g-C3N4粉末。
1.3.2 g-C3N4/Cu-TiO2纳米球的制备
称取5g TBOT置于100 mL烧杯内,加入60 mL无水乙醇搅拌均匀,另称取0.1360 g Cu(NO3)2·3H2O加入其中制得A液。称取0.730g ODA与30 mL无水乙醇充分搅拌,后加入3.1 mL去离子水,在磁力搅拌条件下搅拌20 mL,制得B液。
将A液置于磁力搅拌器上室温搅拌30 min,然后在强磁搅拌下逐滴加入B液,继续强磁搅拌8 h,然后密封条件下室温陈化24 h。将陈化后的样品放置在80 ℃得干燥箱中干燥8 h,然后将样品转移至刚玉坩埚中,在马弗炉内500 ℃煅烧3 h,随炉冷却后充分研磨,得到1% Cu-TiO2的样品。其余纯TiO2、3% Cu-TiO2、5% Cu-TiO2、7% Cu-TiO2、9% Cu-TiO2均由此法获得。通过表征二元复合催化剂得到其中7% Cu-TiO2在紫外条件下的催化活性最高,因此,将7% Cu-TiO2与不同质量分数的g-C3N4加入到60 mL去离子水中,超声分散60 min,得到混合溶液,然后转移到聚四氟乙烯内衬的反应釜中140 ℃反应10 h。g-C3N4的质量分数为10%、30%、50%、70%、90%,以此命名为10% g-C3N4/Cu-TiO2、30% g-C3N4/Cu-TiO2、50% g-C3N4/Cu-TiO2、70% g-C3N4/Cu-TiO2、90% g-C3N4/Cu-TiO2。
1.4 光催化性能测试
试验以罗丹明B(RhB)褪色程度与速率对催化剂光催化性能进行表征。配置100 mL、25 mL/L RhB溶液,将20 mg催化剂均匀分散在溶液中,在黑暗条件下进行暗吸附30 min,使其达到吸附-脱附平衡。再将溶液取出加入0.1 mL 30%H2O2,随即放置在400 W高压汞灯下反应。每隔10 min取5 mL上层样品,将样品6 000 r/min离心20 min,取出上清液,在紫外-可见分光光度计(UV-Vis,日本岛津公司)中测定其吸光度,计算RhB浓度随时间变化的关系。将反应后的溶液离心、真空干燥,获得g-C3N4/Cu-TiO2,并按照上述实验进行3次,对催化剂的重复利用性能进行测试。利用NaOH和HNO3对样品进行pH调节,重复上述试验,对催化剂适用pH范围进行表征。
1.5 光电性能测试
试验在电化学工作站进行,采用三电极对催化剂进行光电性能测试,分别是pt丝、甘汞电极与工作电极,工作电极为滴加在ITO玻璃上的分散在乙醇中的10 mg催化剂。待ITO玻璃烘干后,将三电极同时放入饱和的NaSO4溶液中,测试其样品阻抗,并在400 W高压汞灯下对其进行光电流响应测试。
1.6 光催化机理探索
在四组试验反应体系中分别加入异丙醇(IPA)、对苯醌(BQ)、乙二胺四乙酸二钠(EDTA-2Na)和溴酸钾(KBrO3)1 mmol,作为羟基自由基(·OH)、超氧自由基(·O2-)、空穴(h+)和电子(e-)的捕获剂,找出反应中主要的活性物质,对反应机理进行进一步探索。
2 结果与讨论
2.1 催化剂的结构形貌表征
图1是不同配比的Cu-TiO2和C3N4/Cu-TiO2的XRD图谱。从图1(a)中可以看出,纯TiO2样品在2θ分别为25.3°、37.8°、48.0°、53.9°、55.0°、62.6°、68.8°、70.3°、75.1°时存在特征峰,依次对照锐钛矿相TiO2(PDF No. 076173)的(101)、(004)、(200)、(105)、(211)、(204)、(116)、(220)、(215)晶面。在少量的Cu掺杂后,各组分样品TiO2的结晶程度有所提高,但在XRD检测中并未发现有Cu的产生,Cu极有可能以Cu2+的形式进入了TiO2晶格中。在掺杂了Cu后,各样品中均发现了少量的金红石相,并且TiO2锐钛矿相各峰均有少量偏移,表明少量的Cu2+在结晶过程中确实进入了TiO2的晶格中,发生了晶格畸变,使得锐钛矿相的TiO2向更稳定的金红石相发生相变。随Cu含量的提升,金红石相的含量在7% Cu-TiO2最少,且结晶程度最高。在光催化领域,金红石相由于太过于稳定,在光照下的催化作用较低[15],因此可以预测7% Cu-TiO2在同组样品中表现出最高的催化活性。从图1(b)中可得到,纯g-C3N4在2θ为13.3°与27.7°时存在特征峰,这两个主衍射峰分别为g-C3N4的(100)和(002)晶面[16],其对应峰强随负载量增加依次增加,且各相峰没有偏移,证明成功制备获得g-C3N4/Cu-TiO2复合粉体。
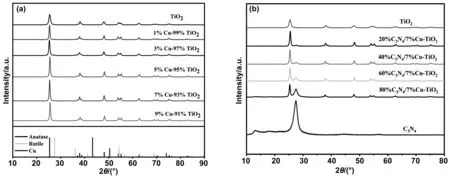
图1 (a)Cu-TiO2的XRD图谱;(b)g-C3N4/7% Cu-TiO2的XRD图
图2为7% Cu-TiO2和不同组分的C3N4/7% Cu-TiO2的FTIR图。从图中可以看出g-C3N4的FTIR图谱可以发现在80 cm-1处以及1 200~1 650 cm-1有较强的吸收峰。805 cm-1为三嗪环状化合物的吸收峰[17-18]。1 329~1 635 cm-1处的对应 g-C3N4中芳香杂环化合物的C-N和C=N的伸缩振动特征吸收峰[19-20]。1 000 cm-1以下的较宽的吸收区为Ti-O-Ti的伸缩振动,随着g-C3N4的组分含量增加,其吸收强度逐渐成比例减弱,且三相复合后并未有新相生成,说明复合催化剂的结构并未发生改变。

图2 7%Cu-TiO2和不同组分的g-C3N4/7% Cu-TiO2的FTIR图

图3 样品的SEM图像:(a)7% Cu-TiO2;(b)g-C3N4;(c)60% g-C3N4/7% Cu-TiO2;(d-h)60% g-C3N4/7% Cu-TiO2的EDX能谱图:Ti(e),C(f),N(g),Cu(h)
图3为7% Cu-TiO2、g-C3N4以及60% g-C3N4/7% Cu-TiO2的SEM图以及60% g-C3N4/7% Cu-TiO2的EDX能谱图。从图3(a)中可以看到,所合成的7% Cu-TiO2为球状纳米颗粒,其平均直径在90~100 nm之间,边缘清晰,存在大量的团聚现象,这是因为纳米颗粒表面能量高,比表面积大导致的。从图3(b)中看到,g-C3N4呈鳞片状的片层结构,这与石墨具有相似的结构,是类似于石墨烯的薄纳米片。图3(c)为60% g-C3N4/7% Cu-TiO2的SEM图,从图中可以看出,Cu-TiO2负载在g-C3N4的层状结构上,为了更直观的看到其中的物相分布,对其中一片区域(图3(D))进行了EDX能谱扫描,从结果可以看到,Ti、C、N元素均匀的分布在该区域,且存在有少量的Cu元素,证明成功制备获得 g-C3N4/Cu-TiO2纳米球。
2.2 催化剂的光学特性表征
图4为不同组分的g-C3N4/7% Cu-TiO2的UV-VIS DRS光谱及带隙图,从图3(a)可以看到,掺7% Cu-TiO2相较纯TiO2的紫外光吸收有所提升,且负载了Cu的样品在可见光区域也有一定的吸收强度,提高了TiO2的光响应范围。与纯g-C3N4相比,复合后的样品紫外吸收强度有逐渐加强,在少量g-C3N4存在时,提升并不明显,这是由于过量纳米粒子负载在g-C3N4,纳米粒子的严重团聚导致样品并不能充分的对光进行吸收,80% g-C3N4/7% Cu-TiO2的紫外光吸收强度减弱也是因为这种原因。60% g-C3N4/7% Cu-TiO2组样品最高,这是因为在均匀复合一定量的Cu-TiO2后,Cu-TiO2纳米粒子均匀分布在层片状g-C3N4上,形成了异质结结构,从而拓宽了光响应范围,增大了吸收强度[21]。同时,根据Kubelka-Munk公式[22]计算了TiO2、Cu-TiO2和g-C3N4的带隙。
αhν=A(hν-Eg)n/2
(1)
式中:α为吸收系数,hν为光子能量,A为比例常数,Eg为禁带宽度,n值取决于半导体性质(直接跃迁n=1,间接跃迁n=4)。对于Cu-TiO2和g-C3N4,n取值为1[23]。如图4(a)内插图、图4(b)、(c)所示,TiO2、Cu-TiO2和g-C3N4的Eg分别为3.20、2.94和2.71 eV。
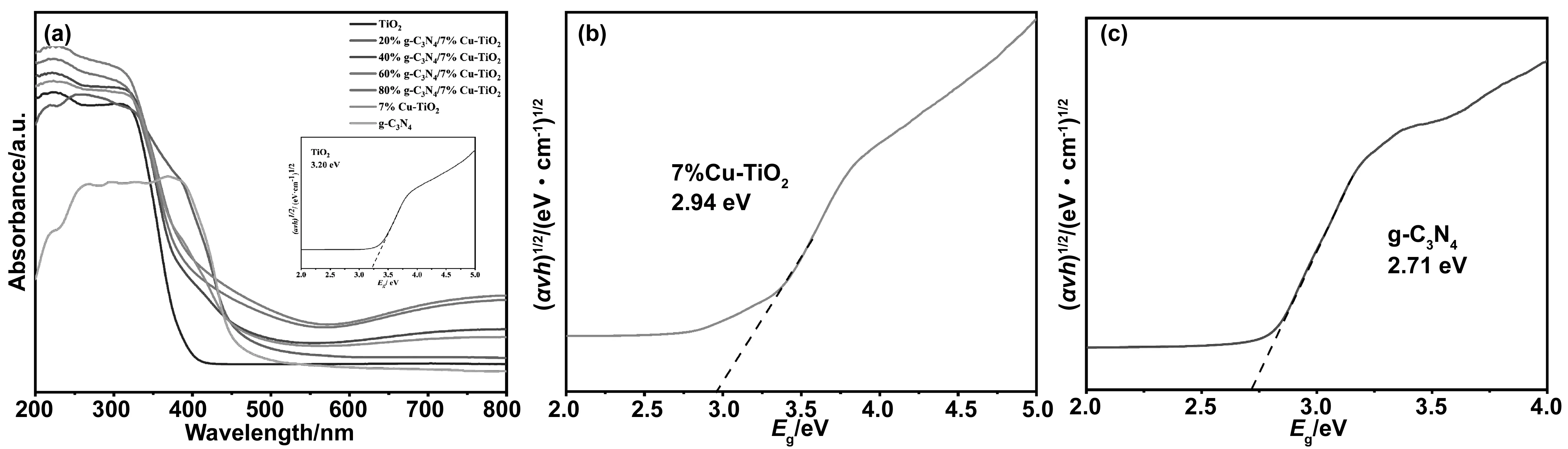
图4 (a)不同组分g-C3N4/7% Cu-TiO2的UV-Vis DRS光谱(内插图为TiO2的带隙图);(b)7% Cu-TiO2的带隙图;(c)g-C3N4的带隙图
2.3 催化剂的催化性能测试
为探索催化剂的催化性能,在初始pH为7、催化剂加投量20 mg、30% H2O2加投量0.1 mL、污染物浓度为20 mg/L,对Cu-TiO2的光催化性能进行表征,该体系为光-芬顿体系。为排除吸附-脱附对光催化性能的影响,在光催化开始前进行了30 min的暗吸附。从图5可以看出,在TiO2加入后60 min内对RhB的催化效率仅为73.80%,这种现象是因为TiO2在受到紫外光照后,快速产生电子-空穴对,使得光生电子与空穴符合速度过快,催化性能过差,另一方面是因为快速产生的光生载流子迅速捕捉了一部分体系中的羟基自由基,使得起到降解的主要活性物主发生了湮灭,从而降低了降解速率。1% Cu-TiO2与3% Cu-TiO2因为物相中存在金红石相,相比其他组分催化性能并不高。5% Cu-TiO2、7% Cu-TiO2、9% Cu-TiO2的样品在60 min中对RhB的降解分别达到98.54%、99.12%和96.61%。但7% Cu-TiO2样品在20 min时便达到了98.92%,相比5% Cu-TiO2、9% Cu-TiO2,具有更高效的催化效率。上述结果表明,7% Cu-TiO2具有更高效的催化性能。
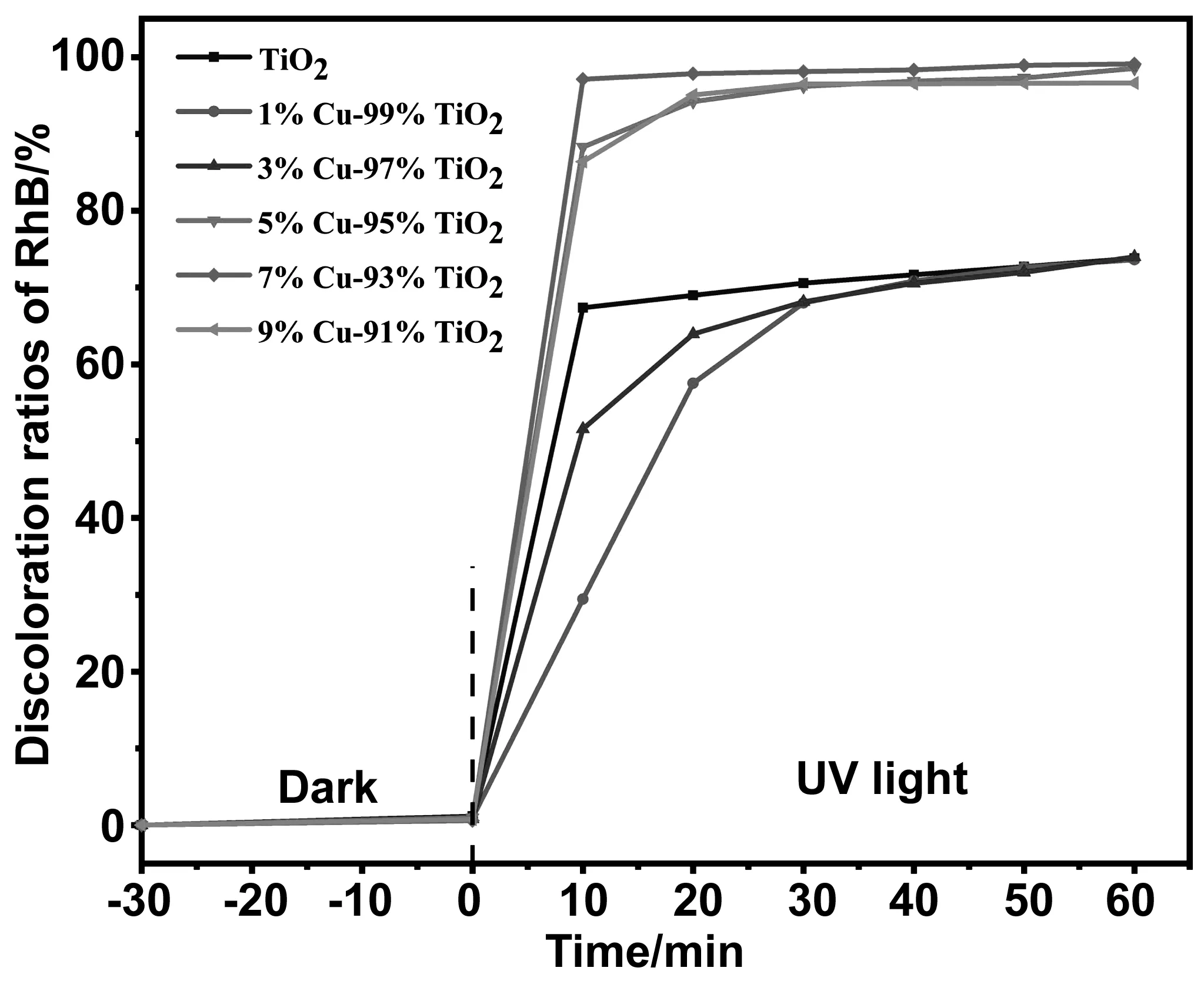
图5 Cu-TiO2的光催化性能表征
图6为不同组分g-C3N4与7% Cu-TiO2复合的光催化性能的表征,由于催化效率过高,因此本组试验在初始pH为7、催化剂加投量20 mg、30% H2O2加投量0.1 mL、污染物浓度为25 mg/L的条件下进行,同时以7% Cu-TiO2做对比。试验开始后同样在暗环境下进行了30 min的吸附平衡。试验发现,纯RhB在紫外光下基本不分解,因此排除了RhB在紫外光条件下的自降解对试验的影响。无催化剂组在只存在H2O2条件下对RhB的降解率在60 min可以达到100%,但相较于其他组加入催化剂的降解率相比,其催化效率明显较低,复合g-C3N4的样品在前30 min内对RhB的降解效率均明显高于未复合的7% Cu-TiO2。其中60% g-C3N4/7% Cu-TiO2样品在30 min内降解效率即可达到100%,相较其他组有明显提升。上述结果表明,复合了g-C3N4的样品可以更快速的提供光催化效果,其中60% g-C3N4/7% Cu-TiO2明显高于其他组分的催化效率。
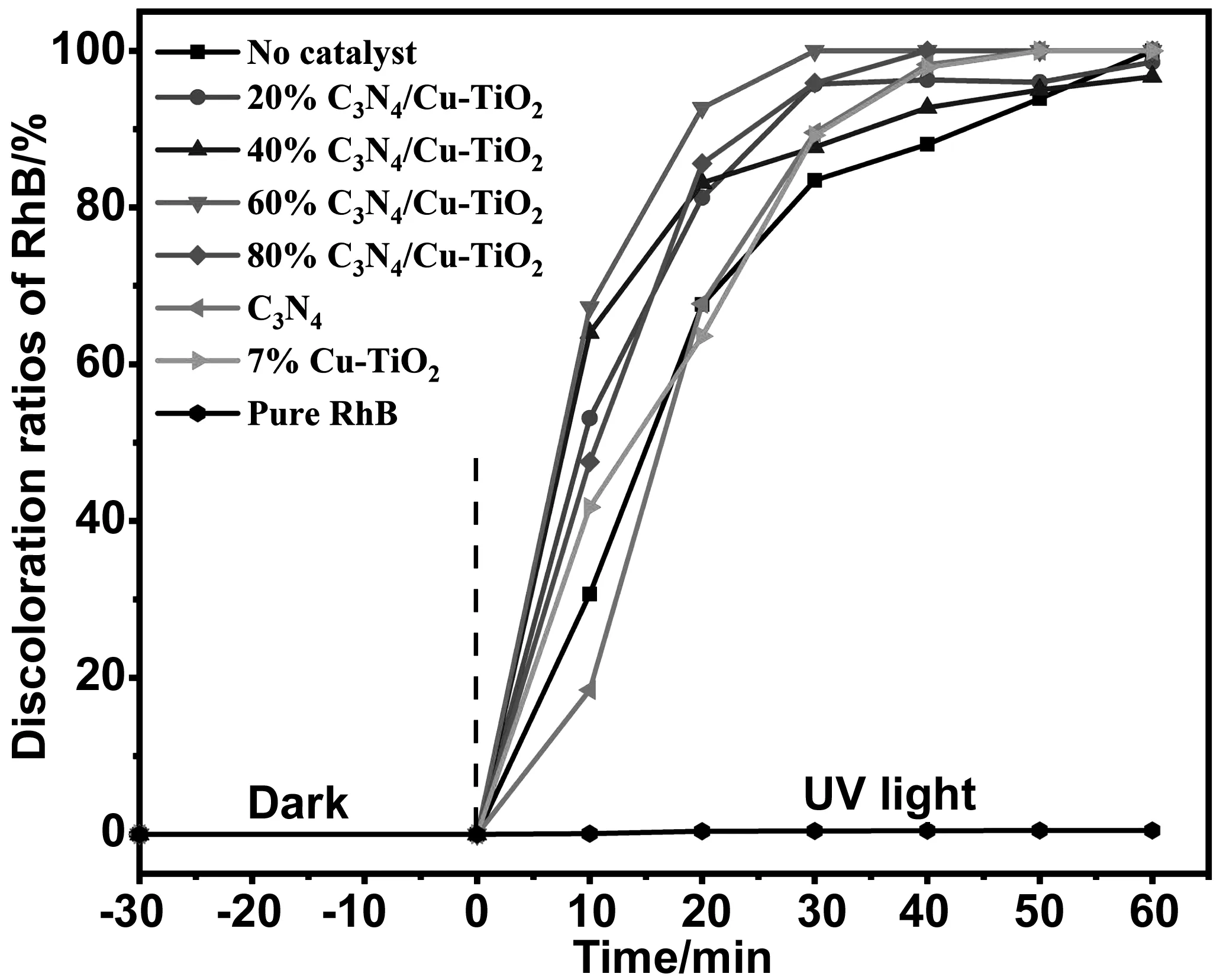
图6 不同组分g-C3N4/7% Cu-TiO2对光催化性能的影响
图6为60% g-C3N4/7% Cu-TiO2加投量20 mg、30% H2O2加投量0.1 mL、污染物浓度为25 mg/L的条件下进行,试验初始使用NaOH和HNO3控制初始pH分别为2、4、6、8、10。试验发现,该催化剂在pH为2、4、6、8时均可以提供较快的催化效率,其中在pH=6及pH=8时催化速率最快,在30 min降解率达到100%。在pH=2和pH=4时在40 min时降解率达到100%。在pH=10时,60 min催化降解率为87.84%,相较其余各组有所降低。这是因为在合适的pH下,溶液可以提供适量的H+,从而促进羟基自由基的生成,碱性环境下,H2O2不稳定,极易分解成为O2和H2O[24-25]。上述结果说明,60% g-C3N4/7% Cu-TiO2在较宽的pH范围内可以提供高效的催化效率,相较传统芬顿反应使用的pH范围有所提高。
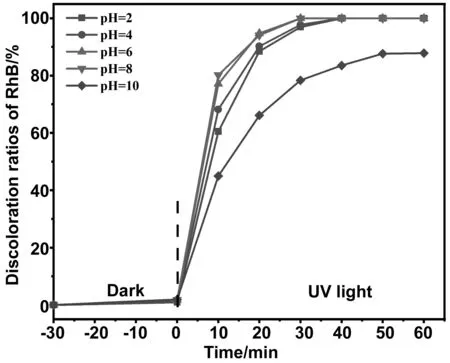
图7 60% g-C3N4/7% Cu-TiO2光催化剂在不同pH下的催化效果
为考察催化剂的稳定性,在pH=6的条件下对催化剂进行了3次回收重复性试验,得出的结果如图8所示。在三次重复实验中,20 min时的催化降解率分别达到92.71%、91.25%和90.22%,并没有明显下降,这证明该催化剂具有良好的稳定性,在进行多次催化试验后,仍具有高效的催化效率及催化效果。这是因为催化剂特殊的异质结结构,使得在反应过程电子及空穴存在从催化剂内部迁移到表面,从而减少了对催化剂内部结构的改变。
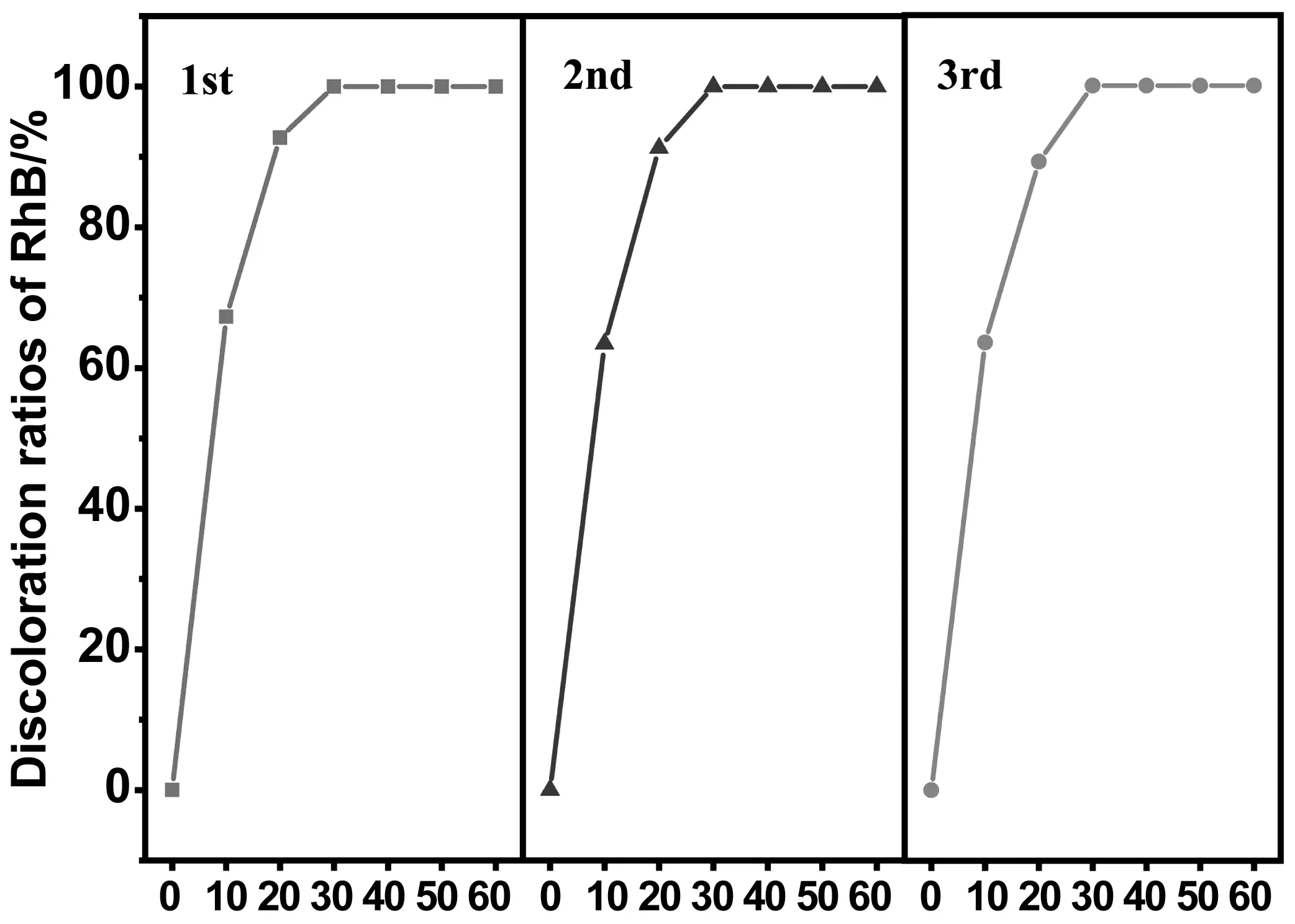
图8 60% g-C3N4/7% Cu-TiO2催化剂的稳定性研究
2.4 催化剂光电性能表征
图9(a)为所制备的催化剂的电化学阻抗图,电化学阻抗谱(EIS)也是半导界面电荷分离过程的有效的检测手段,从图中可以看到,60% g-C3N4/7% Cu-TiO2样品的内切圆半径最小,而在EIS的表征中,内切圆半径越小证明电子和空穴之间相互转移需要克服的电阻最小,即60% g-C3N4/7% Cu-TiO2在光催化过程中电子和空穴复合程度越小,提高了电子-空穴的传输效率,大大提高了催化性能。
图9(b)为对样品进行的瞬态光电流响应的结果图,从图中得到,纯g-C3N4在瞬间接受光照时几乎没有产生瞬态电流,7% Cu-TiO2相比TiO2具有更大的光电流响应强度,而60% g-C3N4/7% Cu-TiO2相比其他三个样品,光电流相应强度最大。这是因为g-C3N4以异质结结构与Cu-TiO2耦合在一起,从而提供更大的电子转移,抑制原有的电子-空穴复合,促进光催化活性。
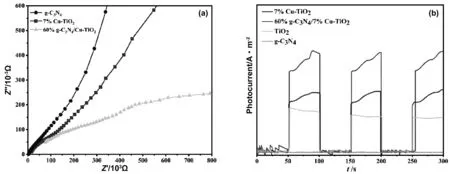
图9 催化剂的光电性能研究
2.5 光催化机理探索
为进一步探索光催化中主要起作用的活性物质,在初始pH=7、60% g-C3N4/7% Cu-TiO2加投量20 mg、30% H2O2加投量0.1 mL、污染物浓度为25 mg/L的条件下进行。分别加入1 mmol异丙醇(IPA)、乙二胺四乙酸二钠(EDTA-2Na)、溴酸钾(KBrO3)和对苯醌(BQ)作为羟基自由基(·OH)、空穴(h+)、电子(e-)和超氧自由基(·O2)的捕获剂。结果如图9所示,加入IPA后的降解率为27.70%,加入EDTA-2Na后的降解率为53.85%,加入KBrO3后的降解率为79.34%,加入BQ后的降解率为91.37%。这说明在光催化降解过程中的主要活性物质为羟基自由基(·OH),也进一步说明,在该体系中,60% g-C3N4/7% Cu-TiO2受到紫外光照后,快速催化H2O2生成大量·OH,从而达到高效降解的目的。
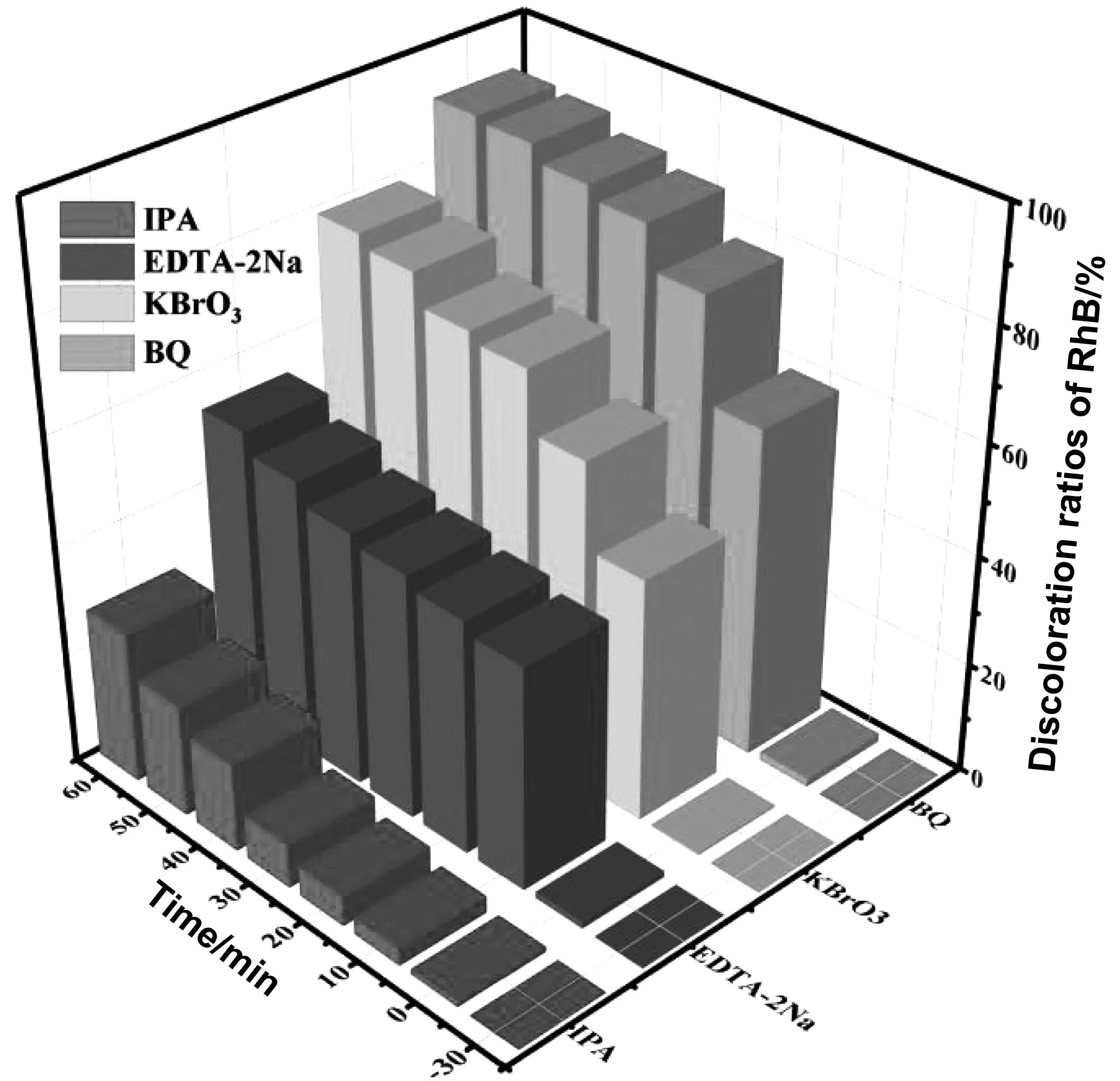
图10 60% g-C3N4/7% Cu-TiO2光催化降解RhB活性物质捕获试验
根据试验结果,提出了g-C3N4/Cu-TiO2在紫外条件下加速紫外芬顿反应速率的可能性。如图10所示,在二元体系中,g-C3N4与TiO2复合材料的紧密接触使得在接受光照时候电子-空穴对的高效分离[26]。在接收到紫外光源后,g-C3N4与TiO2均被激发,使得价带上的电子获得能量迁移至导带,同时在价带上留下空穴,由于TiO2的价带(2.44 eV)[27]正于g-C3N4的价带(1.58 eV)[28],g-C3N4导带(-1.18 eV)负于TiO2的导带(-0.5 eV),使得在激发过程中空穴由TiO2向g-C3N4迁移,电子由g-C3N4向TiO2迁移,从而提高了电子-空穴对的分离效率,充分释放能量,催化H2O2生成羟基自由基(·OH)。另一方面,由于Cu2+的引入,在激发过程中产生的能量一部分使得Cu2+生成Cu+,其中的电子占据了TiO2中的空穴,使得电子-空穴对的分离进一步提高,同时Cu+的产生如式2的反应,该反应具有极高的反应速率,高达1.0×104L·mol-1·s-1[12]。以此g-C3N4/Cu-TiO2具有在紫外光辅助条件下显著提高芬顿效应的催化能力。
Cu++H2O2→Cu2++·OH+HO-
(2)
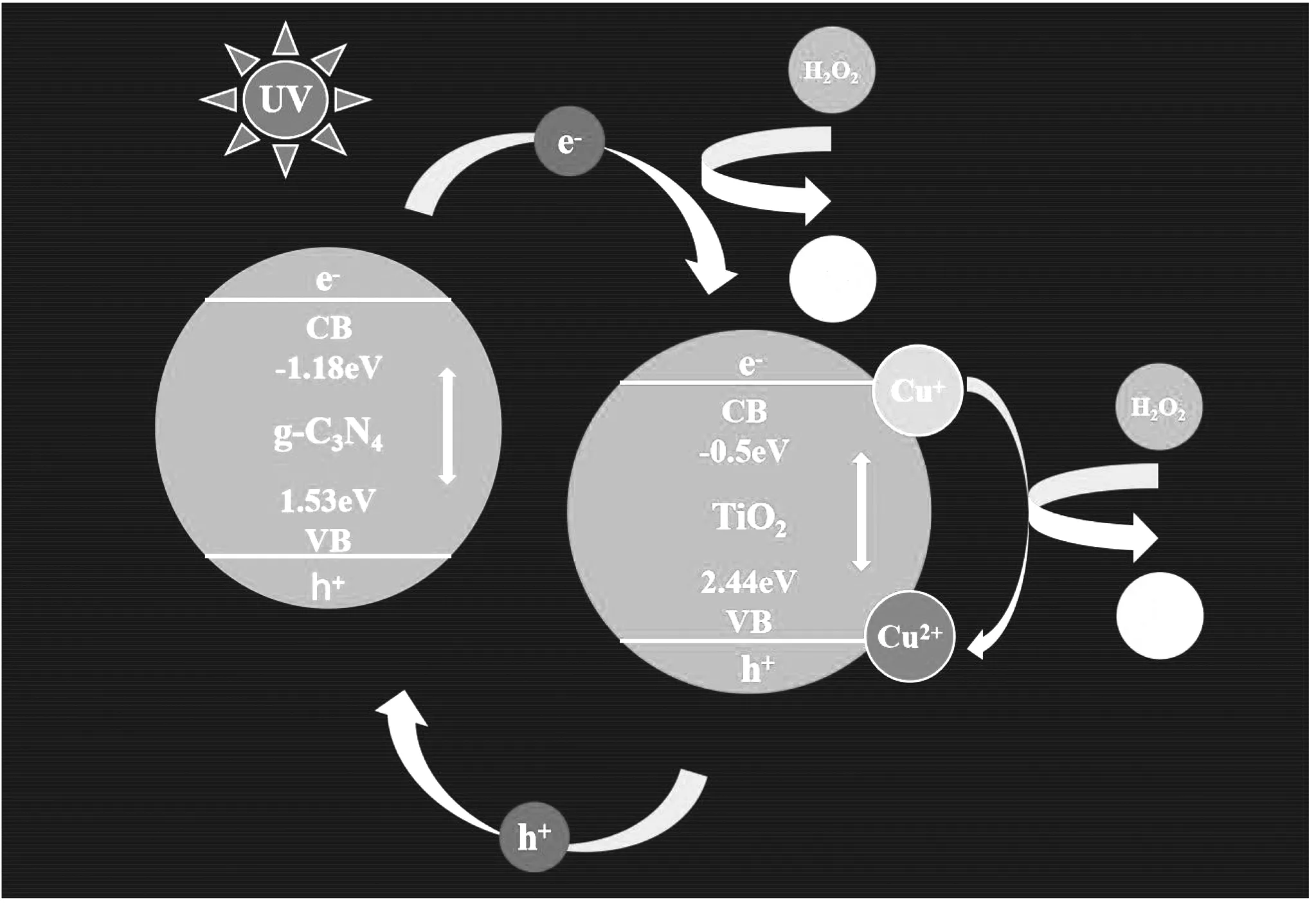
图11 g-C3N4/Cu-TiO2复合催化剂机理示意图
3 结 论
通过一步法与水热法制备了具有紫外光催化活性的g-C3N4/Cu-TiO2纳米球体复合材料。利用XRD、SEM、UVVis DRS等测试方法对催化剂结构形貌及光电学性能进行了表征。试验结果表明:
(1)合成了直径在80nm~90nm范围内的均一的g-C3N4/Cu-TiO2纳米球体,Cu-TiO2均匀分布在g-C3N4上,其中TiO2为锐钛矿相,Cu以离子形式进入了TiO2晶格内,g-C3N4为类似石墨烯的层片状结构。
(2)在60% g-C3N4/Cu-TiO2样品加投量为20 mg、pH=6、0.1 mL 30% H2O2及400W高压汞灯条件下,对25 mg·L-1RhB进行催化,催化效率在20 min内达到92.71%,在30 min内降解率达到100%,与空白对照组相比,效率提高了100%。
(3)60% g-C3N4/Cu-TiO2样品在pH范围2~8内都具有良好的催化性能,相比传统芬顿反应大大扩宽了适用的pH范围。
(4)通过研究催化机理,g-C3N4/Cu-TiO2所提供的高效的芬顿反应可能与g-C3N4/Cu-TiO2异质结结构及TiO2内Cu2+与Cu+相互转化有关。
