Ghrelin 对脂肪间充质干细胞神经分化的影响
2022-12-15杨贺然李兴江胡嘉航李彦伟
杨贺然, 李兴江, 胡嘉航, 李彦伟
(1. 牡丹江医学院附属红旗医院检验科, 黑龙江 牡丹江 157000;2. 牡丹江医学院解剖教研室, 黑龙江 牡丹江 157000;3. 牡丹江医学院附属红旗医院影像科, 黑龙江 牡丹江 157000)
神经损伤会造成机体运动和感觉功能受损, 严重影响人们的正常生活, 目前自体神经移植是最有效的治疗方法, 但存在供区损伤、手术时间长及费用较高等缺点[1]。脂肪间充质干细胞(adiposederived mesenchymal stem cells, ADSCs) 具 有 多向分化潜能, 不仅具有自体移植可行性, 还可通过分泌细胞因子或神经营养因子来促进内源性细胞的存活, 通过抑制炎症反应来促进组织修复, 已被发现在神经系统疾病中具有潜在治疗作用[2-4], 因此有效促进ADSCs 神经向分化, 对神经损伤的治疗十分重要, 有必要对其机制进行深入探讨。Ghrelin作为一种具有调控营养、发育和神经保护作用的脑肠肽[5], 被发现可促进ADSCs 神经分化, 但其详细的作用机制研究[6]较少。研究[7]证实:磷酸酰肌 醇 3 激 酶 (phosphatidylinositol-3-kinase, PI3K)/蛋白激酶B(protein kinase B, Akt)激活可促进脐带间充质干细胞神经分化, 具有神经保护作用, 但其在ADSCs 神经分化中的作用尚未见报道。Ghrelin 能够激活脂多糖诱导的胰岛β 细胞中PI3K/Akt 通路, 以此减轻细胞损伤[8]。因此本文作者通过研究Ghrelin 联合PI3K/Akt 通路特异抑制剂LY294002 对ADSCs 神 经 分 化 的 影 响, 为Ghrelin 在ADSCs 神经分化中的机制研究提供依据。
1 材料与方法
1.1 主要试剂和仪器H-DMEM 培养基(北京伊塔生物科技有限公司), MTT 试剂盒(上海易汇生物科技有限公司), PI3K/Akt 通路特异抑制剂LY294002(北京德航五洲科技有限公司)。Ghrelin(美国Sigma-Aldrich 公司), 兔抗PI3K、Akt、磷酸化PI3K (phosphorylated PI3K, p-PI3K)、磷酸化Akt (phosphorylated Akt, p-Akt) 和β-actin 抗体(美国Cell Signaling Technology 公司), 兔抗神经元特异性烯醇化酶(2-phospho-D-glycerate hydrolase, NSE)和巢蛋白(Nestin)抗体(德国MilliporeSigma 公司), 兔抗胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP) 抗体(丹麦Dako 公司), 羊抗兔IgG-HRP 和羊抗兔IgG-FITC(美 国Abcam 公 司), CD90-FITC 和CD106-PE(美国BioLegend 公司), CD34-PE、CD13-PE 和CD45-FITC(美国BD Biosciences 公司), 蛋白提取试剂盒(广州晨学生物科技有限公司), BCA 蛋白定量试剂盒(上海李记生物科技有限公司)。流式细胞仪购自上海然哲仪器设备有限公司, CKX53ipc 三目倒置相差显微镜和Olympus BX63 自动荧光显微镜购自日本Olympus 公司, Omega Fluor 凝胶成像系统购自四川环亚生物科技有限公司。
1.2 人ADSCs 分离和培养将通过吸脂手术所获取的人ADSCs(25 mL)采用PBS 缓冲液冲洗后, 采用眼科剪剪成体积为1~2 mm3的小块, 除去结缔组织和血管, 添加等体积Ⅰ型胶原蛋白酶(0.1%)后于37 ℃水浴槽中消化1 h, H-DMEM 培养基(含15% 胎牛血清)终止消化, 1 500 r·min-1离心10 min, 弃上清, 将细胞密度调整为2×106cm-1后, 接种于培养瓶中培养(5% CO2、37 ℃), 每隔48 h 更换培养液, 直至培养到细胞融合度约达80%时进行传代, 更换为含15%新生牛血清的H-DMEM 培养基培养, 培养至第4 代进行后续实验, 采用倒置相差显微镜观察细胞形态表现。
1.3 流式细胞术鉴定ADSCs 表面抗体阳性表达率将100 μL 第4 代ADSCs (每毫升2×106个)悬液加入至流式管中, 分别加入5 μ L 抗人CD90-FITC、CD34-PE、CD13-PE、CD106-PE 和CD45-FITC 单抗及其同型对照试剂避光孵育30 min, 采用流式细胞术检测表面抗体阳性表达率。
1.4 各组ADSCs 向神经分化后的形态表现将第4 代ADSCs 分 为 对 照 组、 LY294002 组(给 予40 μmol·L-1PI3K/Akt 通 路 特 异 抑 制 剂LY294002)[9]、 Ghrelin 组(给 予0.1 μmol·L-1Ghrelin)[10]和 Ghrelin+LY294002 组 (给 予40 μmol·L-1LY294002+0.1 μmol·L-1Ghrelin)。按照每孔4×103个ADSCs 的密度接种至预先放置于经多聚赖氨酸处理的无菌载玻片的24 孔细胞培养板中, 培养24 h 后弃培养液, 在对照组、LY294002 组、Ghrelin 组 和Ghrelin+LY294002 组ADSCs 中均加入含15%新生牛血清、10 μg·L-1碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF) 和20 μg·L-1表 皮 细 胞 生 长 因 子(epidermal growth factor, EGF)、20 μg·L-1脑源性神经营养因子(brain derived neurotrophic factor, BDNF) 的H-DMEM 诱导培养基, 培养14 d, 倒置相差显微镜下观察第3、7、10 和14 天细胞形态表现。
1.5 免疫荧光染色法检测ADSCs 中NSE、Nestin和GFAP 阳性细胞百分率培养14 d 后, 弃去培养液, PBS 缓冲液洗涤后加入含4%多聚甲醛的PBS缓冲液过夜, 加入兔抗人NSE(1∶100)、Nestin(1∶200) 和GFAP (1∶100) 抗 体 后 过 夜 孵 育(4 ℃), 室温下加入FITC 标记的羊抗兔二抗(1∶70)孵育1 h, Hoechst33258 染色5 min 后冲洗, 封片, 荧光显微镜观察拍照, 采用Image-Pro Plus 6.0 软件计算NSE、Nestin 和GFAP 阳性细胞百分率, 阳性细胞百分率=阳性细胞数/细胞总数×100%。
1.6 Western blotting 法检测ADSCs 中PI3K/Akt信号通路蛋白表达水平采用RIPA 裂解液将各组ADSCs 裂 解 后, 12 000 r·min-1离 心10 min 后 取 上清, 采用BCA 法检测ADSCs 中总蛋白浓度;每孔吸取30 μg 蛋白样品进行SDS-PAGE 凝胶电泳, 分离蛋白, 根据蛋白相对分子质量大小进行切胶, 并转至PVDF 膜上, 脱脂奶粉封闭1 h 后添加一抗(兔抗PI3K、Akt、p-PI3K、p-Akt 和β-actin 抗体, 1∶1 000), 4 ℃过夜孵育, 孵育2 h 后加入HRP 标记的IgG 二抗(1∶5 000), ECL 化学发光试剂显影, 并置于蛋白凝胶成像仪中观察, 采用Image J软件分析各组ADSCs 中PI3K、Akt、p-PI3K、p-Akt 和β-actin 条带灰度值, 目的蛋白表达水平=目的蛋白条带灰度值/β-actin 条带灰度值, 并计算p-PI3K/PI3K 和p-Akt/Akt 比 值。
1.7 统计学分析SPSS 21.0 统计软件进行统计学分析。各组ADSCs 中NSE、Nestin 和GFAP 阳性细 胞 百 分 率, 各 组ADSCs 中PI3K、Akt、p-PI3K 和p-Akt 蛋白表达水平满足正态分布及方差齐性, 以±s表示, 多组间样本均数比较采用单因素方差分析, 组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 第1 和4 代ADSCs 形态表现第1 代ADSCs呈长梭形或多角形, 第4 代ADSCs 形态均一, 均呈现长梭形。见图1。
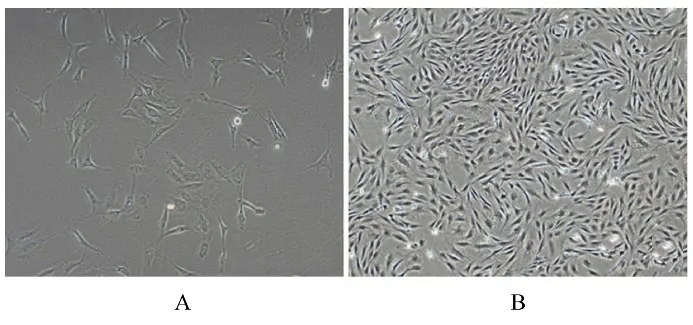
图1 倒置相差显微镜观察ADSCs 形态表现(×100)Fig. 1 Morphology of ADSCs observerd by inverted phase contrast microscope (×100)
2.2 流式细胞术鉴定ADSCs 表面抗体阳性表达率流式细胞术检测结果显示:CD90(99.70%)和CD13(95.30%)呈高水平表达状态, 而CD34(0.20%)、CD45 (2.20%) 和CD106 (0.10%)均呈低水平表达状态。见图2。
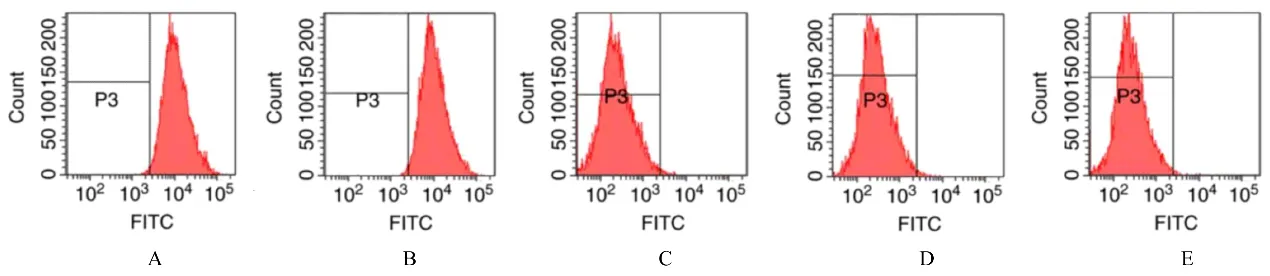
图2 流式细胞术鉴定ADSCs 表面抗体阳性表达率Fig.2 Positive expression rates of surface antibodies of ADSCs identified by flow cytometry
2.3 各组ADSCs 形态表现观察诱导后第3、7、10 和14 天ADSCs 形态表现, 结果显示:第3 天时对照组ADSCs 胞体出现突起, 第7 天时胞体明显收缩, 第14 天时多数细胞由长梭形转变为类圆形胞体, 突起增长、数量增加;与对照组比较, LY294002 组仅部分细胞由长梭形转变为类圆形胞体, 突起较短、数量减少, 而Ghrelin 组细胞由长梭形转变为类圆形胞体速度增快;与LY294002 组比较, Ghrelin+ LY294002 组细胞由长梭形转变为类圆形胞体速度增快, 且突起数量增加。见图3。

图3 诱导不同时间后倒置相差显微镜下观察各组ADSCs 形态表现(×100)Fig.3 Morphology of ADSCs in various groups at different time after induction observed under inverted phase contrast microscope(×100)
2.4 各 组ADSCs 中NSE、Nestin 和GFAP 阳 性 细胞百分率与对照组比较, LY294002 组ADSCs 中NSE 和Nestin阳性细胞百分率降低(t=10.137,t=5.991,P<0.05), Ghrelin 组ADSCs 中NSE 和Nestin 阳性细胞百分率明显升高(t=8.485,t=4.855,P<0.05);与LY294002 组比较, Ghrelin+LY294002 组ADSCs 中NSE 和Nestin 阳 性 细 胞 百分率升高(t=10.093,t=6.798,P<0.05);各组ADSCs 中GFAP 阳性细胞百分率比较差异无统计学意义(P>0.05)。见表1 和图4。
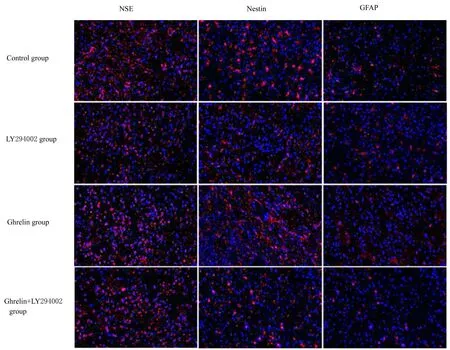
图4 各组ADSCs 分化形态表现(免疫荧光, ×200)Fig.4 Morphology of differentiation of ADSCs in various groups(Immunofluorescence, ×200)
表1 各组ADSCs 中NSE、Nestin 和GFAP 阳性细胞百分率Tab. 1 Percentages of NSE, Nestin, and GFAP positive cells in ADSCs in various groups (n=5, ±s, η/%)
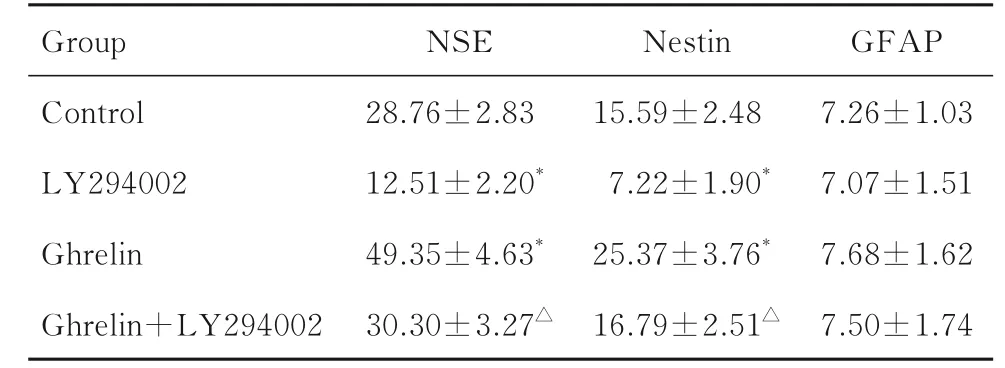
表1 各组ADSCs 中NSE、Nestin 和GFAP 阳性细胞百分率Tab. 1 Percentages of NSE, Nestin, and GFAP positive cells in ADSCs in various groups (n=5, ±s, η/%)
*P<0.05 compared with control group;△P<0.05 compared with LY294002 group.
GFAP 7.26±1.03 7.07±1.51 7.68±1.62 7.50±1.74 Group Control LY294002 Ghrelin Ghrelin+LY294002 NSE 28.76±2.83 12.51±2.20*49.35±4.63*30.30±3.27△Nestin 15.59±2.48 7.22±1.90*25.37±3.76*16.79±2.51△
2.5 各组ADSCs 中p-PI3K、PI3K、p-Akt 和Akt 蛋白表达和p-PI3K/PI3K 和p-Akt/Akt 比值各组ADSCs 中p-PI3K、PI3K、p-Akt 和Akt 蛋白表达情况见图5。与对照组比较, LY294002 组ADSCs 中p-PI3K/PI3K 和p-Akt/Akt 比 值 降 低(t=5.292,t=5.188,P<0.05), Ghrelin 组ADSCs 中p-PI3K/PI3K和p-Akt/Akt 比值升高(t=3.823,t=3.778,P<0.05); 与 LY294002 组 比 较, Ghrelin+LY294002 组ADSCs 中p-PI3K/PI3K 和p-Akt/Akt比 值 升 高 (t=5.747,t=7.453,P<0.05), 见表2。
表2 各组ADSCs 中p-PI3K/PI3K 和p-Akt/Akt 比值Tab. 2 Ratios of p-PI3K/PI3K and p-Akt/Akt in ADSCs in various groups (n=5, ±s)
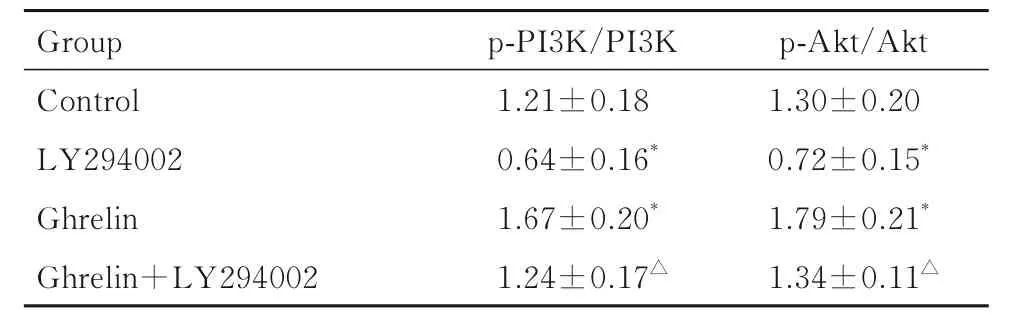
表2 各组ADSCs 中p-PI3K/PI3K 和p-Akt/Akt 比值Tab. 2 Ratios of p-PI3K/PI3K and p-Akt/Akt in ADSCs in various groups (n=5, ±s)
*P<0.05 compared with control group;△P<0.05 compared with LY294002 group.
p-Akt/Akt 1.30±0.20 0.72±0.15*1.79±0.21*1.34±0.11△Group Control LY294002 Ghrelin Ghrelin+LY294002 p-PI3K/PI3K 1.21±0.18 0.64±0.16*1.67±0.20*1.24±0.17△

图5 各组ADSCs 中PI3K/Akt 通路相关蛋白表达电泳图Fig. 5 Electrophoregram of expressions of PI3K/Akt pathway-related proteins in ADSCs in various groups
3 讨 论
神经系统损伤会严重影响患者正常生活, 目前最有效的治疗手段是自体神经移植, 但该治疗仍无法完全恢复受损的神经组织, 并且还会引发感觉缺失和疼痛性神经瘤等供区损伤[1], 需要寻找新的方法促使神经系统再生[11]。ADSCs 是一种具有多向分化潜能的间充质干细胞, 其能够通过定向分化为神经细胞来治疗脊髓损伤、帕金森病和脑卒中等神经系统疾病[12-13]。因此促进ADSCs 神经向分化对神经损伤的治疗具有重要意义。本研究从人脂肪组织中分离出ADSCs, 并经细胞表面抗体检测发现:CD90 与CD13 呈高表达状态, 而CD34、CD45 和CD106 均呈低表达状态, 表明实验成功分离出ADSCs, 并进行后续实验。
Ghrelin 是一种从大鼠胃中所分离出的脑肠肽, 能够刺激垂体释放生长激素, 近年来, 有研究[14]显示:Ghrelin 泛分布于下丘脑、大脑皮层、海马和脊髓等神经组织中, 在神经系统的多种功能中具有重要作用。研究[6,15]显示:Ghrelin 能够促进神经再生, 促进海马神经元恢复及突触形成。Ghrelin已被证明具有神经保护作用, 能够增加神经元活力、抑制氧化应激及免疫反应、促进神经细胞增殖与分化。研究[16]显示:其可能通过激活β-连环蛋白(β-catenin)信号通路促进ADSCs 的神经分化。本研究所分离的ADSCs 在诱导神经发生后转变为类圆形胞体, 并延伸出突触, 并表达神经细胞特异性蛋白NSE 和Nestin, 与前人研究[16]结果一致。本研究结果显示:与对照组比较, Ghrelin 能够有效加快ADSCs 由长梭形转变为类圆形胞体及增加突起数, 还可促进细胞中NSE 和Nestin 表达, 而对细胞中星形胶质细胞活化标志物GFAP 表达无明显影响, 表明Ghrelin 可以显著促进ADSCs 神经分化。
PI3K 是神经营养因子介导的神经生长因子(nerve growth factor, NGF) 依 赖 性 神 经 细 胞 株PC12 细胞存活反应的调节剂, PI3K 下游因子Akt可在受到激活后产生NGF 和BDNF 等营养因子来改善神经干细胞向神经元的分化及存活[17]。PI3K/Akt 通路是调控神经分化所必需的信号通路, 具有神 经 保 护 作 用[18-19]。研 究[20]显 示:Achaete-scute同源物1 可通过激活PI3K/Akt 信号通路正调节神经祖细胞的神经元分化。5-氮杂胞苷能够诱导人ADSCs 定向分化为心肌细胞, 这可能与其激活PI3K/Akt/雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR) 通 路 有 关[21]。本 研 究 采 用PI3K/Akt 通路特异性抑制剂LY294002 处理细胞发现:LY294002 能够抑制ADSCs 由长梭形向类圆形胞体的转变及减少突起数量, 还可抑制细胞中NSE 和Nestin 表达, 而对细胞中星形胶质细胞活化标志物GFAP 表达无明显影响, 表明抑制PI3K/Akt 通路会抑制ADSCs 神经向分化。研究[14]显示:Ghrelin 能够通过激活PI3K/Akt 通路来促进糖原合酶激酶3β 磷酸化, 促进运动神经元存活和再生, 以此发挥神经保护作用。本研究结果显示:与LY294002 组 比 较, Ghrelin+ LY294002 组ADSCs转变速度加快, 细胞中NSE 和Nestin 表达水平及p-PI3K/PI3K 比值和p-Akt/Akt 比值升高, 表明Ghrelin 能够逆转LY294002 对ADSCs 分化的抑制作用, Ghrelin 可能通过激活PI3K/Akt 通路来促进ADSCs 的神经分化。
综上所述, Ghrelin 可能通过激活PI3K/Akt 通路来促进ADSCs 神经分化。本研究不仅为阐明Ghrelin 在ADSCs 神经分化中的作用机制有重要帮助, 还对神经损伤疾病治疗机制的研究具有一定参考意义, 但本研究尚缺乏关于Ghrelin 对PI3K/Akt通路下游细胞因子影响机制的研究, 因此还需在未来进行深入探讨。
