正交试验法结合信息熵理论优化玄参生物活性成分的提取工艺
2022-12-15韩忠耀邓先扩
邓 莹, 刘 杰, 韩忠耀, 邓先扩, 李 香
(黔南民族医学高等专科学校, 贵州 都匀 558000)
0 引言
【研究意义】玄参药材来源于玄参科植物玄参(ScrophularianingpoensisHemsl.)的干燥根,具有清热凉血、滋阴降火及解毒散结等功效,常用于治疗热入营血、温毒发斑、骨蒸劳嗽、目赤、咽痛、白喉、瘰疬及痈肿疮毒等症[1];是玄麦柑橘颗粒、养阴清肺丸、金嗓散结丸等多种制剂的组方药材,为我国常用的大宗药材,年需求量7 000~8 000 t[2]。中药材有效成分的含量对保证用药质量尤为重要。因此,研究玄参药材活性成分的提取工艺,可为其质量控制奠定基础,对促进玄参药材产业的发展具有重要现实意义。【前人研究进展】玄参的化学成分主要有环烯醚萜类、苯丙素苷类、有机酸类、黄酮类及总黄酮类等[3],其中,哈巴苷和哈巴俄苷具有抗炎作用[4-5],肉桂酸具有泻下及抗细菌、真菌的作用[6],黄酮类具有抗炎镇痛和抗肿瘤抗氧化等作用[7],是玄参的主要生物活性成分。对玄参生物活性成分的提取工艺研究,主要集中在哈巴苷和哈巴俄苷[8-10]、环烯醚萜苷和苯丙素苷[11]、总黄酮[7]、多糖[12]及肉桂酸[13]等方面。信息熵赋权法能够处理数量较大且较复杂的数据,用其处理后得到的多指标权重系数计算综合评分,可使结果更客观[14]。信息熵赋权法和逆概率加权等数学模型作为新兴交叉学科,近年来被广泛应用于中药、民族药的质量控制,以及指导中药、民族药加工工艺优化的生产实践[14-18]。李燕等[14]在单因素试验的基础上,通过信息熵赋权法计算所测各指标的权重系数进而计算其综合评分,并采用L9(34)正交试验设计优化了千里光的提取工艺,结果表明:在最佳提取工艺条件下,千里光药材生物活性成分绿原酸、金丝桃苷、总黄酮和总生物碱含量提取率的RSD均小于1.5%(n=3)。韩忠耀等[16]基于信息熵赋权法对苗药水冬瓜根皮提取工艺进行优化,证明信息熵赋权法可用于苗药水冬瓜根皮药材提取工艺的优选。【研究切入点】已报道的玄参提取工艺中所用的评价指标均为单一指标或同一类指标,而中药通过多成分、多靶点发挥药效,已成为学术界的共识,玄参通过多指标评价提取工艺的研究较少。在结果评价中,以传统的主观赋值综合评分法确定各指标权重系数存在客观性和科学性不足的问题,而用信息熵赋权法确定多指标成分的权重系数则可使结果更具科学性[15]。但以信息熵赋权法结合正交试验优化玄参提取工艺的研究鲜见报道。【拟解决的关键问题】采用单因素试验研究甲醇体积分数、液固比、提取时间及提取次数4个因素对玄参哈巴苷、哈巴俄苷、肉桂酸和总黄酮等生物活性成分提取量的影响,并在此基础上采用L9(34)正交试验结合信息熵理论确定各指标的客观权重系数,优化玄参生物活性成分的提取工艺,以期为提高玄参的利用率及标准化提取工艺的制定提供参考。
1 材料与方法
1.1 试验材料
1.1.1 玄参 试验用玄参购于贵州省遵义市道真县玄参种植基地,经黔南民族医学高等专科学校中药教研室鉴定为玄参正品。
1.1.2 仪器 Agilent 1260型高效液相色谱仪,安捷伦科技公司;Agilent C18色谱柱(250 mm×4.6 mm,5 μm),安捷伦科技公司;Cary 100型双光束紫外-可见分光光度计,安捷伦科技公司;SG-4050C型数显恒温水浴锅,上海硕光科技有限公司;FA1004B型电子天平,温州瑞昕仪器有限公司;超声仪和电热恒温鼓风干燥箱等。
1.1.3 试剂 哈巴苷(批号CHB-H-006)、哈巴俄苷(批号CHB190105)、肉桂酸(批号CHB190106)和芦丁(批号190115)对照品,均购于成都克洛玛生物科技有限公司;乙腈为色谱纯,水为娃哈哈纯净水,其余试剂均为分析纯。
1.2 试验方法
1.2.1 材料预处理
1) 标准溶液制备。参照文献[19]制备哈巴苷和哈巴俄苷质量浓度分别为0.06 mg/mL和0.23 mg/mL的混合标准溶液;参照文献[13]制备肉桂酸质量浓度为0.1 mg/mL的标准溶液;参照文献[16]制备质量浓度为0.32 mg/mL的芦丁标准溶液。
2) 供试品溶液的制备。将采购的玄参药材干燥后粉碎,粉末过3号筛,称取适量粉末依照L9(34)正交试验设计,对各药材进行提取,总黄酮含量待测液直接过滤冷藏备用,哈巴苷、哈巴俄苷和肉桂酸待测液用0.45 μm微孔滤膜过滤冷藏备用。
1.2.2 哈巴苷、哈巴俄苷及肉桂酸系统适用性试验 哈巴苷与哈巴俄苷色谱条件参照文献[19]的方法进行;肉桂酸参照文献[13]的方法进行。
1.2.3 绘制标准曲线 哈巴苷和哈巴俄苷参照文献[19]的方法,肉桂酸参照文献[13]的方法,以浓度为横坐标(x)、峰面积(Y)为纵坐标进行线性回归拟合;芦丁参照文献[16]的方法,以含量为横坐标(x)、吸光度(Y)为纵坐标进行线性回归拟合。
1.2.4 方法学考察 参照文献[13,16,19]的方法分别考察哈巴苷、哈巴俄苷、肉桂酸和芦丁的精密度、重复性及稳定性。
1.2.5 加样回收率试验 称取已知含量的玄参样品粉末6份,精密加入哈巴苷、哈巴俄苷、肉桂酸和芦丁对照品溶液适量,按1.2.1的方法制备哈巴苷、哈巴俄苷、肉桂酸和总黄酮供试品溶液,分别测定哈巴苷、哈巴俄苷、肉桂酸及总黄酮含量,计算平均回收率。
1.2.6 哈巴苷、哈巴俄苷、肉桂酸和总黄酮的含量测定 按照1.2.1的方法分别制备哈巴苷、哈巴俄苷、肉桂酸和总黄酮样品溶液,然后按1.2.2进样测定,再按1.2.3根据标准曲线法计算哈巴苷、哈巴俄苷、肉桂酸和总黄酮的含量。
1.2.7 不同因素对玄参生物活性成分提取的影响 以哈巴苷、哈巴俄苷、肉桂酸和总黄酮提取量为评价指标,采用超声提取法考察不同因素对玄参生物活性成分提取量的影响[20]。每组试验3次重复,取平均值进行计算。
1) 甲醇体积分数(A)。试验设5个处理:A1~A5,甲醇体积分数依次为20%、30%、40%、50%及60%。精密称取玄参药材粗粉5份各1.0 g,固定提取次数为2次,每次30 min,分别加入10倍量不同体积分数甲醇进行超声提取,比较玄参总黄酮、哈巴苷、哈巴俄苷和肉桂酸提取量,初步确定甲醇体积分数。
2) 液固比(B)。试验设6个处理:B1~B6,液固比(mL/g)依次为10∶1、20∶1、30∶1、40∶1、50∶1和60∶1。精密称取玄参药材粗粉6份各1.0 g,固定提取次数为2次,每次30 min,提取溶剂为40%甲醇,在不同液固比条件下进行超声提取。比较玄参总黄酮、哈巴苷、哈巴俄苷和肉桂酸提取量,初步确定提取液固比。
3) 提取时间(C)。试验设4个处理:C1~C4,提取时间依次为30 min、45 min、60 min和75 min。精密称取玄参药材粗粉4份各1.0 g,甲醇体积分数为40%,液固比(mL/g)为30∶1,固定提取次数为2次,每次分别提取30 min、45 min、60 min和75 min。比较玄参总黄酮、哈巴苷、哈巴俄苷和肉桂酸提取量,初步确定超声提取时间。
4) 提取次数(D)。试验设4个处理:D1~D4,提取次数依次为1次、2次、3次和4次。精密称取玄参药材粗粉4份各1.0 g,再加入40%甲醇30 mL进行超声提取,分别提取1次、2次、3次和4次,每次60 min。比较玄参总黄酮、哈巴苷、哈巴俄苷和肉桂酸提取量,初步确定提取次数。
1.2.8 正交试验优化玄参的提取工艺 根据单因素试验结果,选取甲醇体积分数(A)、液固比(B)、提取时间(C)和提取次数(D)为考察因素,采用L9(34)正交试验,以哈巴苷、哈巴俄苷、肉桂酸和总黄酮提取量为评价指标,优化玄参的提取工艺。正交试验因素与水平详见表1。
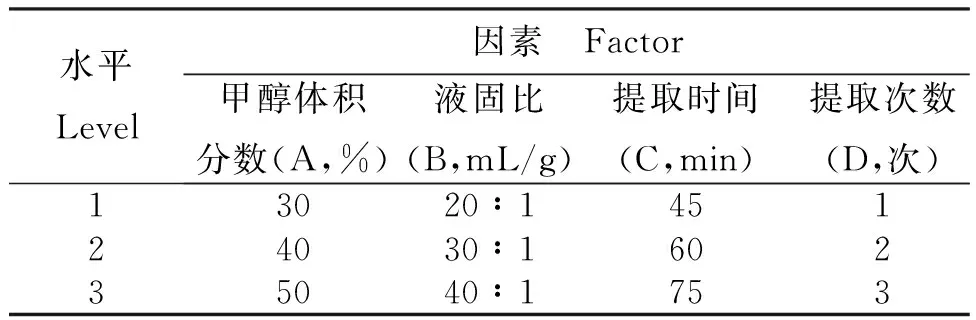
表1 玄参提取工艺优化L9(34)正交试验的因素与水平
1.2.9 信息熵赋权法的应用 参照文献[14,16-18]的方法建立哈巴苷、哈巴俄苷、肉桂酸和总黄酮提取量原始矩阵(Xij),然后将其转换为概率矩阵(Pij)mn,再采用信息熵(Hi)赋权法对(Pij)mn进行加权赋值并计算综合评分(M)。
Mi=P1iW1+P2iW2+P3iW3+P4iW4
式中,Pij表示第j次试验在第i指标下的概率,i、j分别表示矩阵的行、列;Hi表示第i项指标的信息熵;Wi表示第i项指标的权重系数;Mi表示第i项指标的综合评分。
1.3 数据统计与分析
采用SPSS 17.0进行显著性分析。
2 结果与分析
2.1 哈巴苷、哈巴俄苷、肉桂酸和芦丁系统适用性试验与方法学考察
2.1.1 系统适用性 试验结果显示,哈巴苷、哈巴俄苷和肉桂酸的色谱峰与其他色谱峰均完全分离,峰型较好,分离度>1.50,且拖尾因子介于0.95~1.05。哈巴苷、哈巴俄苷和肉桂酸对照品溶液与供试品溶液的高效液相色谱图出峰时间一致,峰形相似,且理论塔板数不低于5 000。表明,哈巴苷、哈巴俄苷及肉桂酸的系统适用性试验方法稳定性较好,适用于上述3种成分的含量测定。
2.1.2 标准曲线 经拟合得到哈巴苷、哈巴俄苷、肉桂酸和总黄酮的标准曲线回归方程:Y哈巴苷=22.195x-0.026 1(R2=1.000 0);Y哈巴俄苷=13.161x+1.809(R2=0.999 9);Y肉桂酸=534.39x-47.421(R2=0.999 9);Y总黄酮=0.354 6x-0.282 7(R2=0.999 0)。
2.1.3 方法学考察 哈巴苷、哈巴俄苷、肉桂酸及芦丁精密度试验的RSD分别为0.76%、0.30%、1.30%及0.25%,表明仪器精密度良好;4个指标重复性试验的RSD分别为1.18%、1.78%、1.82%和2.53%,表明检测方法重复性较好;哈巴苷、哈巴俄苷和肉桂酸稳定性试验的RSD分别为1.14%、1.88%和0.81%,表明3个指标在24 h内保持稳定,总黄酮稳定性试验的RSD为1.36%,表明玄参总黄酮在120 min内稳定性良好。哈巴苷、哈巴俄苷、肉桂酸和芦丁的平均回收率分别为98.12%、98.99%、96.82%和97.40%,RSD依次为2.02%、2.31%、1.56%和2.14%。表明,哈巴苷、哈巴俄苷、肉桂酸和总黄酮的提取方法与检测方法准确可靠。
2.2 不同因素处理玄参哈巴苷、哈巴俄苷、肉桂酸和总黄酮的提取量
从图1看出,不同因素处理玄参哈巴苷、哈巴俄苷、肉桂酸和总黄酮的提取量存在差异。
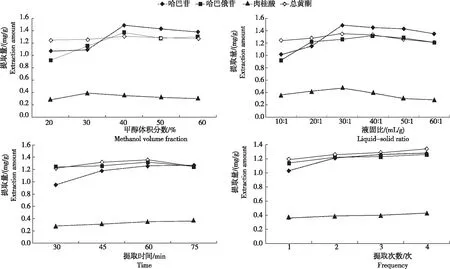
图1 不同因素处理玄参哈巴苷、哈巴俄苷、肉桂酸和总黄酮的提取量
2.2.1 甲醇体积分数 随着甲醇体积分数的增加哈巴苷、肉桂酸和总黄酮的提取量均呈先增后减趋势,哈巴俄苷的提取量呈先增后减再增趋势。哈巴苷提取量为1.07~1.49 mg/g,呈A3>A4>A5>A2>A1,其中,A3最高,A4(1.43 mg/g)其次,A1最低。哈巴俄苷提取量为0.92~1.37 mg/g,呈A3>A5>A4>A2>A1,其中,A3最高,A5(1.30 mg/g)其次,A1最低。肉桂酸提取量为0.28~0.39 mg/g,呈A2>A3>A4>A5>A1,其中,A2最高,A3(0.35 mg/g)其次,A1最低。总黄酮提取量为1.25~1.31 mg/g,呈A3>A4>A5>A2>A1,其中,A3最高,A4(1.29 mg/g)其次,A1最低。综上看出,哈巴苷、哈巴俄苷及总黄酮提取量均在A3时达最大值,肉桂酸提取量在A2时达最大。因此,选择甲醇体积分数30%甲醇、40%甲醇和50%甲醇为后续优化体积分数。
2.2.2 液固比 随着液固比的增加,哈巴苷、肉桂酸、总黄酮和哈巴俄苷的提取量均呈先增后减趋势。哈巴苷提取量为1.01~1.49 mg/g,呈B3>B4>B5>B6>B2>B1,其中,B3最高,B4(1.45 mg/g)其次,B1最低。哈巴俄苷提取量为0.92~1.32 mg/g,呈B4>B5>B3>B2>B6>B1,其中,B4最高,B5(1.28 mg/g)其次,B1最低。肉桂酸提取量为0.28~0.47 mg/g,呈B3>B2>B4>B1>B5>B6,其中,B3最高,B2(0.42 mg/g)其次,B6最低。总黄酮提取量为1.21~1.35 mg/g,呈B3>B4>B2>B5>B1>B6,其中,B3最高,B4(1.33 mg/g)其次,B6最低。综上看出,当加入的溶剂量为30 mL时哈巴苷、肉桂酸及总黄酮的提取量达最高,继续增加溶剂量3个指标呈逐渐下降趋势;哈巴俄苷提取量在加入溶剂量为40 mL时达最高。从节约溶剂的角度和提取量最大化考虑选取液固比(mL/g)20∶1、30∶1和40∶1进行后续试验。
2.2.3 提取时间 哈巴苷和肉桂酸的提取量随提取时间增加呈增加趋势,哈巴俄苷和总黄酮的提取量则随着提取时间的增加呈先增后减趋势。哈巴苷提取量为0.95~1.27 mg/g,呈C4>C3>C2>C1,其中,C4最高,C3(1.26 mg/g)其次,C1最低。哈巴俄苷提取量为1.24~1.32 mg/g,呈C3>C2>C4>C1,其中,C3最高,C2(1.26 mg/g)其次,C4最低。肉桂酸提取量为0.28~0.36 mg/g,C4>C3>C2>C1,其中,C4最高,C3(0.35 mg/g)其次,C1最低。总黄酮提取量为1.22~1.36 mg/g,呈C3>C2>C4>C1,其中,C3最高,C2(1.32 mg/g)其次,C1最低。综上看出,在提取时间为C3时,哈巴俄苷和总黄酮的提取量均达最大值;继续增加提取时间,哈巴苷和肉桂酸的提取量增加较少,而哈巴俄苷和总黄酮的提取量则呈下降趋势。可能是随着提取时间的增加,其他成分的溶出使药材溶液达到饱和状态,使哈巴俄苷和总黄酮的溶出减少。因此,选择提取时间45 min、60 min和75 min进行后续试验。
2.2.4 提取次数 提取次数是决定中药中有效成分提取是否完全的关键因素。随着提取次数的增加,哈巴苷、肉桂酸、总黄酮和哈巴俄苷的提取量均呈逐渐增加趋势,呈D4>D3>D2>D1。哈巴苷提取量为1.03~1.28 mg/g,其中,D4最高,D3(1.26 mg/g)其次,D1最低。哈巴俄苷提取量为1.14~1.26 mg/g,其中,D4最高,D3(1.23 mg/g)其次,D1最低。肉桂酸提取量为0.36~0.43 mg/g,其中,D4最高,D3(0.40 mg/g)其次,D1最低。总黄酮提取量为1.19~1.34 mg/g,其中,D4最高,D3(1.29 mg/g)其次,D1最低。综上看出,在提取次数为2次时4种成分的提取量已趋于稳定,当提取到第3次和第4次时4种成分的提取量与第2次时的提取量差异不显著。因此,从节约能源和节省时间的角度考虑,选取1次、2次和3次为后续试验的提取次数。
2.3 正交试验优化
2.3.1 4个指标的综合评分 哈巴苷、哈巴俄苷、肉桂酸和总黄酮提取量4个指标的信息熵(Hi)分别为0.990 208 10、0.992 185 35、0.989 887 52和0.989 703 14,其权重系数依次为0.257 573 91、0.205 562 71、0.266 006 69和0.270 856 70。从表2看出,各处理的综合评分为6.652~9.052分,呈T4>T7>T1>T3>T9>T5>T2>T6>T8。
2.3.2 最优提取工艺条件 从表2看出,各处理的哈巴苷提取量为1.07~1.68 mg/g,呈T1>T7>T4>T5>T6>T9>T8>T3>T2;哈巴俄苷提取量为0.70~1.37 mg/g,呈T3>T5>T9>T4>T2>T7>T6>T1>T8;肉桂酸提取量为0.28~0.47 mg/g,呈T2=T3>T9>T5=T7>T1>T6=T8>T4;总黄酮提取量为1.29~3.23 mg/g,呈T6>T9>T8>T3>T2>T5>T4>T1=T7。从表3看出,甲醇体积分数3个水平的综合评分为7.774~8.102分,呈k1>k2>k3;液固比的综合评分为7.383~8.799分,呈k1>k3>k2;提取时间的综合评分为7.546~8.222分,呈k2>k3>k1;提取次数的综合评分为7.907~8.053分,呈k1>k2>k3。从极差(R值)看出,各因素对哈巴苷、哈巴俄苷、肉桂酸和总黄酮提取量综合评分的影响程度为B>C>A>D,即液固比>提取时间>甲醇体积分数>提取次数;结合k值得出A1B1C2D1是最佳提取工艺,即:甲醇体积分数为30%,液固比为20∶1,提取时间为60 min,提取次数为1次。以R值最小的D因素作为误差项进行方差分析可知,液固比(B)和提取时间(C)为显著性影响因素(P<0.05)。
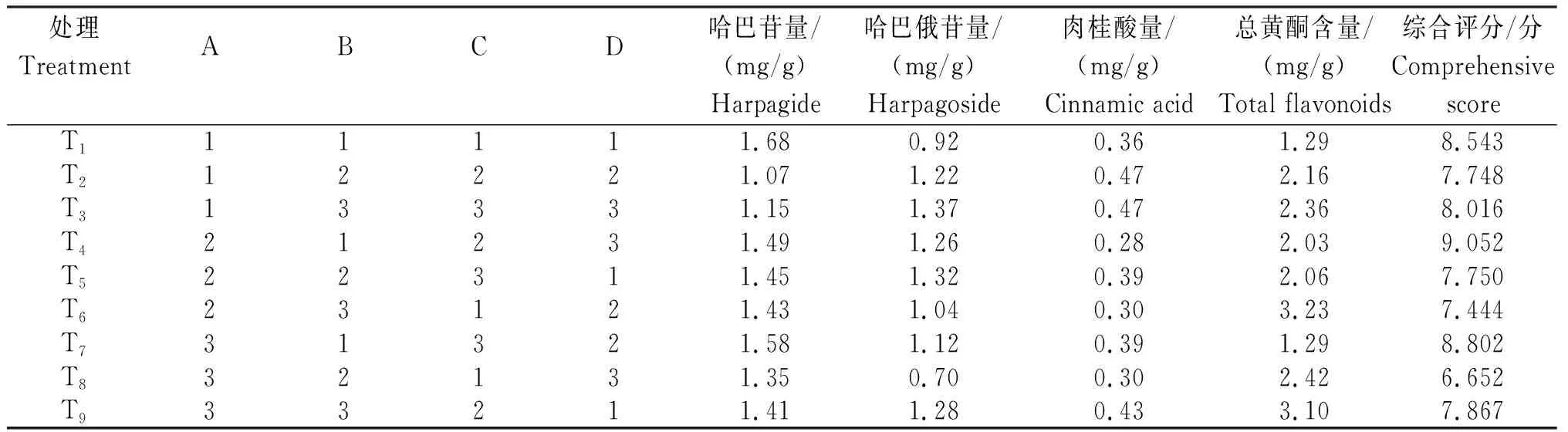
表2 玄参生物活性成分提取工艺优化的正交试验设计、结果与综合评分

表3 正交试验结果的极差
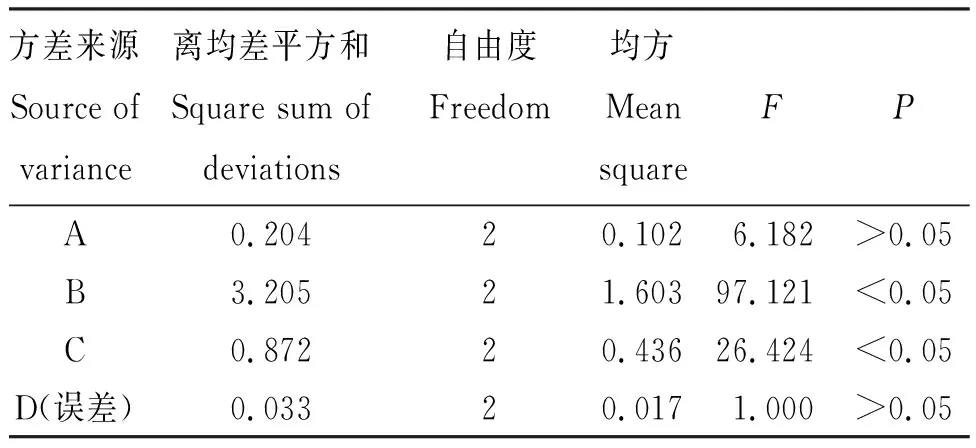
表4 正交试验结果的方差
2.3.3 验证试验 由于筛选出的最佳处理组合不在试验设计方案中,因此进行验证试验。精密称取玄参药材粗粉3份各1.0 g,在优化条件下进行验证试验,3次重复。从表5看出,哈巴苷、哈巴俄苷、肉桂酸和总黄酮提取量均较高,依次为1.59~1.64 mg/g、1.12~1.16 mg/g、0.54~0.57 mg/g和2.29~2.36 mg/g,RSD为1.51%~2.76%,均小于3.00%。表明,优化的提取工艺稳定可行。

表5 验证试验玄参生物活性成分的提取量
3 讨论
李燕等[14,16-18]在单因素试验的基础上,通过信息熵赋权法计算所测各指标的权重系数计算其综合评分,并结合L9(34)正交试验设计优化了不同中药材的提取工艺,其生物活性成分提取率的RSD均小于1.5%~3.0%(n=3)。
已有关于玄参药材提取方法的研究多是单个指标的提取[21],以多指标综合评价玄参提取工艺的研究较少。本试验根据玄参药理作用选取玄参主要生物活性成分哈巴苷、哈巴俄苷、肉桂酸和总黄酮的提取量作为评价指标,相对于单一评价指标,该提取工艺所选取的指标更符合中药的药效发挥特点,使研究结果更真实、全面和准确。而对于提取工艺中多指标的评价方法,所报道的玄参提取工艺[10]中多以主观赋值的综合评分法来对结果进行评价,本试验在单因素考察的基础上,采用信息熵赋权法结合正交试验对玄参药材的提取工艺进行优化,在优化的提取工艺条件下玄参药材的生物活性成分哈巴苷、哈巴俄苷、肉桂酸及总黄酮提取量分别为1.61 mg/g、1.14 mg/g、0.55 mg/g和2.33 mg/g,RSD均小于3%(n=3)。证明,正交试验结合信息熵赋权法优化玄参提取工艺的方法可行,其有效节约了试验成本,减少了试验次数,使试验结果更具客观性和科学性。与李燕等[14,16-18]的研究结论类似。
4 结论
采用单因素试验在其他处理条件固定的情况下筛选得到,当甲醇体积分数为40%时,哈巴苷、哈巴俄苷、肉桂酸和总黄酮的提取量最高,分别为1.49 mg/g、1.37 mg/g、0.35 mg/g和1.31 mg/g;当液固比(mL/g)为30∶1时上述4种成分提取量最高,分别为1.49 mg/g、1.26 mg/g、0.47 mg/g和1.35 mg/g;当提取时间为60 min时4种成分提取量最高,分别为1.26 mg/g、1.32 mg/g、0.35 mg/g和1.36 mg/g;当提取次数为2次时4种成分提取量最高,分别为1.28 mg/g、1.23 mg/g、0.42 mg/g和1.26 mg/g。通过信息熵理论将哈巴苷、哈巴俄苷、肉桂酸和总黄酮提取量的权重系数确定为0.257 573 91、0.205 562 71、0.266 006 69和0.270 856 70;结合经正交试验确定玄参药材生物活性成分的最佳提取工艺:提取溶剂为30%甲醇、液固比(mL/g)为20∶1、提取时间60 min、提取1次。在此提取工艺条件下,玄参药材中哈巴苷、哈巴俄苷、肉桂酸及总黄酮提取量依次为1.61 mg/g、1.14 mg/g、0.55 mg/g和2.33 mg/g,RSD均小于3%。表明,优化后的提取工艺稳定性好、玄参生物活性成分提取量高,可为玄参药材提取工艺的标准化制定提供参考。
