羟基自由基结合宰后高温处理的鸭肉肌原纤维蛋白氧化及凝胶结构变化
2022-12-14朱学伸王凯徐俊杰陈显锐周越刘少华黄雪方王仁雷
朱学伸,王凯,徐俊杰,陈显锐,周越,刘少华,黄雪方,王仁雷
(江苏第二师范学院生命科学与化学化工学院,药食两用活性物质开发与利用重点实验室,江苏南京 211200)
我国一直以来都是鸭子的主要养殖及屠宰基地,鸭肉产量一直稳居世界前列。虽然国内市场上盐水鸭、烤鸭等产品十分深受消费者喜爱,但鸭肉整体深加工比率仍有较大提升空间。众所周知,鸭肉肌原纤维蛋白结构及性质的变化对肉类品质有很大影响,其主要功能特性是能够形成热诱导凝胶,从而赋予肉类制品良好的质地和口感,但劣质肉的产生对于肉品品质的影响不容忽视。课题组较早在国内报道了类PSE 禽肉的发生,其是宰前因素与基因特性共同作用的结果[1,2]。国内外先后研究报道了宰后初期高温处理是诱导类PSE 肉产生的主要途径,可模拟产生鸡肉[3]、火鸡肉[4]、猪肉[5]、兔肉[6]等劣质肉,其显著特征均是颜色发白,保水性差,蛋白质功能特性下降。值得一提的是,禽肉中关于初期高温对鸭肉的影响报道十分缺乏。近年来肌原纤维蛋白氧化与其蛋白特性关系越来越受到关注。Carvalho 等[7]研究报告了利用高温诱导类PSE 肉中蛋白质羰基化程度高,蛋白质不同程度产生交联,最终提出了蛋白质氧化与宰后高温处理后肉鸡纤维蛋白的理化特性显著相关。包玉龙等[8]随后研究报道猪肌原纤维氧化会造成组氨酸残基的损失,会导致肌原纤维蛋白羰基的形成;自由巯基损失,形成二硫键,最终导致大的交联组分的形成。同时肌球、肌动和原肌球蛋白等等电点下降,肌原纤维净电荷发生改变,最终影响肉的品质。李银等[9]试验分析了羟自由基氧化体系中不同过氧化氢浓度对蛋白氧化程度及肌原纤维蛋白凝胶白度、持水力、质构特性与弹性模量等特征指标的影响,羟自由基氧化体系中,氧化剂浓度越高,氧化程度就越高,肌原纤维结构破坏越严重,保水性越低。陈晓思等[10]对氧化兔肉肌原纤维蛋白进行研究,肌原纤维二级结构中无规则卷曲含量上升,同时部分蛋白发生聚集和交联。总结近年来的研究可以发现,蛋白氧化并导致蛋白加工性能的变化,及其与相应功能特性改变的内在关系仍有待于研究。适度的蛋白氧化甚至可以改善或提高肌肉蛋白的功能特性,因此研究鸭肉中氧化程度以及同时关注宰后温度的影响具有一定理论意义。
本文主要研究不同羟基自由基氧化体系对不同温度处理后鸭肉提取的肌原纤维蛋白氧化特性及凝胶微观结构的影响,旨为鸭肉产品加工过程中的质量控制提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
实验材料鸭胸肉采购于江苏省南京市溧水区当地市场。鸭经屠宰后立刻取下鸭胸肉,放置于冰盒中带回实验室,在宰后0.5 h 至4.5 h 期间分别按照两个温度梯度0 ℃和40 ℃下处理鸭胸肉样品,之后分装成约30g 每袋,置于-80 ℃冰箱保存待用。实验所用氯化钠、氯化镁、乙二醇双(2-氨基乙基醚)四乙酸、磷酸氢二钾、过氧化氢、乙二胺四乙酸二钠、三氯乙酸、十二烷基硫酸钠、2,4-二硝基苯肼等试剂均为国产分析纯(≥99.70%),实验用水为超纯水。
1.2 主要仪器设备
ST2100 实验室pH 计,上海奥豪斯仪器有限公司;5810R 多功能台式冷冻离心机,德国Eppendorf 公司;UV5100 紫外可见光分光光度计,上海元析仪器有限公司;BDF-25V350 电热超低温冰箱,济南宝来医疗器械有限公司;GZX9070MBE 电热鼓风干燥箱,上海博迅实业有限公司分散器;T18 分散器,德国IKA 公司;Hitachi S-3000N 扫描电镜,日本日立公司等。
1.3 试验方法
1.3.1 肌原纤维蛋白的提取
鸭肉肌原纤维的提取方法提取按照Park 等[11]的方法做适当修改。取30 g 鸭胸肉样品加入120 mL 提取液(四倍体积),放入绞肉机,之后转移到离心管中。13 000 r/min 条件按下分散30 s 后于4 ℃,6 000 r/min离心10 min,重复上述分散及离心步骤三次,获得的沉淀用Trinton X-100 再洗三次。之后沉淀再用0.1 mol/L NaCl 洗三次,得到肌原纤维蛋白沉淀。此过程需要全程冰浴进行。
1.3.2 Fenton 体外氧化体系的建立
肌原纤维的氧化参考Kong 等[12]的方法,并有一些改动。将浓度调制33 mg/L 的蛋白液与Fenton 试剂:0.01 mmol/L 三氯化铁,0.1 mmol/L 抗坏血酸(A 液)和过氧化氢(B 液)按照表1进行处理,其中过氧化氢的浓度梯度为0、5、10 mmol/L。将整个反应体系放置4 ℃氧化24 h。之后加入10 μL,500 mmol/L EDTA 终止氧化。之后在反应体系中加入30 mL 10 mmol/L 磷酸氢二钾,4 ℃ 10 000 r/min,离心10 min,弃上清。将得到的沉淀用40 mL 10 mmol/L 磷酸氢二钾缓冲液再洗涤2 次,即得氧化后肌原纤维蛋白沉淀。蛋白质浓度采用Biuret 方法测定。
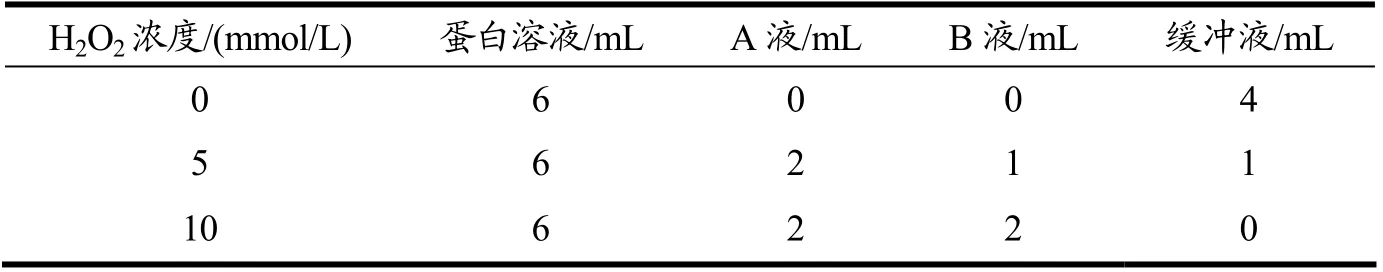
表1 Fenton 氧化体系Table 1 Fenton oxidation system
1.3.3 肌原纤维蛋白的保水性测定
根据Bao 等[13]方法测定了肌原纤维的保水性(B,%)。先称取并记录离心管质量为m1,取约1 g 氧化后肌原纤维蛋白沉淀置于离心管中,记录总质量为m2,将装有蛋白的离心管开盖竖直放入烘箱中,100 ℃干燥6 h;取出离心管,记录总质量为m3。

1.3.4 肌原纤维蛋白巯基含量测定
氧化处理后肌原纤维的巯基含量依据Zhang 等[14]的方法测定,并作适当修改,利用DTNB 显色法测定蛋白中游离巯基的含量。取浓度为2 mg/mL 的蛋白质溶液600 μL,用1 400 μL 0.6 mol/L NaCl 稀释,之后取0.5 mL 上述溶液溶液加入2 mL 0.1 mol/L Tris-HCl,测A412(前)和A280;将溶液倒回离心管中,再向离心管加入0.5 mL 10 mmol/L DTNB,混匀后室温避光30 min 后测A412(后),用0.1 mol/L Tris-HCl 调零。采用14 150 L/(mol·cm)摩尔消光系数换算,巯基含量[记为C,nmol/(mg pro)]利用下列公式计算,测定三次取平均值。

1.3.5 羰基含量测定
氧化处理后肌原纤维的羰基含量的参照Solia等[15]的方法测定,并略做改动,使用DNPH 显色法测定蛋白中的羰基含量。取蛋白浓度为20 mg/mL 的溶液五份(每份200 μL),再加入1 mL 10%三氯乙酸,8 000 r/min离心5 min,弃上清,沉淀加入400 μL 5wt% SDS 于100℃水浴15 min。取其中2 份样品加入400 μL 3 mol/L HCl,另外3 份样品加入400 μL 0.3wt% DNPH,静置30 min 后加入300 μL 体积分数40% TCA,8 000 r/min离心5 min,弃上清液。沉淀用1 mL 乙醇-乙酸乙酯10 000 r/min 离心3×5 min,沉淀干燥20 min,加入1.5 mL 6 mol/L 盐酸胍,37 ℃水浴30 min 后10 000 r/min,4 ℃,离心5 min,取上清测A280和A370,调零用盐酸胍。采用22 000 L/(mol·cm)摩尔消光系数换算,羰基含量[记为D,nmol/(mg pro)]利用下列公式计算,测定三次取平均值。

1.3.6 表面疏水性测定
氧化处理后肌原纤维蛋白的表面疏水性按照Miklavžin 等[16]的方法进行测定,并进行了一些修改。取浓度为2 mg/mL 蛋白质溶液1 mL,加入200 μL 1 mg/mL溴酚蓝溶液,于4 ℃孵育10 min 后10 000 r/min 离心3 min,取上清液稀释十倍后测A595,调零用缓冲液。表面疏水性(E,μg)利用下列公式计算,测定三次取平均值。
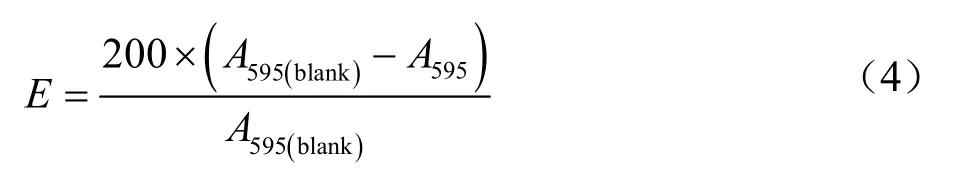
1.3.7 电泳及蛋白免疫印迹
蛋白质电泳参照Jia 等[17]的方法并进行了一些修改,将不同氧化体系处理后蛋白质溶液浓度调至2 mg/mL(用0.6 mol/L NaCl,10 mmol/L 磷酸氢二钾,pH 值7.0 稀释),取500 μL 上述溶液与500 μL 上样缓冲液混合均匀,再加入10 μL 1 mg/mL 溴酚蓝,混匀后金属浴99 ℃加热5 min。电泳条件:200 V,45 min。染色、脱色后用凝胶呈像仪进行拍照和分析。
蛋白免疫印迹条件如下:取出电泳后凝胶进行湿法转移:30 V 转膜1 h。将转膜结束的PVDF 膜在TBST中清洗5 min,然后转移到封闭液中摇晃孵育1 h,用TBST 清洗5 min 后转移到Actin 一抗(小鼠单抗)(AA132-1,碧云天)或MYH7Rabbit Polyclonal Antibody 一抗中(AF7533,碧云天)摇晃孵育1 h,用TBST 清洗3×5 min 后转移到AP 标记山羊抗小鼠lgG(H+L)二抗中或Anti-Rabbit lgG(Fc) AP conjugate(S3738,Promega)中摇晃孵育1 h,用TBST 清洗3×5 min 后转移到另一干净容器中,加入适量BCIP/NBT(A0258,碧云天)显色。将显色完成的PVDF膜用蒸馏水冲洗,放在滤纸上吸干水分,利用凝胶呈像仪进行拍照和分析。
1.3.8 蛋白凝胶结构
上述不同氧化梯度处理后的肌原纤维蛋白质浓度调至60 mg/mL,取6 mL 放置至于10 mL 玻璃烧杯中,在水浴锅中以2 ℃/min 梯度升温从20 ℃加热到80℃,之后用冰水冷却30 min,放入4 ℃冰箱中冷藏12 h。取凝胶用3%的戊二醛固定,之后用乙醇(体积分数50%、70%、90%、95%、100%)进行梯度脱水。脱水后的样品放于叔丁醇中置换,之后冷冻干燥,最后喷上约10 nm 的金粉,15 kV 电镜观察[18]。
1.4 数据处理
数据分析用SPSSTM20 软件(SPSS Inc.,美国)进行双因素方差分析,并采用Duncan's 方法做数据差异显著性比较,p<0.05 时表示不同处理组间存在显著差异。
2 结果与讨论
2.1 肌原纤维蛋白保水性分析
保水性反映了肌原纤维蛋白的吸水能力和防止其在外力作用下渗出水分的能力,侧面反映肌原纤维蛋白状态的重要指标之一[19]。由图1可知,随着过氧化氢浓度的增加,DMP 的保水性逐渐下降。在不添加H2O2情况下0 ℃处理组肌原纤维蛋白的保水性为93.48%,而被10 mmol/L H2O2氧化24 h 后的0 ℃处理组DMP 保水性仅为90.07%,原因可能是部分DMP 被过氧化氢产生的羟基自由基诱导发生氧化,肽链侧链巯基形成二硫键,蛋白质之间发生交联,导致DMP 横向收缩,破坏了蛋白间的稳定结构,肌原纤维蛋白发生了变性并过度聚集形成聚集体。蛋白肽链聚集体改变了其结构,不利于形成稳定的三维网状结构,对水分的截留能力变差[20,21],而氧化导致的蛋白质交联使肌原纤维发生收缩,疏水性基团暴露,从而对DMP 保水性产生直接的负面影响。同时,40 ℃处理组DMP 氧化空白组和添加10 mmol/L H2O2组的保水性分别为85.39%和83.09%,随着过氧化氢浓度的增加,40 ℃处理组组DMP 的保水性呈现一定的下降趋势(p<0.05),但在相同氧化体系条件下,高温预处理组客观上造成了肌原纤维蛋白保水性进一步显著下降。
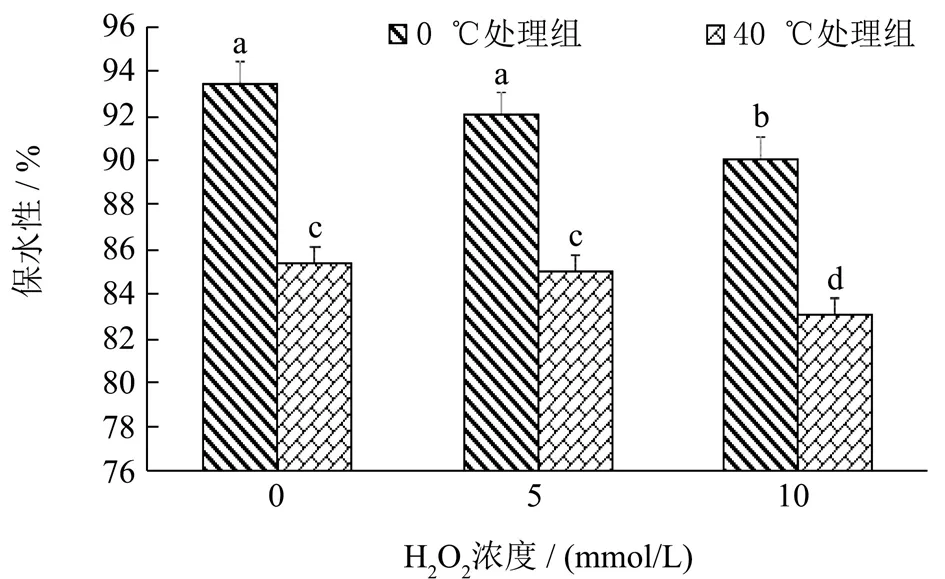
图1 不同过氧化氢氧化梯度对不同温度预处理鸭肉肌原纤维蛋白保水性的影响Fig.1 Effects of different hydrogen peroxide oxidation gradients on water holding capacity of duck myofibrillar protein pretreated at different temperatures
2.2 肌原纤维蛋白氧化指标分析
2.2.1 羰基含量测定
羰基含量是蛋白质氧化的重要指标之一,羰基含量越高表明蛋白质被氧化的程度越高[22],不同浓度过氧化氢氧化下肌原纤维蛋白的羰基含量如图2所示,随着过氧化氢浓度的增加,0 ℃处理组和40 ℃处理组组DMP 的羰基含量都呈现上升的趋势(p<0.05),在相同氧化体系条件下,40 ℃处理组羰基含量显著高于0 ℃处理组的羰基含量(p<0.05),说明40 ℃处理组DMP 更容易被氧化,推测可能与宰后初期高温处理导致部分关键的氧化还原酶活性下降,同时部分骨架蛋白空间结构发生了改变,结构更加松散[7]。推测羟基自由基氧化导致肽链羰基含量上升,主要跟蛋白质侧链上的一些基团,如精氨酸、脯氨酸、苏氨酸和赖氨酸侧链基团被羟基自由基氧化生成羰基化合物有关,同时氧化自由基会直接攻击蛋白质肽链,直接使天冬氨酸和谷氨酸氧化,使肽链进一步裂解,导致羰基含量上升[8];需要强调的是,由于氧化使蛋白的空间结构发生变化,使隐藏在蛋白质内部的氨基酸残基被暴露出来尤其是高温组,被自由基氧化,同样会进一步造成羰基含量上升。李银等[9]报道了类似的结果,随H2O2浓度的增加到20 mmol/L,猪背最长肌中肌原纤维羰基值显著上升至2.82 nmol/mg pro。
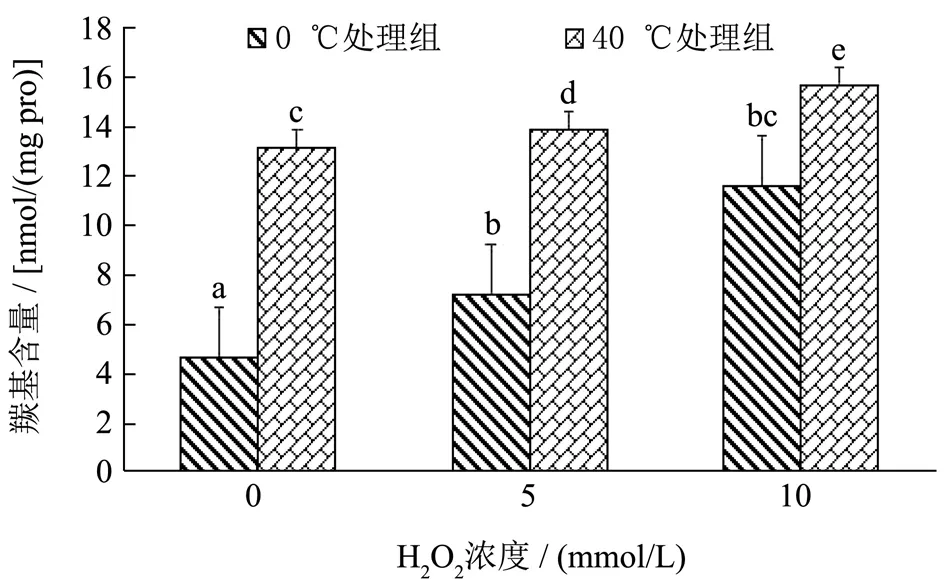
图2 不同过氧化氢氧化梯度对不同温度预处理鸭肉肌原纤维蛋白羰基含量的影响Fig.2 Effects of different hydrogen peroxide oxidation gradients on carbonyls content of myofibrillar protein in duck meat pretreated at different temperatures
2.2.2 巯基含量测定
巯基是肌原纤维中反应活性最高,对氧化条件最敏感的基团,其总含量是反映蛋白质氧化状态的重要指标之一。DMP 中巯基基团数量较多,其中仅肌球蛋白就含有42 个巯基[23]。含硫的氨基酸残基很容易受到活性氧的攻击而形成二硫键产生交联,从而进一步对蛋白质的功能造成一定的影响。不同过氧化氢氧化梯度对不同温度预处理鸭肉肌原纤维蛋白巯基含量的影响如图3所示。0 ℃处理组在没有过氧化氢添加的情况下巯基含量为84.81 nmol/mg pro,随着过氧化氢的浓度增加,蛋白巯基含量呈下降趋势,当过氧化氢浓度达到10 mmol/L 时,巯基含量仅为66.98 nmol/mg pro,说明巯基含量会随着氧化力度的增加而下降。而高温组DMP 随着体系中过氧化氢浓度的升高巯基含量也呈下降趋势(p<0.05)。在同一氧化梯度下,高温预处理组巯基含量显著低于普通肉蛋白的巯基含量,表明40 ℃处理组更易被氧化,以上结果与上述羰基含量所表明的结果相一致。陈晓思等[10]之前报道了类似的结果,过氧自由基(AAPH)处理后巯基含量呈现显著的下降,当浓度达到10 mmol/L 时,巯基含量下降至31.93 nmol/mg pro。
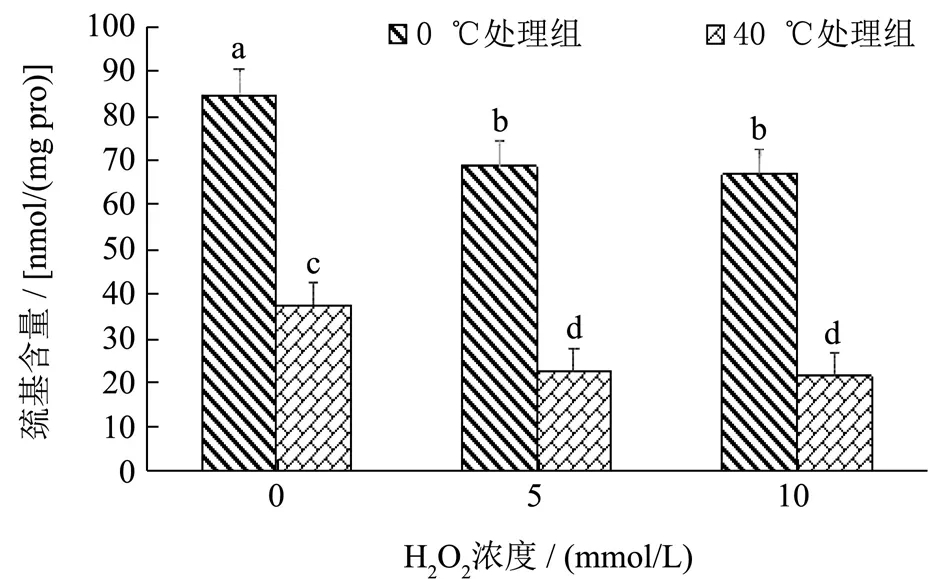
图3 不同过氧化氢氧化梯度对不同温度预处理鸭肉肌原纤维蛋白巯基含量的影响Fig.3 Effects of different hydrogen peroxide oxidation gradients on thiol group content of myofibrillar protein in duck meat pretreated at different temperatures
2.2.3 表面疏水性测定
表面疏水性的改变可以直接反应疏水性氨基酸在蛋白质表面的分布情况和蛋白质结构的变化。蛋白质的表面疏水性一般用蛋白质中疏水性氨基酸与溴酚蓝的结合量表示。表面疏水性的过量增加会使蛋白质与水间的相互作用减弱,造成蛋白质稳定性降低,出现蛋白疏水性聚集,导致蛋白变性,影响肌肉蛋白制品品质[24]。不同浓度过氧化氢氧化对不同温度预处理的肌原纤维蛋白表面疏水性的影响如图4所示,对照组0℃处理组DMP在没有过氧化氢添加的情况下表面疏水性为50.72 μg,在同样条件下,40 ℃处理组蛋白的表面疏水性达到82.93 μg;并且随着过氧化氢浓度的增加,两组样品蛋白的表面疏水性均都有上升趋势(p<0.05),即羟基自由基氧化使DMP 更多的疏水性氨基酸残基暴露。前面研究结果也显示氧化自由基攻击含硫氨基酸残基间形成二硫键,蛋白发生聚集,使蛋白质二级结构发生改变,其可能与隐藏在蛋白内部疏水性氨基酸被暴露过程相关联。需要指出的是,刘洋[25]前期报道了过度Fenton 氧化处理猪肌原纤维表面疏水性却显著下降,推测这可能是因为在Fenton 氧化过程中蛋白受到的氧化作用过于强烈,从而导致蛋白在后期处于聚集状态,掩盖了蛋白结构展开。

图4 不同过氧化氢氧化梯度对不同温度预处理鸭肉肌原纤维表面疏水性的影响Fig.4 Effects of different hydrogen peroxide oxidation gradients on the surface hydrophobicity of duck myofibrils pretreated at different temperatures
2.3 电泳及蛋白免疫印记分析
不同过氧化氢浓度处理后肌原纤维蛋白组成如图5所示,在非还原条件情况下,蛋白大量聚集在180 ku以上区域,同时凝胶顶部上样孔处可以观察到高分子量的蛋白质聚合物;推测原因可能是由于羟基自由基氧化造成蛋白质发生交联,蛋白质分子量增加[26]。需要指出的是周非白等[27]研究报道了氧化对蛋白质结构的影响与反应体系氧化剂浓度有关,较低浓度有利于蛋白交联,产生蛋白聚集体,而过高浓度的反而可能导致蛋白质组分的降解。在还原条件下,凝胶上样孔处堆积的大分子量蛋白显著减少,180 ku 附近的肌球蛋白重链和45 ku 附近肌动蛋白条带强度有明显增强,这表明二硫键是造成蛋白交联的主要作用力,且氧化中发生交联聚集的蛋白主要是肌球蛋白和肌动蛋白[28];结合上文羰基、巯基含量的变化,SDS-PAGE的结果可以进一步证明氧化导致肌原纤维巯基含量下降的部分原因是共价键交联(二硫键等),在凝胶顶部仍然存在部分大分子量的聚集体残留,表明样品中还存在其它非二硫键的共价键参与了蛋白质交联,如希夫碱和二酪氨酸等[27]。还原剂添加后的样品可发现肌球蛋白重链条带强度呈上升趋势,肌动蛋白条带呈下降趋势。同样发现在120 ku 附近有新的不连续条带生成,这可能是由于高温处理组DMP 结构发生改变,肌浆蛋白中的糖原磷酸化酶附着在骨架蛋白(即肌原纤维蛋白)上被提取出来[3]。在17 ku 附近可以观察到无还原剂的样品有清晰的肌球蛋白轻链3(MLC3)条带和模糊的肌球蛋白轻链2(MLC2),而在还原条件下样品肌球蛋白轻链3 条带强度明显减弱,且在20 ku 附近出现清晰的肌球蛋白轻链2。

图5 不同过氧化氢氧化梯度对不同温度预处理鸭肉肌原纤维SDS-PAGE 图谱(a)及肌球蛋白(b)和肌动蛋白(c,d)免疫印迹结果的影响Fig.5 Effects of different hydrogen peroxide oxidation gradients on SDS-PAGE profile of DMP (a) and western-blotting of myosin (b)and actin (c,d) in duck myofibrils pretreated at different temperatures
肌球蛋白蛋白免疫印记实验结果如图5b 所示,非还原组样品结果发现蛋白全部聚集在加样孔附近,且印迹强度与电泳染色结果有相同的趋势。还原组结果显示180 ku 附近的肌球蛋白重链条带大量聚集,与电泳结果中发现的交联聚集的蛋白主要是肌球蛋白重链和肌动蛋白一致。样品7~9 为0 ℃处理组肌原纤维,印迹强度基本处于同一水平,40 ℃处理组印迹强度呈明显的上升趋势,这是因为40 ℃处理组肌球蛋白的蛋白结构发生了改变,较0 ℃处理组肌球蛋白更容易受到羟基自由基的影响。肌动蛋白蛋白免疫印迹实验结果如图5c、5d 所示,其中图5c 为非还原条件,大部分肌动蛋白交联成大分子量蛋白聚集体堆积在凝胶的上部,在45 ku 附近可以观察到部分肌动蛋白蛋白条带;印迹强度也与电泳结果有相同的趋势。对比1 和6 号样品,6 号样品的大分子量条带强度强于1 号样品,45 ku 处的肌动蛋白条带则是1 号样品更强,说明高氧化力度下的高温处理组肌原纤维氧化程度更高,蛋白间交联的程度更高,有更多的肌动蛋白被交联聚集成高分子量的肌动球蛋白聚合物。图5d 为还原状态免疫印迹结果,发现45 ku 附近的肌动蛋白条带强度明显增加,上部分的大分子量蛋白聚集体条带强度减弱,并且55~130 ku 区间有新的小分子量蛋白出现。在顶部进样孔处可以观察到随着氧化力度增加逐渐增强的蛋白聚集,这表明肌球蛋白中还存在着除二硫键外的其它相互作用力参与蛋白质的交联过程,且这种作用力也会受到过氧化氢浓度的影响[28]。
2.4 凝胶微观结构的影响
不同过氧化氢氧化梯度对不同温度预处理鸭肉肌原纤维凝胶结构的影响如图6所示。随着氧化梯度的增加,鸭肉肌原纤维凝胶空洞变大,形成大小不同的分散凝胶胶束且胶束内部网络结构越来越致密,而未经过氧化处理的肌原纤维凝胶结构相对比较均一。网络结构在10 mmol/L 过氧化氢处理后形成的凝胶网络的均匀性显著降低且空隙增加。需要指出的是,同一氧化梯度下,40 ℃处理组结构整体松散程度高于0 ℃处理组,侧面反映其蛋白质的凝胶特性下降,与之前保水性结果相吻合。以上结果表明,40 ℃处理组肌原纤维结构更容易受到氧化因素的影响,最终影响其凝胶特性[29]。许多研究表明羟基自由基氧化导致了蛋白质的变性,结构更加松散无序,同时在凝胶网络结构形成过程中由于分子间作用力受到影响,而降低了形成凝胶三维网状结构的作用力,最终弱化凝胶网络结构[30,31]。

图6 不同过氧化氢氧化梯度对不同温度预处理鸭肉肌原纤维凝胶结构的影响Fig.6 Effects of different hydrogen peroxide oxidation gradients on the structure of duck myofibril gel pretreated at different temperatures
3 结论
宰后不同温度处理的DMP随着羟基自由基处理浓度的提高其羰基含量和表面疏水性升高、而巯基含量和保水性均表现出下降趋势,同时氧化导致了分子间交联度提升,形成凝胶品质下降。尤其需要指出的是,高温预处理组肌原纤维结构更容易受到氧化因素的影响。总之,在羟自由基氧化体系中对蛋白质的氧化存在着明显的浓度效应。以上研究表明在鸭肉的生产加工中,宰后初期应避免高温同时尽量控制引起肌原纤维蛋白氧化的外界因素。
