藏灵菇发酵富集青稞中β-葡聚糖和γ-氨基丁酸的工艺优化
2022-12-14张奋搏陈琼蒋涛焦迎春
张奋搏,陈琼,蒋涛,焦迎春
(青海大学农牧学院,青海西宁 810016)
青稞(Hordeum vulgareLinn.var.nudumHook.F.),又名裸大麦,是青藏高原特有的大麦变种[1]。青稞中含有β-葡聚糖、γ-氨基丁酸等活性物质,其中β-葡聚糖具有预防高血压、调节血糖和胆固醇的作用,能够改善肠道环境和胰岛素敏感性,降低直肠癌和心血管疾病发病率[2-4];γ-氨基丁酸是一种非蛋白质氨基酸,对脑损伤具有一定的保护作用,也具有抗癌等活性功能[5],因此青稞中的β-葡聚糖和γ-氨基丁酸是具有开发潜力的食品功能因子。藏灵菇(Tibetan Kefir)用于发酵牛乳制备酸奶,发酵过程中形成的富有弹性的乳白色菜花或米粒状团块[6],主要由乳酸菌、酵母菌和醋酸菌等多种微生物组成,具有改善肠道菌群、抗感染、降血脂等诸多益生作用。由藏灵菇制备的发酵乳与传统酸乳在风味、口感和质地等品质特征方面有明显差异,是一种良好的生物发酵剂[7]。
青稞中β-葡聚糖、γ-氨基丁酸天然存在含量低,很难实现产业化和规模化的发展,因此需要对青稞中现有的β-葡聚糖和γ-氨基丁酸进行有效的富集,目前富集青稞中β-葡聚糖跟γ-氨基丁酸的方法有很多,比如发酵法、混合菌发酵法、添加酶制剂法以及超声波处理等[8],混合菌发酵将两种在发酵特征上具有互补性的菌进行混合以弥补单一菌种发酵的不足,但该方法要考虑菌种的生长周期是否相同,产物是不是对另一种菌种产生抑制作用等[6];添加酶制剂法可以参与植物体内多种生理活动,但该方法对酶制剂要求高,成本高[10];超声波处理法则将植物处理后还需要进一步纯化出β-葡聚糖、γ-氨基丁酸,实验步骤较长。而发酵法具有成本低,富集含量高的特点,并且具有发酵速度快、安全性高、发酵周期短等特点,是一种安全且高效的方法。目前对藏灵菇的研究还很少,大部分研究是对藏灵菇菌种所含菌群进行分离鉴定以及功能测定[11]。也有部分学者对藏灵菇菌种发酵酸奶工艺的研究,但是针对藏灵菇发酵青稞的研究很少。
综上所述,本研究采用青藏高原特色作物青稞为原料,藏灵菇作为发酵剂,通过单因素试验和响应面试验设计,以β-葡聚糖、γ-氨基丁酸的得率为指标对青稞中β-葡聚糖和γ-氨基丁酸的富集工艺进行研究,旨在为青稞中营养物质的开发利用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
材料:青稞购自青海省互助县;藏灵菇为青海大学农牧实验楼保藏。
主要仪器:WDP-450 电热恒温培养箱,上海安亭科学仪器有限公司;400Y 多功能粉碎机,永康市铂欧五金制品有限公司;YM50 立式压力蒸汽灭菌锅,上海三申医疗器械有限公司;LR10M 大容量冷冻离心机,湖南赫西仪器装备有限公司;DHG-9070A 电热鼓风干燥箱,上海一恒科技有限公司。
主要试剂:硼酸、重蒸酚、无水乙醇、次氯酸钠、氢氧化钠、磷酸氢二钠、磷酸二氢钠等均为分析纯,β-葡聚糖标品、γ-氨基丁酸标品,北京索莱宝科技有限公司。
1.2 试验方法
1.2.1 试验处理
(1)青稞处理:清理掉青稞中的沙石、泥块、麦壳等,将泥土、沙尘清洗后放在电热鼓风干燥箱中烘干,待青稞冷却后,粉碎。
(2)菌种活化:将藏灵菇放入筛筐中来回晃动,将牛乳筛出去,用凉开水反复冲洗干净,将清洗好的藏灵菇放入干净的容器中,倒入纯牛奶,并淹没藏灵菇,而后将容器用纱布封好,置于室温下活化,每隔24 h 换一次牛奶。
(3)培养基制备:将粉碎好的青稞与水按一定的料液比加入锥形瓶中制成青稞培养基,封口后在121℃、15 min 下进行高温灭菌。
(4)发酵:将活化好的菌种按设定的接种量接入青稞培养基中,按设定温度和时间进行发酵。
(5)离心、测吸光值:发酵至一定时间后,进行离心操作,在4 000 r/min 的条件下离心10 min,然后取离心后的上清液,备用,以测定β-葡聚糖标品和γ-氨基丁酸含量。
1.2.2 测定方法
1.2.2.1β-葡聚糖测定
标准曲线测定:参照刘新琦等[12]测β-葡聚糖标准曲线的方法,得到回归方程:y=6.664x+0.222,R²=0.999。
样品得率测定:取发酵液5 mL 放入离心管,4 000 r/min 离心10 min,取离心后上清液2 mL,样品在550 nm 处的吸光度值按上述方法测量,根据回归方程计算样品β-葡聚糖含量。按下式计算样品中β-葡聚糖得率:

式中:
X——β-葡聚糖得率,%;
m1——β-葡聚糖含量,mg/g;
V——上清液体积,mL;
m2——青稞粉质量,g。
1.2.2.2γ-氨基丁酸测定
标准曲线测定:按照刘栋等[13]测定γ-氨基丁酸标准曲线的方法,得到回归方程:
y=1.92x-0.006 2,R²=0.996 5。
样品得率测定:取发酵液5 mL 放入离心管,4 000 r/min 离心10 min,取离心后上清液2 mL,样品在645 nm 处的吸光度值按上述方法测量,根据回归方程,计算样品γ-氨基丁酸含量。按如下公式计算样品γ-氨基丁酸得率:

式中:
Y——γ-氨基丁酸得率,%;
m1——γ-氨基丁酸含量,mg/g;
V——上清液体积,mL;
m2——青稞粉质量,g。
1.2.3 单因素试验设计
1.2.3.1 料液比对青稞中活性物质的影响
分别设置β-葡聚糖料液比(m/V)为1:15、1:20、1:25、1:30、1:35;γ-氨基丁酸料液比为1:20、1:25、1:30、1:35、1:40,发酵温度为20 ℃,发酵时间24 h,测定发酵液中β-葡聚糖、γ-氨基丁酸的得率,研究不同料液比分别对青稞中β-葡聚糖、γ-氨基丁酸得率的影响,确定最佳料液比。
1.2.3.2 接种量对青稞中活性物质的影响
分别设置接种量(m/m)梯度为2.5%、5%、7.5%、10%、12.5%,保持料液比为1:30,发酵温度20 ℃,发酵时间24 h,测定发酵液中β-葡聚糖、γ-氨基丁酸的得率,研究不同接种量对青稞中β-葡聚糖、γ-氨基丁酸的得率的影响,确定最佳接种量。
1.2.3.3 发酵时间对青稞中活性物质的影响
分别设置β-葡聚糖发酵时间梯度为12、24、36、48、60 h,γ-氨基丁酸发酵时间梯度为4、6、8、10 12 h,各保持料液比为1:30,接种量5%(m/m),发酵温度20 ℃,测定发酵液中β-葡聚糖、γ-氨基丁酸得率,研究不同发酵时间对青稞中β-葡聚糖、γ-氨基丁酸得率的影响,确定最佳发酵时间。
1.2.3.4 发酵温度对青稞中活性物质的影响
分别设置发酵温度梯度为25、32、37、40、45 ℃,保持料液比为1:30,接种量为5%(m/m),发酵时间24 h,测定发酵液中β-葡聚糖、γ-氨基丁酸的得率,研究不同发酵温度对青稞中β-葡聚糖、γ-氨基丁酸的得率的影响,确定最佳发酵温度。
1.2.4 响应面实验设计
在单因素试验的基础上,以接种量、发酵温度、发酵时间为考察因素,通过软件Design-Expert 8.0.6 进行试验设计,设计因素与水平见表1、表2。

表1 β-葡聚糖响应面试验因素及水平Table 1 β-glucan response surface test factors and levels

表2 γ-氨基丁酸响应面试验因素及水平Table 2 Response surface test factors and levels of γ-aminobutyric acid
1.3 数据处理
试验重复三次,结果以平均值±标准差表示,用Excel 软件进行统计分析,Origin 2018 作图分析,SPSS 23.0 进行显著性分析,Design-Expert 8.0.6 软件对响应面试验进行设计和分析。
2 结果与分析
2.1 单因素试验
2.1.1 料液比对青稞中活性物质的影响
藏灵菇发酵青稞富集β-葡聚糖的最佳料液比为1:25。由图1a 可以看出,藏灵菇发酵青稞的过程中β-葡聚糖的得率随着料液比的减小呈先升高后降低的趋势,β-葡聚糖的得率在料液比为1:25 时达到最大值30.25%,相对于最低料液比,提高了1.52 倍,差异显著(p<0.05)。这可能是因为料液比太小,β-葡聚糖无法完全溶解,但是料液比太大,增加了水的消耗,因此选择富集β-葡聚糖的最佳料液比为1:25,这与康田田等[14]报道的发酵后青稞中β-葡聚糖含量变化结果稍有不同,该研究中β-葡聚糖含量随着料液比呈先增加后减少的趋势,而β-葡聚糖含量在达到一定值后趋于稳定,可能是因为原料不同,发酵剂不同。藏灵菇发酵青稞富集γ-氨基丁酸的最佳料液比为1:30。由图1b可以看出,藏灵菇发酵青稞的过程中γ-氨基丁酸的得率随着料液比的减小呈先升高后降低的趋势,γ-氨基丁酸的得率在料液比为1:30 时达到最大值39.08%,相对于最低料液比,提高了1.45 倍,差异显著(p<0.05)。这可能是因为料液比的大小会影响发酵系统的供氧,料液比低时供氧效果好,增加了菌体的流动性;料液比高时供氧效果较差,气体交换效果差,因此选择富集γ-氨基丁酸的最佳料液比为1:30。

图1 料液比对β-葡聚糖(a)、γ-氨基丁酸得率(b)的影响Fig.1 Effect of solid-liquid ratio on the yield of β-glucan (a) and γ-aminobutyric acid (b)
2.1.2 接种量对青稞中活性物质的影响
藏灵菇发酵青稞富集β-葡聚糖的最佳接种量为5%。由图2a 可以看出,藏灵菇发酵青稞的过程中,β-葡聚糖得率呈先升高后降低的趋势,β-葡聚糖的得率在接种量为5%时达到最大值35.37%,相较于最低接种量,提高了2.06 倍,差异显著(p<0.05)。这可能是因为5%的接种量下,发酵液已经达到了饱和程度,因此选择富集β-葡聚糖的最佳接种量为5%,这与刘新琦等[12]报道的发酵后青稞中β-葡聚糖含量随着接种量的增多先增加后减少的变化一致。藏灵菇发酵青稞富集γ-氨基丁酸的最佳接种量为5%。由图2b 可以看出,藏灵菇发酵青稞的过程中γ-氨基丁酸的得率随着接种量的减小呈先升高后降低的趋势,在接种量为5%时,γ-氨基丁酸的得率达到最大值54.02%,相对于最低接种量,提高了1.57 倍,差异显著(p<0.05)。出现该现象的原因可能接种量小时,菌体的适应期和对数期会相对延长,菌体在生长繁殖阶段的发酵能力较差,导致含量较低;而当接种量过大时,发酵可利用的发酵剂变多,导致发酵时间缩短,使得发酵不完全导致含量减少,因此选择富集γ-氨基丁酸的最佳接种量为5%,这与张园林等[15]报道的发酵后青稞中γ-氨基丁酸含量随着菌种添加量的升高先增加后减少的变化一致。

图2 接种量对β-葡聚糖(a)、γ-氨基丁酸(b)得率的影响Fig.2 Effect of inoculation amount on the yield of β-glucan (a)and γ-aminobutyric acid (b)
2.1.3 发酵时间对青稞中活性物质的影响
藏灵菇发酵青稞富集β-葡聚糖的最佳发酵时间为36 h。由图3a 可以看出,藏灵菇发酵青稞的过程中,β-葡聚糖的得率随着发酵时间的增加呈先升高后降低的趋势,得率在36 h 时达到最大值43.45%,相对于最低发酵时间,提高了1.29 倍,差异显著(p<0.05)。这可能是因为发酵前期,β-葡聚糖酶活性较小,降解速率较慢,随着时间增加,酶活性增强,使得β-葡聚糖降解加快,因此选择富集β-葡聚糖的最佳发酵时间为36 h,这与刘新琦等[12]的研究结果相一致,发酵后的青稞中β-葡聚糖得率随着发酵时间的延长先增加后减少。藏灵菇发酵青稞富集γ-氨基丁酸的最佳发酵时间为8 h。由图3b 可以看出,藏灵菇发酵青稞的过程中,γ-氨基丁酸的得率随着发酵时间的增加呈先升高后降低的趋势,γ-氨基丁酸的得率在8 h时达到最大值60.74%,相对于最低发酵时间,提高了1.64 倍,差异显著(p<0.05)。这可能是因为在发酵初期,蛋白酶没有充分激活,随着时间延长,蛋白质水解形成了谷氨酸,在谷氨酸脱羧酶的作用下使得谷氨酸转化为γ-氨基丁酸[15],后期γ-氨基丁酸富集,促进γ-氨基丁酸转氨酶的活性增强,使γ-氨基丁酸转化为琥珀酸半醛酸,导致含量下降,因此选择富集γ-氨基丁酸的最佳发酵时间为8 h。

图3 发酵时间对β-葡聚糖(a)、γ-氨基丁酸(b)得率的影响Fig.3 Effect of fermentation time on the yield of β-glucan (a) and γ-aminobutyric acid (b)
2.1.4 发酵温度对青稞中活性物质的影响
藏灵菇发酵青稞富集β-葡聚糖的最佳发酵温度为37 ℃。由图4a 可以看出,β-葡聚糖的得率随着发酵时间的增加呈先升高后降低的趋势,得率在37 ℃时达到最大值45.01%,相对于最低发酵温度25 ℃,提高了1.96 倍,差异显著(p<0.05)。这可能是因为在37 ℃时新陈代谢所需的酶活性达到较高水平[16],因此选择富集β-葡聚糖的最佳发酵温度为37 ℃。藏灵菇发酵青稞富集γ-氨基丁酸的最佳发酵温度为37 ℃。由图4b可以看出,γ-氨基丁酸的得率随着发酵时间的增长呈先升高后降低的趋势,得率在37 ℃时达到最大值51.98%,相对于最低发酵温度25 ℃,提高了1.81 倍,差异显著(p<0.05)。这可能是因为温度过高或过低则会破坏部分谷氨酸脱羧酶的活性,导致γ-氨基丁酸的含量下降,因此选择富集γ-氨基丁酸的最佳发酵温度为37 ℃,这与冯志彬等[17]报道的发酵后青稞中γ-氨基丁酸得率的变化一致,均随温度的升高得率呈先增加后减少的趋势。
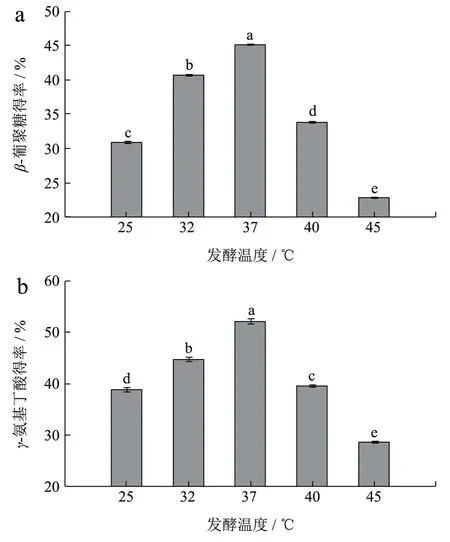
图4 发酵温度对β-葡聚糖(a)、γ-氨基丁酸(b)得率的影响Fig.4 Influence of fermentation temperature on the yield of β-glucan (a) and γ-aminobutyric acid (b)
2.2 响应面实验
2.2.1β-葡聚糖响应面分析
2.2.1.1 响应面试验设计及结果
在单因素实验结果的基础上,应用响应面优化藏灵菇发酵青稞富集β-葡聚糖的条件,选择发酵温度(A)、接种量(B)、发酵时间(C)作为试验因素,以β-葡聚糖得率为响应值,进行三因素三水平的响应面试验,如表3。

表3 β-葡聚糖响应面试验设计及结果Table 3 Design and results of β-glucan response surface test
2.2.1.2 回归模型拟合及方差分析
进行回归拟合,得到回归模型方程为:R1=48.32+1.15A-0.64B+0.084C+0.38AB-0.96AC+0.83BC-7.06A²-6.75B²-10.49C²。回归方程模型项p<0.000 1,失拟项p=0.054 1>0.05,失拟项不显著,表明建立的回归方程拟合良好。影响因子A、B的p<0.05,表明发酵温度(A)、接种量(B)对β-葡聚糖的得率的影响较显著。二次回归方程的决定系数R2为99.81%,说明99.81%的响应值变化可以用该模型解释。校正决定R2=99.56%,与R2相近,进一步说明了模型的显著性。所以可以利用此模型和方程确定藏灵菇发酵青稞富集β-葡聚糖的最佳富集工艺。比较各项p值可以看出各因素对响应值的影响大小为A>B>C,即发酵温度>接种量>发酵时间。各因素之间存在交互作用,交互作用显著性依次为AC>BC>AB。
2.2.1.3 响应面各因素交互作用分析
从图5可以看出,AC 和BC 的响应面比AB 的坡度更陡峭,AC 的响应面比BC 的坡度更陡峭,说明发酵温度、发酵时间和接种量、发酵时间的交互作用对β-葡聚糖得率的影响极显著,而发酵温度、接种量的交互作用不显著。

图5 β-葡聚糖的响应面图和等高线图Fig.5 Response surface and contour plot of β-glucan
从图5的响应面图可以看出,发酵温度、接种量、发酵时间对发酵青稞中β-葡聚糖得率的影响均呈现先升高后降低的趋势,且β-葡聚糖的得率在三因素所设定的水平范围内均存在最高值。从等高线图中可以看出交互作用AC、BC 等高线比起交互作用AB 等高线更为密集,说明影响的显著性顺序为AC>BC>AB,这与方差分析的结果一致。
2.2.2γ-氨基丁酸响应面分析
2.2.2.1 响应面试验设计及结果
在单因素实验结果的基础上,应用响应面优化藏灵菇发酵青稞富集γ-氨基丁酸的条件,选择发酵温度(A)、接种量(B)、发酵时间(C)作为试验因素,以γ-氨基丁酸得率为响应值,进行三因素三水平的响应面试验,如表4。

表4 γ-氨基丁酸响应面试验设计及结果Table 4 Design and results of γ-aminobutyric acid response surface test
2.2.2.2 回归模型拟合及方差分析
进行回归拟合,得到回归模型方程为:R1=+54.50+0.66A+0.66B+0.93C+0.11AB+1.27AC-1.58BC-4.47A²-5.13B²-5.31C²。回归方程模型项p<0.000 1,失拟项p=0.274 3>0.05,失拟项不显著,表明建立的回归方程拟合良好。影响因子A、B、C的p值均小于0.05,表明发酵温度(A)、接种量(B)、发酵时间(C)对γ-氨基丁酸的得率的影响较显著。二次回归方程的决定系数R2为98.68%,说明98.68%的响应值变化可以用该模型解释。校正决定系R2=98.98%,与R2相近,进一步说明了模型的显著性。所以可以利用此模型和方程确定藏灵菇发酵青稞富集γ-氨基丁酸的最佳富集工艺。比较各项p值可以看出各因素对响应值的影响大小为C>A>B,即发酵时间>发酵温度>接种量。各因素之间存在交互作用,交互作用显著性依次为BC>AC>AB。
2.2.2.3 响应面各因素交互作用分析
从图6可以看出,BC和AC的响应面比AB的坡度更陡峭,BC的响应面比AC的坡度更陡峭,说明接种量、发酵时间和发酵温度、发酵时间的交互作用对γ-氨基丁酸得率的影响极显著。
从图6的响应面图可以看出,因素发酵温度、接种量、发酵时间对发酵青稞中γ-氨基丁酸得率的影响均呈现先升高后降低的趋势,且γ-氨基丁酸的得率在三因素所设定的水平范围内均存在最高值。从等高线图中可以看出交互作用AC、BC等高线比起交互作用AB等高线更为密集,说明影响的显著性顺序为BC>AC>AB,这与方差分析的结果一致。

图6 γ-氨基丁酸的响应面图和等高线图Fig.6 Response surface and contour plot of γ-aminobutyric acid
2.3 验证试验
2.3.1β-葡聚糖验证试验
通过对回归方程进行分析,得到最佳工艺条件为:菌种添加量为5%、发酵温度为37 ℃、发酵时间为36 h。此条件下得出的β-葡聚糖的得率的理论值为48.18%。为证实结果是否正确,进行3 组重复的验证试验,试验得到的β-葡聚糖的得率为48.26%,试验值与预测值吻合,说明建立的模型可靠。国内外对于青稞中β-葡聚糖的富集已有许多方法,如超声波提取法、酶制剂法、多菌种发酵法、发芽法等。罗燕平等[18]通过微波辅助法,得到的β-葡聚糖的得率为5.92%;王谦等[19]采用超高压提取方法从青稞中提取β-葡聚糖,β-葡聚糖得率为3.72%;而本实验中,通过藏灵菇发酵,青稞中的β-葡聚糖得率为48.26%,较以上方法,本实验青稞中β-葡聚糖得率分别提高了8.15 倍(p<0.05)、12.97倍(p<0.05)。
2.3.2γ-氨基丁酸验证试验
通过对回归方程进行分析,得到最佳工艺条件为:菌种添加量为5%、发酵温度为37 ℃、发酵时间为8 h。此条件下得出的γ-氨基丁酸的得率的理论值为54.46%。为证实结果是否正确,进行3 组重复的验证试验,试验得到的γ-氨基丁酸的得率为54.51%,试验值与预测值吻合,说明建立的模型可靠。张圆林等[20]以红曲霉CH-1 发酵生产γ-氨基丁酸,得到的γ-氨基丁酸含量为17.19%;研究发现[21-23]选择浸泡发芽工艺富集γ-氨基丁酸,其含量达10.33%;本实验中,通过藏灵菇发酵,青稞中的γ-氨基丁酸得率为54.51%,与其他方法比较,分别提高了3.17 倍(p<0.05)、5.28 倍(p<0.05)。
3 结论
本研究以青藏高原特色作物青稞为原料,采用藏灵菇进行液体发酵,通过单因素试验和响应面试验,以β-葡聚糖、γ-氨基丁酸的得率为测定指标对青稞中富集β-葡聚糖和γ-氨基丁酸的工艺进行研究。
通过单因素试验确定藏灵菇发酵富集青稞中β-葡聚糖的最佳条件为料液比1:25,藏灵菇接种量5%,发酵温度37 ℃,发酵时间36 h;富集青稞中γ-氨基丁酸的最佳条件为1:30,藏灵菇接种量5%,发酵温度37 ℃,发酵时间8 h。
通过响应面试验得出发酵富集β-葡聚糖的最佳藏灵菇接种量为5%,发酵温度为37 ℃,发酵时间为36 h;富集γ-氨基丁酸的最佳藏灵菇接种量为5%,发酵温度为37 ℃,发酵时间为8 h,得到的β-葡聚糖的得率为48.17%,γ-氨基丁酸的得率为54.46%,通过验证试验得出β-葡聚糖的得率是48.26%,γ-氨基丁酸的得率是54.51%,β-葡聚糖得率较未发酵前提高了1.93 倍(p<0.05),γ-氨基丁酸得率较未发酵前提高了1.8 倍(p<0.05)。
结果表明,藏灵菇发酵能够有效富集青稞中的营养物质,为青稞中营养物质的开发利用提供了理论依据和数据基础,为青稞的深加工利用提供参考。
