果胶活性片段的定向制备与表征
2022-12-14曾繁濠季杏迪王兆梅曹晶潘振辉黄灿庆罗歆桐
曾繁濠,季杏迪,王兆梅,曹晶,潘振辉,黄灿庆,罗歆桐*
(1.广州酒家集团利口福食品有限公司,广东广州 511442)(2.华南理工大学食品科学与工程学院,广东广州 510640)
果胶是自然界中最为丰富的结构多糖,近年来,一类由果胶降解得到的具有突出生物活性的“改性果胶”(Modified Pectin,MP)受到广泛关注,其中以抗肿瘤活性最为引人注目[1-4],一种改性柑橘果胶(GCS-100)处于Ⅱ期的临床研究可用于免疫和抗肿瘤辅助调节[5]。然而原果胶是一种结构复杂的酸性杂多糖,包含两个主要的结构区域,即聚半乳糖醛酸(Homogalacturonan,HG)和鼠李半乳糖醛酸I(RG-I)[6],因此需要优化果胶结构得到高活性片段。目前通过化学降解、酶法降解、超声降解[7]等获取MP,其中果胶的光催化降解是利用过氧化氢产生的自由基裂解果胶中的GalA,得到富含RG-I 的果胶片段。与原果胶相比,降解修饰后的改性果胶活性更强,因此能更好地发挥其免疫调节和抗肿瘤作用[8]。
大量的同行研究和临床试验结果显示,MP 的抗肿瘤活性与其对半乳糖凝集素-3(Galectin-3,Gal-3)显著的拮抗作用密切相关[9,10]。Gal-3 能通过糖识别结构域(Carbohydrate Recognition Domain,CRD)与半乳糖残基通过受体-配体作用产生特异性结合,与癌细胞表面大量表达的Gal-3 相互识别,阻断Gal-3 与其他蛋白质及多肽的结合,进而抑制Gal-3 介导的肿瘤细胞的吸附与迁移[11,12]。因此,Gal-3 是近年来糖生物学领域倍受关注的抗癌药物新靶点,是临床检验肿瘤的重要指标之一。
鉴于果胶相关的抗肿瘤活性与其对Gal-3 的多价结合而产生的拮抗作用密切相关,本文提出基于果胶与Gal-3 的糖-凝集素配体特异性结合的原理,从复杂的果胶降解片段中定向分离与Gal-3 结合的活性潜力片段,验证其抑制肿瘤细胞增殖的活性,为优化果胶降解方法,发掘高活性的果胶片段食品功能因子提供依据。
1 材料与方法
1.1 原料
柑橘果胶(P9135,≥99%),上海Sigma Aldrich公司;人重组半乳凝集素-3,美国BioVison 公司。
1.2 主要仪器设备
制备改性果胶的光催化降解设备主要由CEL-LAB500光化学反应仪、CEL-LX1000 低温冷却循环水泵、500WLMLS 500 W 长弧汞灯泡三部分组成,均购自北京奥莱特有限公司;XSP-11C 光学显微镜,上海光学仪器厂;MCO-175 CO2细胞培养箱,日本SAMYO 公司;Infinite M200 多功能酶标仪,瑞士Tecan 公司。
1.3 试验方法
1.3.1 酸碱协同紫外光催化过氧化氢氧化法降解果胶
根据曹晶等[13]优化的紫外光催化过氧化氢氧化工艺(Ultraviolet Light Catalytic Hydrogen Peroxide Oxidation System,UHP)协同一定的酸碱微环境进行果胶降解。称取适量柑橘果胶粉末于去离子水中充分溶解至溶液浓度10 mg/mL。分别用1.0 mol/L 的HCl或NaOH 调节pH 值至4.0 和10.0,再向果胶溶液中滴加H2O2溶液(30%,V/V)使其最终浓度为0.03 mol/L。取20 mL 上述反应溶液置于光化学反应仪的石英试管中,在磁力搅拌与紫外光照射条件下反应不同时间(1、3、5、7 h),得到果胶降解溶液。反应结束后,立即用1.0 mol/L 的NaOH 或HCl 调节pH 值至中性,并加入4 倍体积的无水乙醇,隔夜静置沉降,7 104g离心15 min,得到的沉淀在60 ℃真空干燥得到果胶降解产物,根据反应酸碱度和时间分别用编号UHP 4-1、UHP 4-3、UHP 4-5、UHP 4-7、UHP 10-1、UHP 10-3、UHP 10-5、UHP 10-7 表示。准确称量果胶降解产物质量m1,原果胶质量m0,按公式计算每种降解产物的产率(C,%)。

1.3.2 分子质量
参考Yang 等[14]方法并作适当修改。用Waters 凝胶渗透色谱仪(GPC)测定果胶及降解产物的分子量。4~5 mg 果胶降解产物溶于2 mL 20 mmol KH2PO4缓冲溶液中,用0.45 μm 水系膜过滤。色谱条件:两根串联的TSK 凝胶柱TSK(G-5000PWXL,7.8×300 mm 和G-3000PWXL,7.8×300 mm),Waters 2414 示差检测器,洗脱液为20 mmol KH2PO4缓冲液(pH 值4.0),流量0.6 mL/min,柱温35 ℃,运行时间45 min。用不同重均分子量(Mw)葡聚糖标准品(1 400、668、410、273、148、48.6、23.8、11.6、5.2 ku)建立线性方程。
1.3.3 甲氧酯化度(Degree of Methylation,DM)和乙酰酯化度(Degree of Acetylation,DA)
果胶降解产物(10 mg)在0.5 mL 6 mmol CuSO4、1.0 mL 0.5 mol NaOH 和10 µL 4 mmol 异丙醇的溶液中4 ℃反应30 min,7 104g离心10 min。用0.5 mol HCl调pH 值2.0,用0.45 µm 膜过滤后待用。标准曲线用10 µL 100 µL/mL 异丙醇(IPA)、10 µL 100 µL/mL 乙酸(AcOH)、6 µL 甲醇(MeOH)和2 mL 超纯水测定。采用Waters 1525 高效液相色谱系统,C18色谱柱(SinoChrom ODS-BP,250×4.6 mm)和示差检测器(Waters 2414)。取20 µL注入HPLC 体系,柱温25 ℃,运行时间20 min,洗脱液为4 mmol H2SO4,流量为0.8 mL/min。以IPA 为内标得到MeOH 和AcOH 的响应因子FR,再计算出DM 和DA。
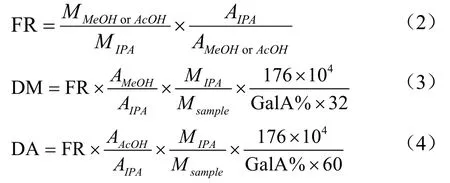
式中:
M——下标物质的质量;
A——下标物质的峰面积;
GalA%——样品中半乳糖醛酸的质量百分含量。
1.3.4 果胶降解产物的分离纯化
取1 mL 浓度为10 mg/mL 果胶降解产物缓慢加入到平衡后载有DEAE-cellulose 的层析柱(2.6 cm×60 cm)中,分别用蒸馏水和三个浓度梯度的NaCl 水溶液(通过预实验确定浓度梯度为0.1 mol、0.3 mol 和1.0 mol)洗脱,体积流量1.2 mL/min。收集主要洗脱馏分后,再用Sephadex G200(2.6 cm×60 cm)凝胶层析柱进一步纯化。收集峰最大的组分,透析后冷冻干燥,得到纯化的果胶降解片段,根据洗脱液组分分别用UHP 4-5-0、UHP 4-5-0.1、UHP 4-5-0.3 和UHP 4-5-1.0 表示。
1.3.5 Gal-3 诱导的红细胞凝集实验
Gal-3 诱导的红细胞凝集(Galectin-3-Mediated Hemagglutination,G3H)实验被普遍应用于鉴定某种物质是否为Gal-3 的抑制剂[15]。在V 型透明的96 孔板上,设定第一孔作为阴性对照组加入75 μL PBS,第二孔为阳性对照组加入50 μL PBS,其余除第三孔外各加入50 μL PBS。以PBS 为溶剂配置浓度为1 mg/mL 的待测果胶样品溶液,取100 μL 样品溶液加入到第三孔,然后按2 倍逐步稀释,静置10 min。除第一孔,其它所有孔各加25 μL 20 μg/mL Gal-3,混匀后静置30 min。所有孔各加25 μL 4%鸡血红细胞,25 ℃下静置1.5 h后观察鸡血红细胞的凝集状态。若红细胞最终沉降为一个小红点,则判断为完全不凝集;若红细胞在孔壁上大量凝集,则判断为完全凝集。以乳糖(Lac)、半乳糖(Gal)、CP、酶改性柑橘果胶(Pectasol-C)作为阳性对照,以完全抑制鸡血红细胞凝集所需样品的最小抑制浓度(Minimum Inhibition Concentration,MIC)表示样品的抑制活性。
1.3.6 肿瘤细胞增殖实验
选用CCK-8 比色法进行果胶降解产物抑制肿瘤细胞(HepG 2、MCF-7)增殖的实验,以及果胶降解片段对正常细胞毒性(293A)和肿瘤细胞(HepG2、MCF-7、HeLa)的抑制增殖实验。取对数生长期的细胞,用0.25wt%胰蛋白酶制成细胞悬液,控制细胞密度为每毫升5×104个。在96 V 型孔板上每孔接种100 μL细胞液,置于CO2培养箱的37 ℃条件下培养。当细胞密度大于80%时,用PBS 润洗孔板3 次。加入100 μL不同浓度的样品,37 ℃继续培养6 h。而后缓慢吸出液体,再用PBS 润洗孔板3 次,每孔加入10 µL CCK8,37 ℃继续培养4 h。采用酶标仪在450 nm 处测定OD值,计算细胞增殖率,公式如下所示:

式中:
B——细胞增值率,%;
OD1——加样组平均OD 值;
OD0——正常对照组OD 值。
1.3.7 结构表征
1.3.7.1 红外光谱
采用FT-IR 光谱仪Vertex 70 测定样品的FT-IR 光谱。1 mg 样品与200 mg KBr 混合,压成薄片,在4 000~400 cm-1光谱范围内进行扫描分析。
1.3.7.2 单糖组成分析
用对羟基二苯法[16]测定GalA 含量。中性糖组成用高效阴离子交换色谱(HPAEC)测定[17]。总中性糖(NS)含量由岩藻糖(Fuc)、鼠李糖(Rha)、半乳糖(Gal)、阿拉伯糖(Ara)、葡萄糖(Glc)和木糖(Xyl)之和计算。
1.3.7.3 核磁共振分析
称取约30 mg 样品溶解于500 μL 的重水(99.96%)溶液中。在室温下用Bruker AVIII 600M 获取1H NMR谱。用标准Bruker 程序记录二维光谱HSQC。采用MestReNova 6.1.1 处理光谱。
1.3.8 数据分析
所有实验均进行3 次重复,数据处理和分析采用SPSS 25.0 和Origin 2018 软件。同一类不同处理的数据采用沃勒-邓肯多重检验方法,并用字母标注显著性(显著水平p<0.05)。
2 结果与分析
2.1 酸碱协同UHP 对果胶的降解
图1反映了在不同反应时间下酸碱协同UHP 降解果胶的结果与产物结构参数的变化。随着反应进行,果胶降解产物的产率不断下降,但本实验范围内最低产率仍高于50%。相比于碱协同UHP 反应(产率66.5%~94.2%),UHP 4 系列产物的得率(54.0%~75.4%)更低,这与酸性果胶更易发生降解有关。反应过程中果胶内部发生链裂解使分子量不断降低,如图1a 所示,UHP-4 系列产物的重均分子量由原果胶的641.2 ku 降低至65.3 ku,而UHP-12 的分子量更低为54.7 ku,这主要是由于碱性环境中果胶发生了去酯化和β-消除反应[18]。图1b 中UHP 10 的DM 值(38.74%~24.39%)相比UHP 4 的DM 值(56.01%~45.52%)显著降低,说明相同反应时间内UHP10 系列产物的降解程度更高,UHP 10 和UHP 4 在DA 值上的差异同是降解程度导致的,因此碱协同UHP 可以去除更多的甲氧基和乙酰基,而在酸性环境中更倾向于主链末端断裂的降解模式。值得注意的是,碱协同UHP 反应导致DM 和DA 较大程度地降低,因此,这一反应对果胶侧链小分子基团的酯化作用明显,与酸碱改性的作用相似[6],而与目前通常采用的酶法降解果胶不同[19],这将为果胶定向修饰提供一个新途径。
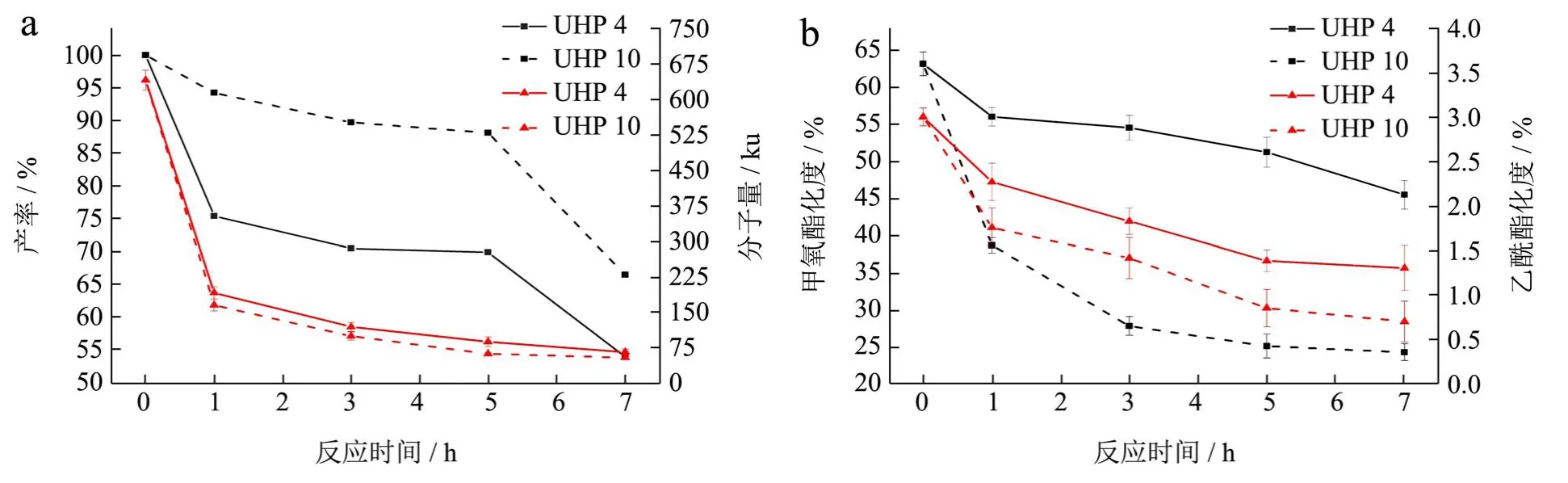
图1 不同反应时间下降解果胶片段的结构参数Fig.1 Structural parameters of pectin fragment prepared at different reaction time
2.2 活性引导果胶片段的纯化分离
红细胞膜表面分布着一定量的寡糖链,可被凝集素特异性识别并结合,因此向鸡红细胞中加入Gal-3 后产生细胞凝集,而当体系中添加含有乳糖Lac 或半乳糖Gal 的成分则可阻断二者结合,从而抑制红细胞凝集。图2为基于Gal-3 结合的活性引导果胶片段分离示意图及分离结果,柑橘果胶CP 和商业改性果胶Pectasol-C 的MIC 都大于1.0 mg/mL,果胶降解产物UHP 4-1 与UHP 10-1 的MIC 值均大于1.0 mg/mL,说明一定时间和程度的氧化降解对组分的结合能力有促进作用。随着果胶的不断降解,酸协同UHP 降解产物的MIC 值整体呈降低趋势,其中UHP 4-5 的MIC 值(0.125~0.25 mg/mL)最小,且与半乳糖相当,因此,UHP 4-5 与Gal-3 的结合能力等同于阳性对照组的半乳糖。而碱协同UHP 降解产物的MIC 值普遍偏高,仅有UHP 10-7 的MIC 值为0.25~0.5 mg/mL。因此对比分析,UHP 4系列产物抑制Gal-3介导的鸡血红细胞凝集的浓度更低,说明其与Gal-3 结合能力更强,这可能是由于碱性条件下果胶甲氧基的大量去除不利于降解产物与Gal-3 的结合。接下来,UHP 4-5 经过DEAE 纤维素柱层析和葡聚糖凝胶柱层析分离,得到4 种纯化组分UHP 4-5-0、UHP 4-5-0.1、UHP 4-5-0.3 和UHP 4-5-1.0,经红细胞凝集实验筛选,确定了其中的主要纯化组分UHP 4-5-0.3 为活性片段,MIC 值为0.016 mg/mL,约为乳糖的1/3、半乳糖的1/12,这一结果优于pH 改性的柑橘果胶[20],与人参花蕾果胶[21]、人参果胶[22]等果胶片段活性相当,因此具备进一步开发为Gal-3 抑制剂的潜力。在本文后面的研究中,所述的果胶片段如无特别说明,均指活性引导纯化后得到的果胶片段UHP 4-5-0.3。
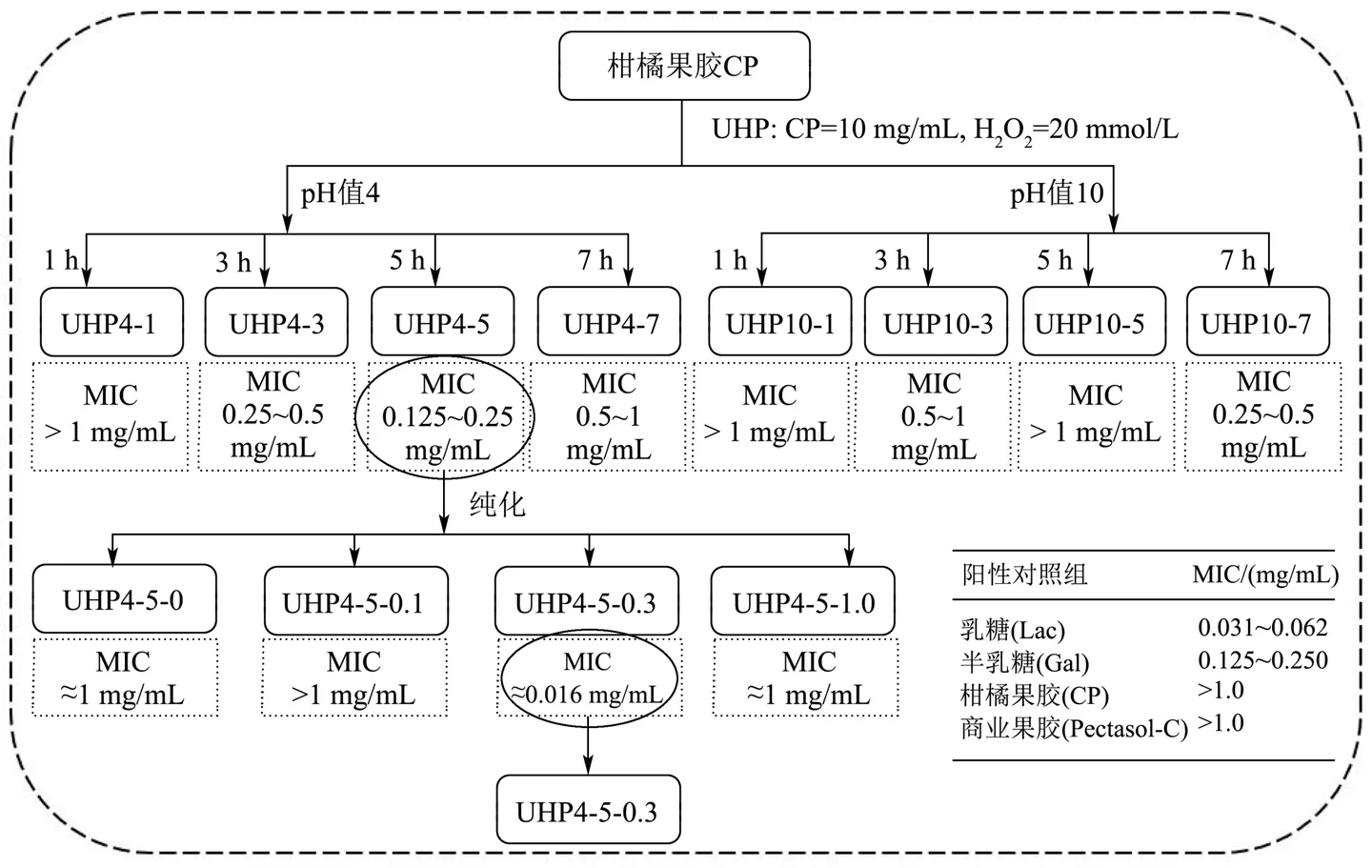
图2 活性引导果胶片段分离示意图Fig.2 Schematic diagram of activity-guided separation of pectin fragments
2.3 果胶降解产物对肿瘤细胞增殖的抑制作用
采用CCK-8 法分析不同浓度的果胶降解产物对Gal-3 高表达的肿瘤细胞存活率的影响,结果如图3所示。所有果胶降解产物在0.5 mg/mL 浓度下对应肿瘤细胞的存活率明显低于浓度0.1mg/mL 的相应组分,表明果胶降解产物对肿瘤细胞的增殖抑制作用呈浓度依赖性。图3a 中,在0.5 mg/mL 浓度下UHP 4 对HepG 2肿瘤细胞的抑制作用(细胞存活率71.9%~77.9%)低于UHP 10 对其的抑制作用(细胞存活率66.8%~74.0%),这与G3H 的结果一致。而在UHP 4 的系列产物中UHP 4-3 对HepG2 的抗增殖作用最大(77.9%),同时在G3H 实验中也表明UHP 4-3 与Gal-3 的结合活性最强。与CP(存活率47.4%)相比,高浓度的果胶降解产物对 MCF-7 的增殖抑制作用明显增强(81.2%~85.1%)。而0.1 mg/mL 浓度下的抑制作用与CP(22.3%)相近,其中在低浓度下UHP 4-5 的抗增殖作用最强(33.9%),这也与G3H 实验的结果一致。因此,可通过果胶片段与Gal-3 的结合活性判断其抗肿瘤增殖的能力。

图3 果胶降解产物对肿瘤细胞增殖的影响Fig.3 Effect of pectin degradation products on the proliferation of tumor cells
果胶片段对293A、HepG2、MCF-7 和HeLa 细胞存活率的影响如图4所示。未纯化的果胶片段UHP 4-5 对人正常肾细胞293A 的增殖活性无显著影响,而纯化后的UHP 4-5-0.3 在高浓度(0.5 mg/mL)下293A 细胞存活率降至72.1%,表明在此浓度下UHP 4-5-0.3 对正常细胞产生一定的毒性,这可能与高浓度下的高渗透压对细胞壁的机械损伤有关。纯化可以显著提高果胶片段的体外抗肿瘤活性,与UHP 4-5 相比,添加纯化后的UHP 4-5-0.3 所对应的肿瘤细胞的存活率加大幅度降低,在0.1 mg/mL 浓度下,添加UHP 4-5 后HepG 2 和MCF-7的细胞存活率分别为72.9%和66.1%,而添加UHP 4-5-0.3组的相应细胞存活率分别下降到27.2%和10.0%,这一现象与G3H 实验结果一致。而对于HeLa 细胞,低浓度的果胶片段展现出更强的增殖抑制作用,这可能是由于HeLa 细胞对果胶活性片段的敏感性更强,后续需降低浓度进行试验。但整体上,G3H 的实验结果可以反映果胶片段的抗肿瘤活性,说明UHP 4-5-0.3 可能通过与肿瘤细胞表面的寡糖链结合从而拮抗促转移蛋白Gal-3,最终抑制肿瘤细胞的增殖、聚集、粘附和转移[23,24]。然而,这一设想的详细机制还有待后续研究。

图4 果胶片段对四种细胞增殖活性的影响Fig.4 Effect of pectin fragment on the proliferation of four cells
2.4 结构表征
表1列出了纯化前后果胶片段的理化性质与单糖组成。在所有样品的单糖组成中,GalA 均是主要成分,平均摩尔百分比超过50%。经降解纯化后,Gal 的百分含量由CP 的12.7%增加到17.3%,同时研究表明富含半乳糖残基的多糖和果胶对糖-凝集素的结合起促进作用[25]。中性糖摩尔百分含量由CP 的22.41%增加到37.52%,这主要是由于UHP 反应过程中对果胶结构中的HG 部分产生定向降解从而去除了部分GalA[26]。中性糖如Xyl、Glc 和Rha 在降解处理后也显著增加,导致鼠李半乳糖醛酸(RG)结构域在最终产物中比例提高。此外,UHP 4-5 与UHP 4-5-0.3 的Rha/GalA 比值分别为0.14 和0.11,根据RG-I 型结构模型,Rha/GalA比值一般在0.05~1.0 之间[27],因此,推测酸协同UHP氧化降解得到的果胶片段是一种高度支化的RG-I 富集型果胶片段。此外,代表果胶线性度的指标GalA 与NS 摩尔比GalA/NS 从CP 的3.46 显著降低到1.08(UHP 4-5)和1.67(UHP 4-5-0.3),表明CP 由线性主导结构转变为分支结构。综上所述,原果胶的降解主要是通过破坏主要化学成分GalA,产生高度分支的RG-I 型果胶片段。
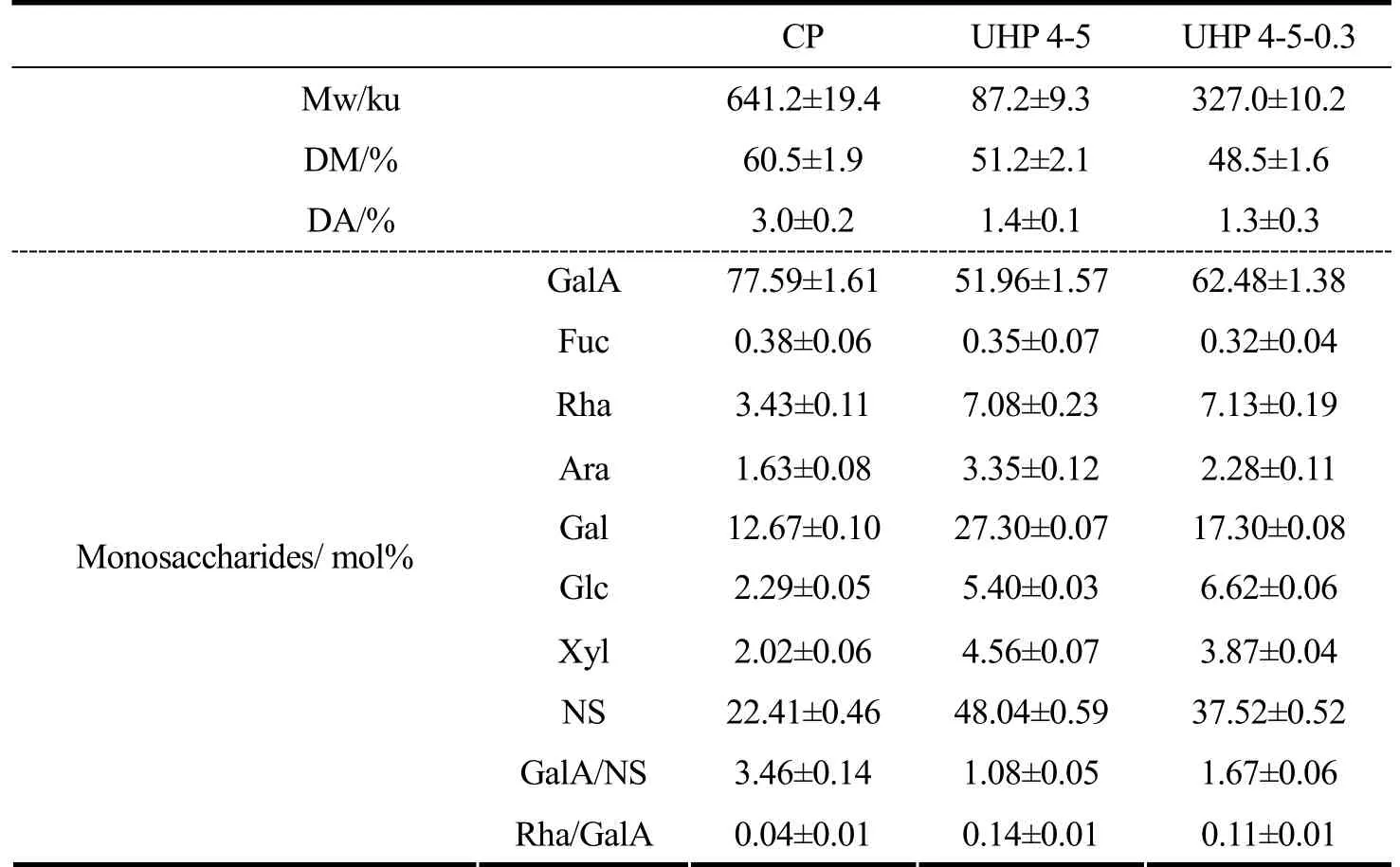
表1 果胶片段的单糖组成与结构Table 1 Monosaccharide composition and structure of the pectin fragments
果胶片段UHP 4-5-0.3 的红外光谱如图5a 所示,与CP 相比,UHP 4-5-0.3 在1 750 cm-1处(酯化羰基特征峰)的峰强度明显减弱,而在1 640 cm-1和1 446 cm-1处(游离羧酸基团特征峰)的峰强度增强,说明CP 降解过程中酯化度降低,这与图1中DM 值的变化趋势相同。1 200 cm-1至800 cm-1之间的光谱区域普遍被认为是多糖类化合物的特殊指纹区,与CP 和UHP 4-5 相比,UHP 4-5-0.3 在1 102 cm-1和1 012 cm-1处的吸收峰(阿拉伯半乳聚糖的特征峰)明显增强[28],而阿拉伯半乳聚糖常作为中性侧链与RG-I 相连接,表明纯化过程中富集了含有中性糖分支的果胶结构域。

图5 果胶片段的结构表征图Fig.5 Structure spectra of the pectin fragment
利用1H NMR 和HSQC 谱图分析了UHP 4-5-0.3 的分子结构。为了便于结构推测,本研究根据Mohnen[29]提出的果胶典型结构模型,将果胶片段结构简化为HG+RG-I,其中 RG-I 由重复的双糖单元[1,4-α-D-GalA-1,2-α-L-Rha-]n组成主链,大部分鼠李糖(Rha)残基被半乳糖等中性糖取代形成侧链。Rha 是RG-I 主链中唯一连接到分支的糖残基,因此根据1,2-Rha 和O-2,4-Rha 的摩尔数量和两者的数量比例推测分支数量。如图5所示1H NMR 和HSQC 谱图所提供的信息,1,2-Rha 和O-2,4-Rha 所对应的峰面积比分别为67.4%和32.6%,故UHP 4-5-0.3 中Rha 分支的数量约为46。根据单糖组成分析(表1),Gal 和Ara 是RG-I 侧链上除Rha 以外的主要中性糖,通过Ara/Gal的峰面积及两者与O-2,4-Rha 的数量比例,推测UHP 4-5-0.3中RG-I侧链平均由8个糖残基组成。根据HSQC谱图分析,RG-I 区域具有多种Ara 和Gal 类型(图5d),1→5 和1→t 连接的α-Ara 残基且面积比分别为56.4%和43.6%,说明UHP 4-5-0.3 存在一定量的α-1,5-Arab伴随着α-1,t-Arab 侧链,故UHP 4-5-0.3 中存在四种连接形式(1→4、1→6、1→3,6 与1→3)的Gal 残基,且28×10-6/92.23×10-6的H-1/C-1 信号为糖残基中的还原端。3.70×10-6归属于酯化GalA基团羧基部分的甲氧基,与CP 相比UHP 4-5-0.3 的信号强度弱,表明降解后的产物DM 值降低。GalA 上O-6 取代的甲酯残基的相关峰在4.55×10-6处的信号也在减弱,进一步证实了DM的变化。
2.5 果胶片段的结构模型
通过化学和谱图信息分析,推测出UHP 4-5-0.3 的分子结构如图6所示。果胶片段中的活性区域是具有中性糖侧链的RG-I 结构域,含有[-α-D-GalA-1,2-α-L-Rha-1-4-]n的双糖重复主链,分支度达到32.6%。通过谱图计算得到更详细的信息,RG-I约有46 条由Rha 连接的侧链,且平均侧链长达8 个糖残基。果胶片段的高活性与其半乳聚糖侧链的数目和长度紧密相关,高支化度的分子结构更有利于与Gal-3的多价结合作用[30]。而线性HG 结构域是由α-1,4-GalA组成,C-6 羧基处部分甲基化,O-2 和O-3 处轻度乙酰化,它的存在可以增强RG-I 结构域的生物活性[10]。

图6 果胶片段UHP 4-5-0.3 的结构模型Fig.6 A proposed structural model of the pectin fragment UHP 4-5-0.3
3 结论
采用酸碱协同紫外光催化氧化工艺降解柑橘果胶,生成低分子量、低酯化度、RG-I 富集的果胶片段。不同的分子特征的果胶片段结构的差异导致其与Gal-3多价结合能力不同。基于此,提出活性引导分离的思路,通过果胶活性片段与Gal-3 特异性结合的G3H 实验模型,筛选出结合能力强的果胶片段UHP 4-5。通过CCK-8 细胞增殖实验,验证了所选片段对多株肿瘤细胞显著的增殖抑制作用,证实果胶片段通过对Gal-3 的拮抗作用而产生抗肿瘤的潜力。结构分析确定了果胶片段主要是由具有中性糖侧链的RG-I 结构域和线性HG 结构域组成。本研究获得一种结构明确的高抗肿瘤活性的果胶片段,也为探寻高活性的Gal-3 多糖拮抗剂提供了新的思路。
