“麸曲+酒母”模式对丢糟发酵产酒的影响
2022-12-14黄亮任志强邓杰黄治国卫春会
黄亮,任志强,2,邓杰,2,黄治国,2,卫春会,2*
(1.四川轻化工大学酿酒生物技术及应用四川省重点实验室,四川宜宾 644000)(2.中国轻工业酿酒生物技术及智能制造重点实验室,四川宜宾 644000)
白酒是以大曲、小曲或麸曲等为糖化发酵剂,利用谷物原料(高粱、糯米、大米、小麦和玉米等),经蒸煮、糖化、发酵、蒸馏、陈酿、勾兑等工艺制成的蒸馏酒[1,2]。白酒丢糟是传统固态法白酒生产中的主要副产物,白酒与丢糟的产量比约为1:3[3]。白酒丢糟中含有较高的粗淀粉、粗蛋白、粗脂肪和粗纤维等,此外还含有多种氨基酸等[4-6]。近年来,随着白酒产量持续增加,丢糟产量也在不断增加。丢糟的有效处理一直是白酒行业的难题。目前丢糟的利用主要是生产饲料[7-9]、丢糟酒[10,11]和有机肥[12,13];此外还有生产有机酸[14]、燃料乙醇[15]、沼气[16,17]、氢气[18]等。
丢糟酒是以传统白酒丢糟为原料,普遍通过添加酵母、糖化酶等一种或多种发酵剂[19,20],经过发酵、蒸馏获得的白酒。丢糟的特点为酸度高,其中的淀粉经过反复蒸煮、多次返生,不利于糖化发酵。因此,在厌氧状态下丟糟中老化的淀粉难以被酵母利用。酸性环境还妨碍了酵母菌的生长繁殖,不利于产酒。因此,相比于常规的白酒生产,丢糟酒生产过程中需要的糖化发酵剂用量更大,提高了丢糟酒生产成本。目前丢糟酒生产存在的主要问题有以下三点:(1)丢糟酒的发酵条件不利于微生物的生长代谢;(2)用曲量大,成本高;(3)丢糟中的淀粉利用率和资源的利用率低。
本研究采用实验室酿造模型[21],以米根霉制备霉菌麸曲;以商品小曲为酵母菌源,用粮食糊化料液作为基质,对酵母菌进行复苏增殖制备出酒母醪液;再将麸曲与酒母醪液混合发酵浓香型丢糟酿造丢糟酒,以期为白酒行业生产丢糟酒提供一种新思路。
1 材料与方法
1.1 试验材料
1.1.1 试验材料与药品
某品牌小曲、高粱、玉米、大米、糯米、小麦、土豆、麸皮均为市售;丢糟由宜宾市某浓香型酒厂提供;米根霉(编号为R.oryzaeJQ-1),由酿酒生物技术及应用四川省重点实验室提供。麦芽汁培养基,青岛高科园海博生物技术有限公司;乙酸正丁酯(色谱纯),西格玛奥德里奇(上海)贸易。
1.1.2 仪器与设备
SW-CJ-1F 超净化工作台,上海博迅实业有限公司;LRH-100-MS 微生物培养箱,广东泰宏科学仪器股份有限公司;GI54DS 立式自动压力蒸汽压灭菌器,致微(厦门)仪器有限公司;DZKW-4 电热恒温水浴锅,上海科恒实业发展有限公司;DW-25W388 医用低温保存箱,青岛海尔特种电器有限公司;7890A-5975B气相色谱-质谱联用仪,美国Agilent 公司。
1.2 试验方法
1.2.1 粮食糊化料液与培养基的制备
(1)粮食糊化料液:粉碎高粱、小麦、大米、糯米、玉米、五粮混合物(高粱36wt%、小麦16wt%、大米22wt%、糯米18wt%、玉米8wt%),过100 目筛,各称取100 g,分别加入200 mL 去离子水,搅拌均匀后,加入到800 mL 沸水中加热至微沸状态,保持15 min,冷却至室温,定容至1 000 mL,即单粮糊化料液和五粮糊化料液。
(2)麦芽汁琼脂培养基:称取麦芽汁培养基130.10 g,加入去离子水定容至1 000 mL,121 ℃灭菌15 min。
(3)PDA 培养基:200 g 土豆丁煮沸,过滤,滤液加20 g 葡萄糖、20 g 琼脂,加入去离子水定容至1 000 mL,121 ℃灭菌15 min。
1.2.2 酒母醪液的制备
称取10 g 某市售小曲加入至冷却后的1 000 mL不同的粮食糊化料液中,搅拌均匀,28 ℃培养48 h,制得酵母扩培液,即酒母醪液。
1.2.3 商品小曲中酵母数量的测定
准确称取1.00 g 小曲,加入到装有99 mL 无菌生理盐水的锥形瓶内,用封口膜封口,置于摇床,28 ℃、200 r/min 下震荡30 min,吸取菌悬液进行梯度稀释,依次稀释至10-6。分别取10-4、10-5、10-6稀释度的菌悬液进行涂布,每个梯度做3 个平行,一组空白对照,28 ℃培养48 h 后,对酵母菌菌落计数。
1.2.4 酒母醪液中酵母数量的测定
平板菌落计数法:在发酵48 h 后,取10 mL 均匀样液加入含90 mL 无菌水的三角瓶中,混合均匀,静止后制得菌悬液,静至后取上清液进行梯度稀释,分别取10-4、10-5、10-6菌悬液各0.1 mL 涂布于PDA 平板培养基上,并做空白对照,28 ℃培养48 h 后,对酵母菌菌落计数。
血球计数板法:取不同稀释倍数的菌悬液0.10 mL 于血球计数板,分别数五个中格的酵母菌数,取平均值计算出酵母醪液中的酵母菌数。
1.2.5 麸曲制备工艺
参照文献[22]的麸曲制备工艺,将根霉菌R.oryzaeJQ-1 制备成麸曲JQ-1。
1.2.6 麸曲和酒母接种量对丢糟酒的影响
(1)为了考察麸曲接种量对丢糟酒酿造的影响,限定的酵母的接种量为每千克丢槽1.00×1010个,以麸曲的添加量为0.20wt%、0.40wt%、0.60wt%、0.80wt%、1.00wt%设计试验。
1.2.7 丢糟酒的酿造试验
(1)试验组:取丢糟6.00 kg,酒母醪液和霉菌麸曲的接种量分别为1.2.6 所得到的最佳接种量,均匀混合,装入发酵罐,30 ℃密闭发酵15 d。
(2)对照组:取丢糟6.00 kg,加入热水,使对照组和试验组的质量相同,小曲接种量为0.80wt%,均匀混合,装入发酵罐,30 ℃密闭发酵15 d。
1.2.8 理化指标的测定
糖化酶活力的测定:参考酿酒曲行业标准QB/T 4257-2011[23]。
出酒量的测定:取5.00 kg 酒醅进行蒸馏,得到的酒样充分混合,测量酒样度数和体积(以60% vol 计),即实际出酒量。
酒醅粗淀粉测定:采用酸水解法[24]测定酒醅中的淀粉含量。
淀粉出酒率:根据淀粉消耗量计算出5.00 kg 酒醅中理论出酒量(以60% vol 计),再用公式(1)计算淀粉出酒率。

式中:
中国教师:2016年寒假,新教育研究院携手媒体,共同发起了“寒假阅读指导计划”活动,旨在通过阅读指导师的专业指导,让家长掌握正确的亲子共读方法,培养孩子的阅读习惯。您怎么评价这个活动?您怎么看待家庭对于培养孩子阅读习惯的重要性?
A——淀粉出酒率,%;
V1——实际出酒量,mL;
V0——理论出酒量,mL。
1.2.9 丢糟酒风味检测
(1)样品前处理:复蒸酒样,调整度数为60% vol,取1 mL 进行分析,加入50 μL 乙酸正丁酯溶液(70 mg/100 mL),混匀。
(2)GC条件:DB-WAX(60.00 m×250 μm×0.25 μm)毛细管色谱柱;载气为99.999%氦气;进样口温度230℃;升温程序为:初温50 ℃,以8 ℃/min 升至100 ℃,保持5 min,再以10 ℃/min 升至170 ℃,保持3 min,最后以15 ℃/min 升至230 ℃,保持4 min,总运行时间29.25 min;载气体积流量为1 mL/min;不分流,进样量1 μL。
(3)MS 条件:电子电离源(Electron Ionization,EI),电子能量70 eV,离子源温度230 ℃,四级杆温度150 ℃,质量扫描范围35~400 u。
(4)定性定量分析:采用NIST05a.L 标准谱库检索、比对,进行定性分析;利用内标峰面积对挥发性物质进行定量分析。
1.3 数据分析
所有试验均重复三次,结果表示为“平均值±标准误”,采用SPSS 22.0 软件进行统计分析,Origin 9.1软件做图。
2 结果与分析
2.1 麸曲和商品小曲的糖化酶活力比较
分别测定麸曲JQ-1 和商品小曲的糖化酶活力,其中商品小曲的糖化酶活力较高,达到1 707.63 U/g;JQ-1 的糖化酶活力为1 507.91 U/g,两种曲的糖化酶活力具有显著差异(p<0.05)。霉菌麸曲JQ-1 的糖化酶的活力略低于商品小曲,与其他霉菌麸曲相比,酶活力处于较高水平[23],霉菌麸曲制作成功,可作为丢糟酒酿造的糖化剂使用。
2.2 商品小曲和酒母醪液中酵母数目的比较
按1.2.3 方法对所使用的小曲中的酵母菌进行计数,小曲中酵母数目为3.47×107CFU/g。不同原料制备的酒母醪液中酵母数目的测定结果如图1所示。结果表明,五粮酒母醪液中的酵母数量显著(p<0.05)高于单粮酒母醪液。酵母菌在以五粮糊化料液上的扩增效果最佳,酵母菌数达到了2.40×108CFU/mL,与培养前相比,酵母菌增殖近700 倍,表明酵母的扩培效果良好,可以为丢糟酒发酵提供充足的酵母菌源。原因可能是五粮糊化料液的营养丰富,更有利于酵母菌的增殖。从不同种类单粮的糊化料液增殖结果来看,高粱糊化料液扩培效果最佳。这符合单粮酿酒常选用高粱作为原料的实际情况。五种粮食中,以大米和糯米的总淀粉含量较高,高粱和糯米的支链淀粉含量较高[25],但糯米糊化料液中的酵母数量并不高,可能是因为高粱中有某些成分更有利于酵母的生长繁殖。不同粮食对酵母菌生长繁殖的影响还需要进一步试验。

图1 不同酒母醪液中的酵母菌数量Fig.1 Quantity of yeast in different barm mash
由此可见,在选用不同种类粮食对酵母进行扩配时,可以选择高粱或五粮,都可以实现对酵母菌的高效扩培。考虑到酵母将进入丟糟中发挥作用,不同原料扩培酵母可能存在适应上的差异性,在生产实践中可根据丟糟的原料成分来进行具体选择。本研究采用五粮型丟糟,因此选用五粮糊化料液进行酵母扩培。
2.3 麸曲和酒母接种量对丢糟产酒的影响
2.3.1 麸曲接种量对丢糟产酒的影响
麸曲主要提供糖化酶,将酒醅的淀粉分解为糖。酒醅的糖化过程是白酒酿造的重要环节,因此对麸曲的接种量进行探讨。按照0.20wt%、0.40wt%、0.60wt%、0.80wt%、1.00wt%的比例接种米根霉麸曲,30 ℃发酵15 d。由如图2可知,与酵母接种量对酒醅的影响进行比较,麸曲主要影响酒醅的淀粉含量,随接种量的增加,酒醅的淀粉含量逐渐降低,接种量为0.20%的淀粉含量显著高于其他接种量(p<0.05)。当接种量达到0.40%后,在增加接种量对酒醅的含量变化影响不显著(p>0.05)。可能是因为酒醅中的淀粉在反复蒸煮、发酵过程中,使淀粉老化,淀粉被纤维素包裹或连结,难以利用,酒醅中淀粉利用达到了一个极限值[21]。由如图2可知,不同的麸曲接种量对淀粉出酒率影响不显著(p>0.05),可能是因为麸曲主要影响淀粉的糖化过程,而酵母主要影响酒醅的产酒过程,因此应再对酵母接种量进行优化。综上所述,确定麸曲的接种量为0.40%。

图2 不同麸曲接种量对丢糟淀粉含量和淀粉出酒率的影响Fig.2 Effect of different amount of Fuqu on starch content and conversion rate of starch to ethanol of distiller's grains
2.3.2 酒母接种量对丢糟产酒的影响
酒母的接种量直接影响酒醅的出酒量和出酒率,因此对酒母接种量进行了探讨。选用五粮糊化料液对酵母进行扩培,分别按照每千克丢槽0.60×1010、0.80×1010、1.00×1010、1.20×1010、1.40×1010个接种,30 ℃发酵15 d。由如图3可知,随着酒母接种量的增加,酒醅的淀粉含量逐渐下降。接种量为每千克丢槽1.00×1010个时,酒醅淀粉含量显著低于接种量为每千克丢槽6.00×109个和每千克丢槽8.00×109个(p<0.05)。当再增加酒母接种量,酒醅的淀粉含量下降不显著(p>0.05)。由如图3可知,淀粉到酒的转化率随着接种量的增加逐渐增加,当接种量达到每千克丢槽 8.00×109个后,转化率增长不显著(p>0.05)。酒母醪液为丢糟发酵提供酵母菌,酵母属于兼性厌氧型微生物,在有氧条件和无氧条件下均可以生存,但是其呼吸方式不一样。有氧条件下,酵母通过TCA 循环途径,将糖类分解为水和二氧化碳,酵母大量生长繁殖,属于酵母的扩培阶段;在无氧条件下,酵母将糖发酵为乙醇和二氧化碳,属于乙醇发酵阶段[26]。随着乙醇的大量积累,乙醇对酵母有一定的毒害作用,会抑制了酵母的生长代谢。因此,将两阶段分开,先进行有氧繁殖,再进行无氧发酵,可能更利于酵母生产乙醇。综上,酒母的接种量确定为每千克丢槽1.00×1010个,此条件下,丢糟的淀粉消耗和淀粉出酒率均达到较高水平。
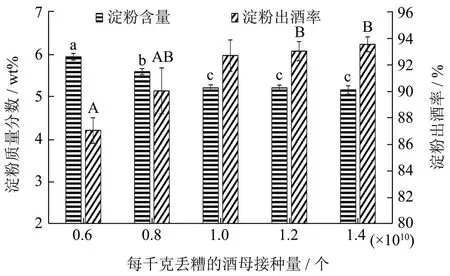
图3 不同酒母接种量对丢糟的淀粉含量和淀粉出酒率的影响Fig.3 Effect of different barm mash inoculum amount on starch content and conversion rate of starch to ethanol of distiller's grains
2.4 “麸曲+酵母”模式对丢糟淀粉的利用效果
由2.3 分别探讨了酵母和麸曲的接种量对丢糟酒酿造的影响,分别得到酵母和麸曲的最佳接种量为每千克丢槽1.00×1010个和0.40%。在此条件下在进行丢糟酒的酿造,以小曲做对照。酿造试验结果如图4所示,发酵前酒醅的淀粉含量为10.69%,对照组酒醅的残余淀粉为7.23%,发酵过程消耗的淀粉量为3.46%;试验组酒醅的残余淀粉为5.20%,消耗了5.49%的淀粉。试验组发酵后的酒醅淀粉含量显著(p<0.05)低于对照组。结果表明,采用麸曲和酒母共同发酵能够更好的利用丢糟中的淀粉,发酵丢糟酒的效果较好,提高了淀粉的利用率。可能是由于酵母的加入方式为液态,可以更好将酵母、麸曲和酒醅混合,促进了淀粉的利用[21]。

图4 丢糟发酵前后淀粉含量的比较Fig.4 Comparison of starch content before and after distiller's grains fermentation
2.5 酒醅出酒量的比较
根据2.3.3 发酵前后酒醅中淀粉含量的消耗,分别计算出5.00 kg 酒醅理论出酒量,得到试验组和对照组的理论出酒量分别为257.00 mL 和162.00 mL;试验组和对照组5.00 kg酒醅实际蒸馏得到60% vol酒的量分别为238.00 mL 和134.00 mL,试验组出酒量高出对照组104.00 mL,约为对照组的1.78 倍。结果见表1,可知试验组和对照组的淀粉出酒率分别为92.66%、82.75%。由此可见,相比于对照组,试验组不仅更多的利用了丢糟中的淀粉,而且还增加了淀粉出酒率。这是由于麸曲和酵母醪液均匀混合,作用于酒醅的各个部位,能够将更多的淀粉转化为葡萄糖,利于酵母菌的产酒;在发酵前进行了酵母的复苏增殖,避免了由于丢糟内部酸度大[4]等不利因素对酵母复苏增殖的影响,尤其是乳酸会抑制酿酒酵母的活性[12,27]。大量活化后的酵母在接触丢糟后可快速开始酒精发酵。试验组采用“麸曲接种0.40%+酵母接种量每千克丢槽1.00×1010个”的模式与对照组小曲的接种量0.80%相比,查询了市售麸皮、小曲和粮食的价格,通过计算得到试验组处理1 t丢糟用曲费用约为150元,出酒47.60 L;对照组处理1 t 丢糟用曲费用约为260 元,出酒26.80 L。表明“麸曲+酵母”的模式较用商品小曲的传统模式,更加节约成本,提高出酒量。
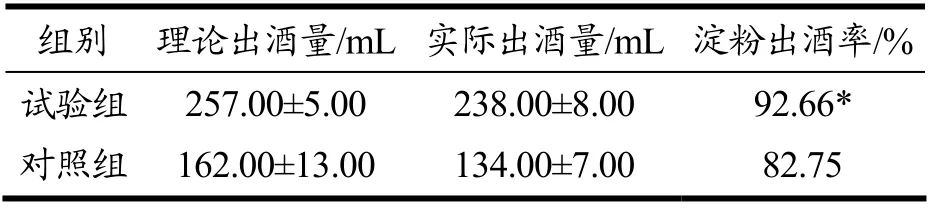
表1 试验组和对照组的出酒量对比Table 1 Comparison of alcohol output between the test group and the control group
2.6 丢糟酒风味分析
通过GC-MS 法分析试验组和对照组酒样的风味物质。试验组和对照组丢糟酒中的风味物质种类和含量,如表2所示。结果发现,试验组有32 种风味物质,对照组有29 种风味物质,两组试验的风味物质种类和含量相差不大。且试验组的己酸和己酸乙酯含量分别为265.25、443.69 mg/L;对照组的己酸和己酸乙酯含量分别为272.65、436.81 mg/L。说明“麸曲+酒母”新模式酿造的丢糟酒与商品小曲酿造的丢糟酒在风味物质方面几乎无差异,新模式酿造的丢糟酒与商品小曲酿造的丢糟酒的风格相近。

表2 试验组和对照组白酒中的风味成分种类及质量浓度(mg/L)Table 2 Types and contents of flavor components in liquor of experimental group and control group (mg/L)
以浓香型白酒丟糟为原料,试验组和对照组酿造的丟糟酒依然具备浓香型风味特点。可能是因为酒醅中残留的浓香型白酒的风味物质,例如非挥发性有机酸等,在发酵过程与乙醇发生酯化反应;酒醅中可能还存有梭状芽孢杆菌,丢糟酒发酵过程为其提供了生长繁殖条件,梭状芽孢杆菌代谢产生了相关风味物质,其原因还有待进一步研究。
3 结论
高糖化力JQ-1 麸曲的制备,糖化酶活力为1 507.91 U/g,满足丢糟酒的酿造需求。酵母在不同粮食糊化料液中进行复苏增殖,五粮糊化料液和高粱糊化料液的酵母生长最好,酵母数量在原基础上分别提高了近700 倍、450 倍。
分别探讨了酵母接种量和麸曲接种量对丢糟酒酿造的影响,分别得到酵母的最佳接种量为每千克丢槽1.00×1010个,麸曲的接种量为0.40wt%,在此条件下酿造丢糟酒,淀粉消耗、淀粉出酒率和出酒量均比较高。以商品小曲作为对照,试验组的淀粉消耗量和淀粉出酒率均高于对照组。采用“麸曲+酵母”新模式酿造丢糟酒,淀粉消耗能力和产酒能力均高于商品小曲。
通过比较试验组和对照组的风味物质,两组丢糟酒的风味物质种类和含量均相差不大,且具有浓香型白酒的特征。
本研究基于实验室建立的酿造模型,采用 “麸曲+酵母”新模式酿造丢糟酒,降低了丢糟用曲的使用量和丢糟酒的生产成本。为白酒行业处理丢糟或其他难利用淀粉提供了一种新方法和理论指导。
