象皮生肌膏对糖尿病足溃疡大鼠创面组织内上皮-间质转化过程的影响
2022-12-12孙之中刘朝红陈其华林雅思刘均瑜
孙之中,刘朝红,陈其华,易 倩,羊 羡,赵 姣,林雅思,何 欢,刘均瑜
(1.湖南中医药大学第一附属医院,湖南 长沙410007;2.湖南中医药大学,湖南 长沙410007)
糖尿病足溃疡(Diabetic foot ulcer,DFU)是由于足部神经病变以及缺氧缺血缺失感觉、缺失活力,且伴随着感染而引发的足溃疡,其为糖尿病常见的并发症之一[1]。糖尿病患者一旦发生DFU很难痊愈,甚至往更严重的方向发展,而且具有较高的截肢及死亡风险,对患者的生活质量造成严重不良影响,同时也加重了经济负担。DFU属中医学“脱疽”等范畴,患者气阴两虚、瘀血内阻,肢端坏疽,应益气养血、生肌敛疮、解毒通络[2]。《素问》记载:“发于足趾,名曰脱疽,其状赤黑,死不治;不赤黑,不死。不衰,急斩之,不则死矣”[3]。因此,以去除坏死组织为治疗DFU首要手段。然而,去除坏死组织后病足溃疡创面愈合仍然是现代医学一个棘手问题,生肌类中药的使用对DFU愈合起着关键作用。象皮生肌膏作为经典中医外用制剂,具有清热解毒、活血止痛、敛疮生肌的作用[4]。多项临床研究表明[5],象皮生肌膏可促进创面恢复,具有较好的糖尿病足溃疡治疗效果,但其作用机制尚未明确,仍需进一步探讨。上皮-间质转化(Epithelial-mesenchymal transition,EMT)是上皮细胞经过特定程序转化成带有间质表型细胞的过程,是创伤修复过程的重要分化过程,亦是器官纤维化、肿瘤以及伤口愈合发生的重要基础[6]。基于此,本研究通过对DFU大鼠进行象皮生肌膏治疗,并从EMT方向探讨象皮生肌膏促进DFU创面愈合的机制,以期为临床应用提供理论支持。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:于湖南斯莱克景达实验动物有限公司采购SPF级雄性SD大鼠40只,平均体重(272.45±5.48)g,动物许可证号:SCXK(湘)2009-0004,将大鼠安置于湖南中医药大学动物实验中心分笼饲养。饲养环境:SPF级;温度20~22 ℃,湿度50%~60%,予以标准饲料,两天更换一次垫料及消毒笼具。所有试验及操作均严格遵守国家卫生研究院中有关实验室动物伦理准则及使用指南,且已通过湖南省实验动物管理委员会审核同意。
1.1.2 主要实验药物、试剂与仪器:象皮生肌膏(批号20190818,湖南中医药大学第一附属医院药剂科自制,主要成分有象皮粉、龟甲、生地黄各120 g,当归100 g,生石膏150 g,炉甘石200 g,血余炭80 g);医用碘伏(批号150101,四川金山制药有限公司);0.9%氯化钠溶液(批号2A16010901,山东齐都药业有限公司);链脲佐菌素(批号Y161101,北京索莱宝科技用有限公司);柠檬酸-柠檬酸钠缓冲液(批号PH1716,天津百伦斯生物技术有限公司);水合氯醛(批号191S09R23,天津市科密欧化学试剂有限公司);青霉素(批号F6057301,华北制药股份有限公司);酶联免疫吸附测定试剂盒(批号CK5441Y,上海恒远生物科技有限公司);一次性使用无菌注射器(武汉帝王冠医疗器械有限责任公司);实时荧光定量PCR仪(型号TL988-Ⅰ型,天隆科技公司);台式冷冻离心机(型号AllegraX-15R,美国贝克曼库尔特有限公司);双目显微镜(型号DM LB2型,德国LEICA公司);微型蛋白电泳转印系统(型号PowerPac Basic,美国Bia-Rad公司)等。
1.2 实验方法
1.2.1 建立糖尿病大鼠模型:40只SD大鼠适应性饲养5 d,予以普通饲料喂养,5 d后从中随机选择10只大鼠作为空白组,继续予以普通饲料喂养。将余下30只作为糖尿病组,予以高脂高糖饲料继续喂养1个月,引导大鼠发生胰岛素抵抗。建模前大鼠需禁食14 h,在糖尿病组腹腔注射1% 链脲佐菌素,空白组大鼠予以等量柠檬酸钠缓冲液腹腔注射。注射结束后4 h恢复正常喂养,72 h定时监测血糖,如连续3次血糖均值>16.7 mmo1/L即为糖尿病模型建立成功。
1.2.2 建立糖尿病足溃疡大鼠模型:建立大鼠缺损性皮肤溃疡模型,建模成功后观察7 d,所有大鼠建立糖尿病足溃疡模型。术前所有大鼠予以注射青霉素8 IU以防止感染,随后注射适量水合氯醛进行麻醉,麻醉后每只大鼠进行背部脱毛,最后在脱毛处涂抹碘伏或者酒精消毒。沿着大鼠脊柱正中肩胛骨下缘2 cm处切下2 cm×2 cm的全层皮肤,使溃疡直至筋膜,接着0.9%氯化钠溶液冲洗创面并包扎,术后及时复温。
1.2.3 分组及给药:将30只糖尿病足溃疡模型大鼠随机分成三组,即模型组、对照组(碘伏)、实验组(象皮生肌膏)。四组均使用0.9%氯化钠溶液清理伤口,对照组、实验组加用对应药物外敷在创面上,空白组、模型组则用无菌0.9%氯化钠溶液外敷。每组每隔24 h进行创面换药处理,连续用药14 d。
1.2.4 创面愈合率:分别在干预后的第7、14天观察并记录各组大鼠创面情况,以标尺定位创面并拍照,固定相机焦距和相机与创面间的距离,并用图像分析IPP软件分析未愈合面积,计算创面愈合率。创面愈合率(%)=[(原始创面面积-未愈合创面面积)/原始创面面积]×100%[7]。
1.2.5 检测各组创面TGF-β1、IGF-1、FN、E-cadherin、Fibronectin蛋白及mRNA的表达:在干预后的第7、14天采用实时荧光定量聚合酶链式反应法(RT-qPCR)检测TGF-β1、IGF-1、FN、E-cadherin、Fibronectin mRNA表达情况。
1.2.6 采用Western blotting法检测TGF-β1、IGF-1、FN、E-cadherin、Fibronectin蛋白表达情况:取各组大鼠相同位置的创面组织,洗净后剪碎,使用BCA蛋白浓度测定试剂盒提取并测定蛋白浓度,采用Western blotting法检测每组大鼠的TGF-β1、IGF-1、FN、E-cadherin、Fibronectin蛋白表达情况,一抗按照1∶1000稀释,二抗按照1∶5000稀释。GAPDH作为内参照蛋白,计算出每组样本中TGF-β1、IGF-1、FN、E-cadherin、Fibronectin蛋白的相对表达量。目的蛋白相对表达量=目的蛋白灰度值/GAPDH灰度值。重复3次,取平均值。
1.2.7 血管内皮生长因子(Vascular endothelial growth factor,VEGF)含量:切取的干预后第7、14天大鼠的创面组织,将标本充分研碎制备成匀浆,以2000 r/min离心10 min,取上清液,采用酶联免疫反应法测定组织中VEGF含量,检测操作均严格按照说明书进行。
1.3 统计学方法 数据分析处理应用SPSS 22.0统计学软件进行。计量资料用均数±标准差表示,多组间比较行单因素方差分析,两两进一步比较行SNK-q检验;P<0.05表示差异有统计学意义。
2 结 果
2.1 各组干预第7、14天大鼠创面愈合率比较 空白组大鼠干预7 d后,创面愈合率高于对照组、模型组、实验组,差异有统计学意义(P<0.05)。干预14 d后,空白组创面愈合率高于对照组、模型组,但低于实验组。实验组大鼠干预7 d后,创面愈合率高于对照组、模型组,低于空白组,差异有统计学意义(P<0.05)。干预14 d后,实验组创面愈合率明显升高,高于对照组、空白组、模型组,差异有统计学意义(P<0.05)。对照组大鼠干预7 d后,创面愈合率高于模型照组,低于空白组及实验组,差异有统计学意义(P<0.05)。干预14 d后,对照组创面愈合率高于模型照组,低于空白组及实验组。模型组干预第7、14天后创面愈合率均低于对照组、空白组、实验组,差异有统计学意义(P<0.05)。见表1。

表1 各组干预第7、14天大鼠创面愈合率比较(%)
2.2 各组干预第7、14天创面E-cadherin和Fibronectin蛋白表达比较 干预第7天,与模型组对比,空白组和实验组E-cadherin蛋白表达均降低,Fibronectin表达均显著升高;与对照组相比,实验组E-cadherin蛋白表达显著降低,Fibronectin蛋白表达显著升高(图1)。干预第14天,与模型组对比,空白组和实验组E-cadherin蛋白表达显著降低,Fibronectin蛋白表达显著升高(图2)。

图1 干预第7天后,创面E-cadherin和Fibronectin蛋白表达电泳图
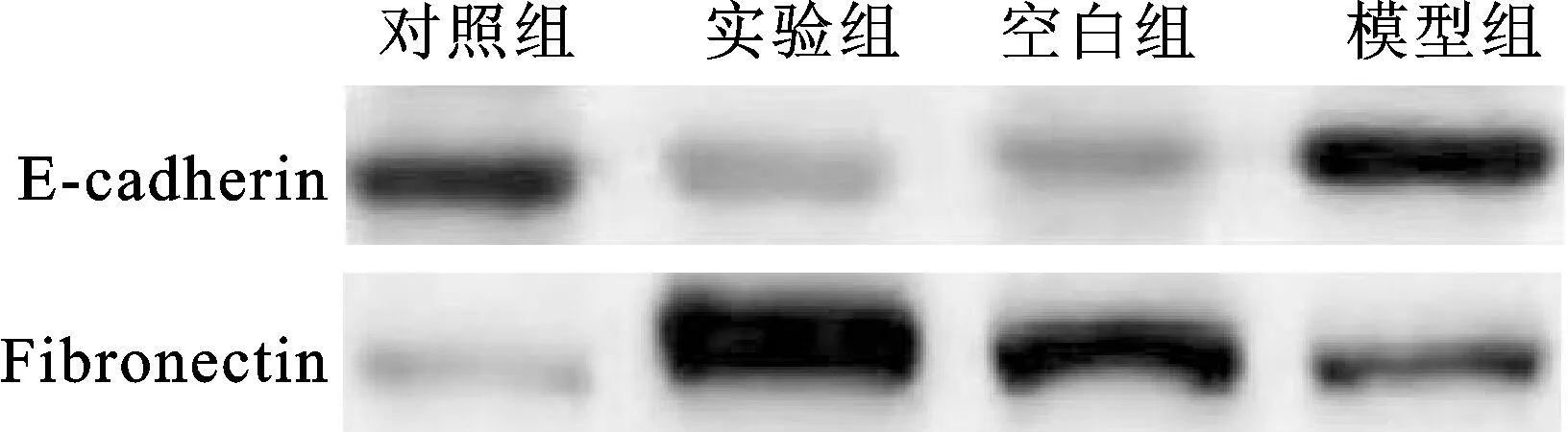
图2 干预第14天后,创面E-cadherin和Fibronectin蛋白表达电泳图
2.3 各组创面TGF-β1、IGF-1、FN mRNA表达情况比较 干预第7天,与模型组对比,空白组和实验组TGF-β1、IGF-1、FN mRNA表达均升高(P<0.05),见表2。干预第14天,与模型组对比,其他三组FN mRNA表达均升高,空白组和实验组TGF-β1的mRNA表达均升高,差异有统计学意义(P<0.05);除空白组外,其他三组的IGF-1的mRNA表达比较,差异无统计学意义(P>0.05),见表3。

表2 干预第7天创面TGF-β1、IGF-1、FN mRNA表达情况比较

表3 干预第14天创面TGF-β1、IGF-1、FN mRNA表达情况比较
2.4 各组大鼠皮肤溃疡组织VEGF表达比较 空白组大鼠干预7、14 d后,VEGF表达均高于对照组、模型组、实验组,差异有统计学意义(P<0.05)。实验组大鼠干预7、14 d后,VEGF表达均高于对照组、模型组,差异有统计学意义(P<0.05)。对照组大鼠干预7、14 d后,VEGF表达均高于模型组,差异有统计学意义(P<0.05)。见表4。

表4 各组大鼠皮肤溃疡组织VEGF表达比较(μg/g)
3 讨 论
在中医范畴中,糖尿病为“消渴”,体现为上中下三焦阴虚、阴损等促使脏腑阴阳失调,气血两虚,使得水液运化异常,化湿成痰;血液无气推动导致运输较慢,逐步促进瘀血的形成[8]。另患者阴虚燥热,长久体虚,如干热旺盛,则积毒成脓,然而正气虚弱无力抵抗邪气,最终导致痈疽疖疮,即为“脱疽”,为临床的DFU,其病性属本虚标实,应尽早对创面进行治疗。象皮生肌膏具有清热解毒、活血止痛、敛疮生肌的功效。临床研究表明象皮生肌膏可通过促进血管形成,改善血运情况,促进肉芽组织生成和上皮化,进一步促使溃疡创面愈合,但其加快创面愈合的相关调控机制仍需深入探究[9]。
本研究结果显示,干预第7、14天,实验组的创面愈合率均最高,提示象皮生肌膏具有较好的创面愈合治疗效果,与既往研究相似[10]。象皮生肌膏为中药制剂,由象皮粉、当归、生地黄、血余炭、炉甘石、生石膏、龟甲组成。其象皮粉有敛疮止血、清热解毒之效,为君药;炉甘石有解毒收湿、止痒敛疮之效,生石膏有清热解毒、泻火功效,两者为臣药;当归补血活血、消肿除脓、止痛生肌,生地黄清热凉血、生津滋阴,血余炭消瘀止血,龟甲滋阴潜阳、壮骨养血,四者均为佐药[11]。诸药结合既有根除外在病灶功效,又兼顾充实其本,调节体内气血阴阳,达到祛腐敛疮生肌的效果,促进伤口愈合[12]。本研究中,模型组中的E-cadherin表达上升,Fibronectin表达下降,提示EMT过程受到限制,影响到创面愈合,而象皮生肌膏能使组织内Fibronectin表达升高,E-cadherin降低,进一步推动EMT过程而促进愈合。创面愈合是涉及炎症反应、血管生成、再上皮化、细胞增殖及迁移等多个阶段的复杂过程,而EMT是指上皮细胞经过特定程序转变为具有间质表型细胞的生物学过程,且已被证实包括胚胎发育、创面愈合、组织器官纤维化等多个病理过程,是可通过治疗手段进行干预的过程[13]。
本研究结果显示,模型组中创面TGF-β1、IGF-1、FN mRNA表达降低,而创面愈合速度减慢;实验组使用象皮生肌膏治疗后TGF-β1、IGF-1、FN mRNA表达升高,且比对照组更早的发挥EMT调控作用,加快创面愈合。TGF-β1是一类拥有较多功能的细胞因子,且被认为是最强的致纤维化因子,可调控细胞周期,促进细胞的增殖与分化,促进新生肉芽组织形成,从而达到加快组织修复的目的[14]。TGF-β1通过依赖Smad激活细胞表面受体,结合形成Smad复合物,复合物则通过进入细胞核调控EMT重要的转录因子,对创面愈合有着核心且关键的作用[15]。IGF-1是与胰岛素同源的生长因子,其参与调控组织细胞的增殖、分化、凋亡,在创面愈合的过程起到重要的生理作用[16]。李博文等[17]研究指出,合适浓度的IGF-1可促进成纤维细胞增殖和分化。但IGF-1的合成及释放受到糖尿病患者高血糖影响,因此模型组中IGF-1的mRNA表达减少。本研究中发现IGF-1在第7天时空白组mRNA表达较低,实验组显著升高而到第14天时迅速下降,且除空白组外其余三组均无明显差异。考虑到因空白组无胰岛素抵抗而使其处于较为平稳的水平,而显著升高后迅速下降也可能与负反馈机制有关,同时也提示了象皮生肌膏不能促进IGF-1的表达,其可能是通过调控IGF受体的数量和结构来加快创面愈合。FN的创面修复机制是通过促进吞噬细胞功能及促进细胞与纤维基质间联系而实现[18-20]。Tang等[21]研究表明,EMT过程中会分泌较多的细胞外基质(ECM),而FN作为ECM重要成分沉积于肾脏,从而导致了纤维化过程,因此糖尿病中E-cadherin降低以及FN表达增多均与EMT有关。此外,本研究发现实验组大鼠在干预第7、14天VEGF含量显著高于对照组、模型组,可见象皮生肌膏可促进内皮细胞分泌VEGF,进一步加速血管生长。VEGF是调控血管的主要生长因子,能引发一系列修复反应,可有效促进新血管生成。DFU创面VEGF水平不仅异常低表达,而且缩短表达高峰持续时间,是导致创面难愈合的主要原因之一[22-24]。治疗组VEGF含量高于对照组、模型组,可能是与象皮生肌膏改善了内皮祖细胞和内皮细胞的生物学功能有关。
综上所述,象皮生肌膏可促进DFU大鼠模型创面组织的EMT过程,促进愈合,其机制可能是通过调控TGF-β1、IGF-1、FN 等基因实现。此外,TGF-β1、IGF-1、FN 途径诱导的EMT过程有可能成为DFU新的治疗靶点,但仍需进一步探究其靶向调控关系。
