基于内源酶活性变化的冷藏哈氏仿对虾肌肉品质研究
2022-12-10水珊珊李志鹏吴盈茹丁怡萱
周 婷,水珊珊,2, ,李志鹏,吴盈茹,丁怡萱,张 宾,
(1.浙江海洋大学,食品与药学学院,浙江舟山 316022;2.浙江省海洋开发研究院,浙江舟山 316021)
哈氏仿对虾(Parapenaeopsis hardwickii)属十足目,对虾科,仿对虾属,俗称九虾、珠虾、剑虾、滑皮虾、青皮等,为广温广盐暖水性中型虾类,主要分布于印度、马来西亚、加里曼丹、新加坡、日本以及我国黄海南部、东海及南海附近海域[1]。哈氏仿对虾肌肉鲜嫩,可以生食,也可制成海产品,深受消费者的喜爱,是江浙沿海一带渔民用来生产的主要虾类品种[2]。哈氏仿对虾在捕捞后离开其适应的水环境很容易死亡,而死亡后的虾极易发生物理损伤、蛋白质降解及微生物侵袭作用等,导致其肌肉品质下降迅速。冰鲜虾类在贮藏过程中也易发生腐败,主要原因是虾死后组织器官中内源酶的降解作用,导致虾体肌肉分解不断加速[3]。
虾体肌肉软化由多种原因造成,主要是由自身存在的内源酶而引起,如胰蛋白酶、组织蛋白酶和钙蛋白酶等。其中,胰蛋白酶作为一种重要的消化性蛋白酶,主要存在于虾头胰腺组织中。陈诗妍[4]研究发现,在凡纳滨对虾贮藏过程中,虾头中胰蛋白酶可能会逐步迁移到虾肌肉中,进而对肌肉品质产生较大影响。此外,各种组织蛋白酶对虾肌肉品质的影响逐渐被人们所关注,尤其在虾类离水死后贮藏初期,组织蛋白酶可导致肌肉细胞骨架蛋白的破坏,因此被认为是诱导肌肉蛋白质降解的重要影响因素之一[5]。卢涵[6]研究发现,低温条件下鳙鱼肉在代谢过程中,肌肉中组织蛋白酶主要分布于肌原纤维蛋白周围,其与肌浆蛋白的降解以及肌肉质构、肌纤维微观结构的变化均有关联。此外,有研究表明,钙蛋白酶首先攻击肌原纤维的肌节部分,释放肌原纤维,可降解原肌球蛋白、肌钙蛋白 T、丝蛋白、结合蛋白及肌钙蛋白,同时还可以降解肌肉纤维骨骼蛋白,如肌动蛋白。据推测,钙蛋白酶首先攻击肌原纤维的肌节部分,释放肌原纤维,将它们分解成更小的碎片,最后将碎片化的肌原纤维捕获在溶酶体中分解[7-8]。孙蕾蕾等[9]研究发现宰后鱼肉能量的代谢和质构变化与肌肉中的肌钙蛋白酶有关。目前,国内外对水产品内源酶的研究报道主要集中于鱼类内源酶,而关于虾类尤其是海水哈氏仿对虾,尚缺少系统性研究。
本文以哈氏仿对虾为对象,分为完整虾组和去头虾组,通过比较分析冷藏过程中虾肌肉组织理化特性及各内源酶活性变化情况,阐述多种内源酶与虾肌肉品质特性之间的相互关系,旨在为后续通过抑制内源酶活性,进而保障海水虾类品质的提供理论基础。
1 材料与方法
1.1 材料与仪器
新鲜的哈氏仿对虾(体长约8 cm) 购于舟山市沈家门水产码头,放入准备好的泡沫箱内并封存,半小时内运回实验室;组织蛋白酶ELISA检测试剂盒
上海继锦化学科技有限公司;蛋白定量测试盒、胰蛋白酶测试盒 南京建成生物工程研究所;三氯乙酸(TCA)、三(羟甲基)氨基甲烷(Tris)、磷酸氢二钾、磷酸二氢钾、乙二醇双四乙酸(EGTA)、氯化镁等国药集团化学试剂有限公司。
751UVGD型紫外-可见分光光度计 上海第三分析仪器厂;Synergy H1全功能酶标仪 美国伯腾仪器有限公司;DiRECT-Q超纯水装置 美国MILLIPORE公司;MDF-U53V型超低温冰箱 日本SANYO公司。
1.2 实验方法
1.2.1 前处理与分组 选取个头相似的新鲜哈氏仿对虾,分为完整虾组和去头虾组。将整虾和去头虾分装后,用标签记录并置于0 ℃冰箱中低温保存。分别在0、2、4和6 d,取出相对应时间的样本,对其进行后续指标的测定。
1.2.2 指标测定
1.2.2.1 质构特性测定 参照祁雪儿等[10]报道,并稍作修改。采用TPA模型进行检测,测定参数如下:P/50平底圆柱体探头,测试速度为1.0 mm/s,测定哈氏仿对虾肌肉第2腹节,样品压缩变形量为30%,测试力0.6 N。采用FTC-PRO软件从每个虾肉样品产生的力与时间曲线中,计算出虾肉的硬度、粘附性、内聚性、弹性、胶黏性和咀嚼性。
1.2.2.2 TCA-可溶性肽含量的测定 参考刘芳芳等[11]报道方法并稍作修改。称取2.0 g切碎后样本,加入18 mL预冷至4 ℃的5% TCA溶液中,11000 r/min均质2 min,4 ℃静置1 h后,置于离心机中8000 r/min离心15 min(4 ℃)。利用双缩脲法测定上清液中TCA-可溶性肽含量,结果用μmol/g表示。
1.2.2.3 肌原纤维蛋白含量及小片化指数测定 肌原纤维蛋白含量测定:参考柳佳彤等[12]报道的方法并稍加调整。称取2.0 g虾肉,加入9倍体积的20 mmol/L Tris-马来酸缓冲液(含50 mmol/L KCl,pH7.0)后进行均质,10000 r/min离心15 min(4 ℃),弃去上清液,获得沉淀采用相同缓冲液洗涤2次;收集沉淀,加入9倍体积的20 mmol/L Tris-马来酸缓冲液(含0.6 mol/L KCl,pH7.0)后进行均质,4 ℃下静置提取1 h,10000 r/min离心15 min(4 ℃),取上清液采用双缩脲法测定其吸光度。
肌原纤维小片化指数(MFI):参考张斌斌等[13]的方法并做适当修改。准确称取2.0 g样本,切碎后加入40 mL预冷的MFI提取缓冲液(含100 mmol/L KCl、11.2 mmol/L K2HPO4、8.8 mmol/L KH2PO4、1 mmol/L EGTA和1 mmol/L MgCl2),高速均质后,4000 ×g离心15 min(4 ℃),离心后弃去上清液。向沉淀中加入30 mL预冷的MFI提取缓冲液,溶解混匀,4000×g离心15 min(4 ℃),离心后弃去上清液,重复一次上述步骤。所得沉淀用上述MFI缓冲液制成蛋白浓度为(0.50±0.05) mg/mL的悬浊液,用双缩脲法测定其540 nm处的吸光度值A540,计算肌原纤维小片化指数MFI=A540×200。
1.2.2.4 胰蛋白酶活性测定 参考陈诗妍等[4]实验方法并稍作修改。分别取冷藏哈氏仿对虾虾头的胰腺部分、整虾与去头虾腹部第2节肌肉样品各2.0 g,按样本:缓冲液=1:4(m:v)的比例加入4 ℃预冷的磷酸盐缓冲液,冰浴条件下进行机械匀浆,3000 r/min离心10 min(4 ℃),取上清液,即为粗酶液,并根据试剂盒说明书并稍加修改进行胰蛋白酶活性测定。
1.2.2.5 组织蛋白酶B、D、H、L及钙蛋白酶活性测定 取2.0 g样本,按照样本:缓冲液=1:4(m:v)的比例加入0.9% NaCl,均质2~3次,每次20 s,间隔10 s,3000 r/min离心20 min(4 ℃),取上清液进行测定,操作过程依据试剂盒说明书进行。
1.2.2.6 亚细胞各部分中组织蛋白酶B、D、H及L活性测定 参考Ertbjerg等[14]的方法并稍加调整。取2.0 g样本与10 mL缓冲液A(含100 mmol/L蔗糖、100 mmol/L KCl、50 mmol/L Tris、10 mmol/L Na4P2O7·10 H2O、1 mmol/L Na2EDTA,pH7.2)混合均质后,用尼龙网过滤去除结缔组织,将混合物在1100×g下离心10 min(4 ℃),所得沉淀部分为肌原纤维。上清液部分继续在3000×g下离心10 min,所得沉淀为线粒体部分。上清液继续在16000×g下离心30 min,所得沉淀为溶酶体部分,上清液部分为肌浆。将线粒体及溶酶体部分置于贮藏缓冲液B(含85 mmol/L CH3COONa、15 mmol/L CH3COOH和1 mmol/L EDTA-2Na)后,立即检测各组织蛋白酶的活性,具体操作依据试剂盒说明书进行。
1.3 数据处理
实验数据采用Origin 2018、Excel 2010和SPSS 25进行统计分析,结果均采用平均值±标准差形式表述。比较平均值采用单因素ANOVA检验中的最小显著差异法(LSD)和沃勒-邓肯(W),P<0.05视为显著差异。
2 结果与分析
2.1 冷藏过程中哈氏仿对虾肌肉质构特性变化
质构特性是水产品贮藏过程中评价产品质量和可接受程度的重要指标。由表1可知,通过对整虾肉和去头虾肉的对比发现,0 ℃条件下的两组样品,在冷藏过程中各项质构指标均有明显差异。质构的各项指标均能较好地体现肌肉组织的状况,其中硬度和弹性与虾肌肉品质相关性较为紧密,这与王伟等[15]的研究结果相类似。随着贮藏时间的延长,虾肉蛋白质被逐渐分解,导致虾肉软化,冷藏6 d后,完整虾肉与去头虾肉的硬度分别降至为5.707、6.513 N;而弹性则分别从1.000、1.083 mm下降至0.750、0.793 mm。结果表明,在低温存放过程中,随着虾新鲜度逐渐降低,整虾肉和去头虾肉的各个质构特性会出现不同程度的波动,且去头虾组往往指标表现更好些,可能是因为整虾组中存在较多的内源酶,更易引起蛋白质和结缔组织的自溶降解[16]。
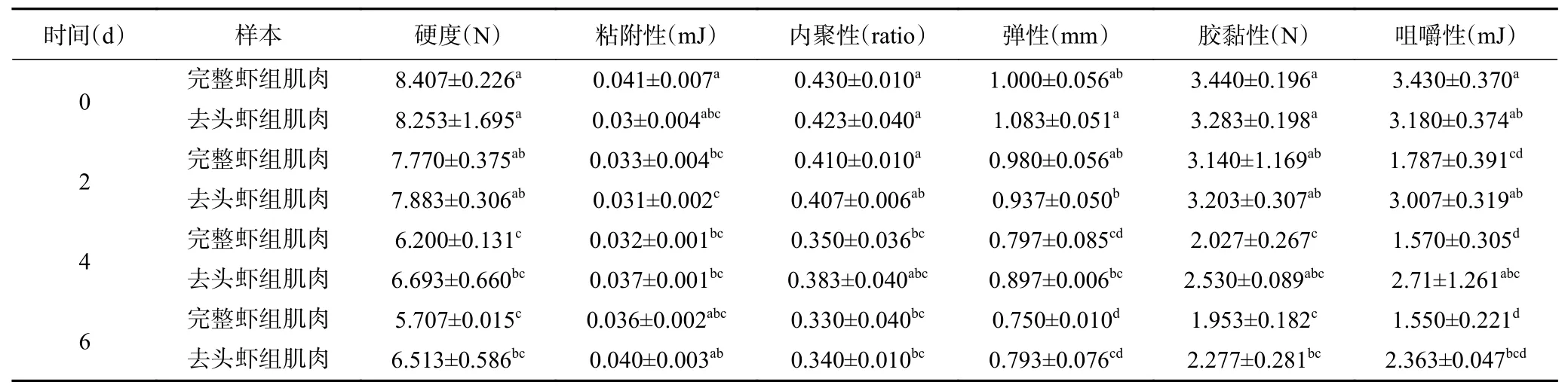
表1 不同冷藏天数对哈氏仿对虾质构的影响Table 1 Effects of different cold storage days on the texture of Parapenaeopsis hardwickii
2.2 冷藏过程中哈氏仿对虾TCA-可溶性肽含量变化
蛋白质分解产生大量肽,TCA-可溶性肽的变化趋势可以一定程度上反映出蛋白质的分解情况,其值越高,蛋白质分解的程度就越严重[17]。虾头中存在较多的内脏及活性物质,在冷藏过程中可能会发生较大的作用,并对虾肌肉中TCA-可溶性肽含量产生一定影响。如图1所示,完整虾组肌肉与去头虾组肌肉中TCA-可溶性肽含量随着冷藏时间延长而上升,在6 d后显著上升(P <0.05),表明虾体内的蛋白降解在持续进行。完整虾组虾头中TCA-可溶性肽含量先下降后上升,可能是在冷藏前期,虾头中的内源酶参与了虾肉蛋白质降解,影响虾头中的蛋白质降解速度,到了冷藏后期,整虾组虾头中的TCA-可溶性肽含量的上升趋势远大于整虾组肌肉,可能是虾头中的蛋白质降解机制被激活,促进了蛋白质加速降解,造成TCA-可溶性肽急剧上升。TCA-可溶性肽含量前期增加的原因可能是内源性蛋白酶导致,后期在内源酶及微生物共同作用下发生蛋白质降解,这与张楠楠[18]发现鱼肉在贮藏过程中被内源酶和微生物外源酶分解的研究结果一致,与张喜才[19]报道的石斑鱼冷藏过程中的TCA-可溶性肽含量变化的结论一致。
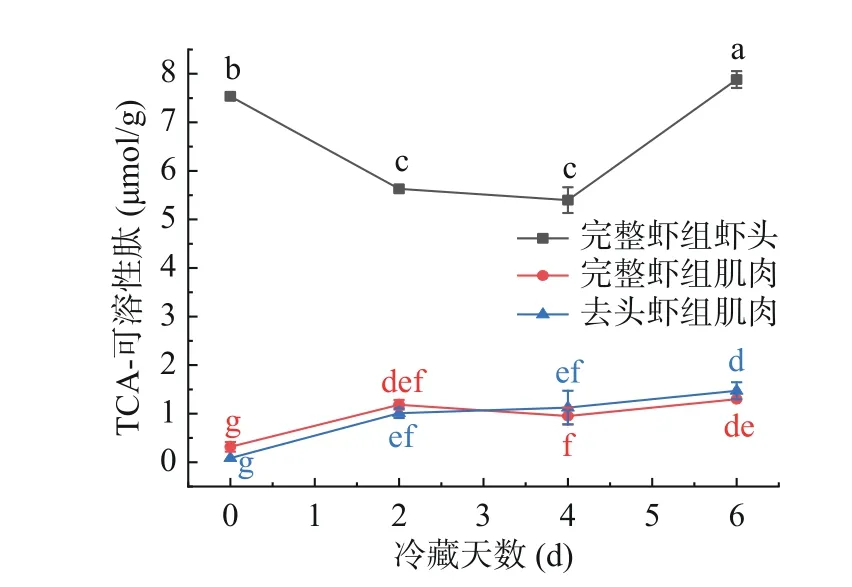
图1 哈氏仿对虾体内TCA-可溶性肽含量变化Fig.1 Changes of TCA-soluble peptide content in Parapenaeopsis hardwickii
2.3 冷藏过程中哈氏仿对虾肌原纤维蛋白含量及小片化指数变化
肌原纤维蛋白是虾肉中含量最高的蛋白质,是虾肌肉蛋白质的重要组成部分,其含量的高低可能表明虾肌肉质量存在一些差异[20]。如图2(a)所示,随着冷藏时间的延长,哈氏仿对虾肌肉中的肌原纤维蛋白含量持续下降。新鲜的虾肉中肌原纤维蛋白含量为89.22 mg/g;在冷藏6 d时完整虾组肌肉与去头虾组肌肉中的肌原纤维蛋白含量分别下降了56.65%和44.63%,且在6 d后,完整虾组的肌原纤维蛋白含量显著低于去头虾组(P<0.05),可能是在贮藏过程中,整虾中存在较多的微生物及其他活性物质促进虾肉中的肌原纤维蛋白降解,造成组间肌原纤维蛋白降解差异[4]。
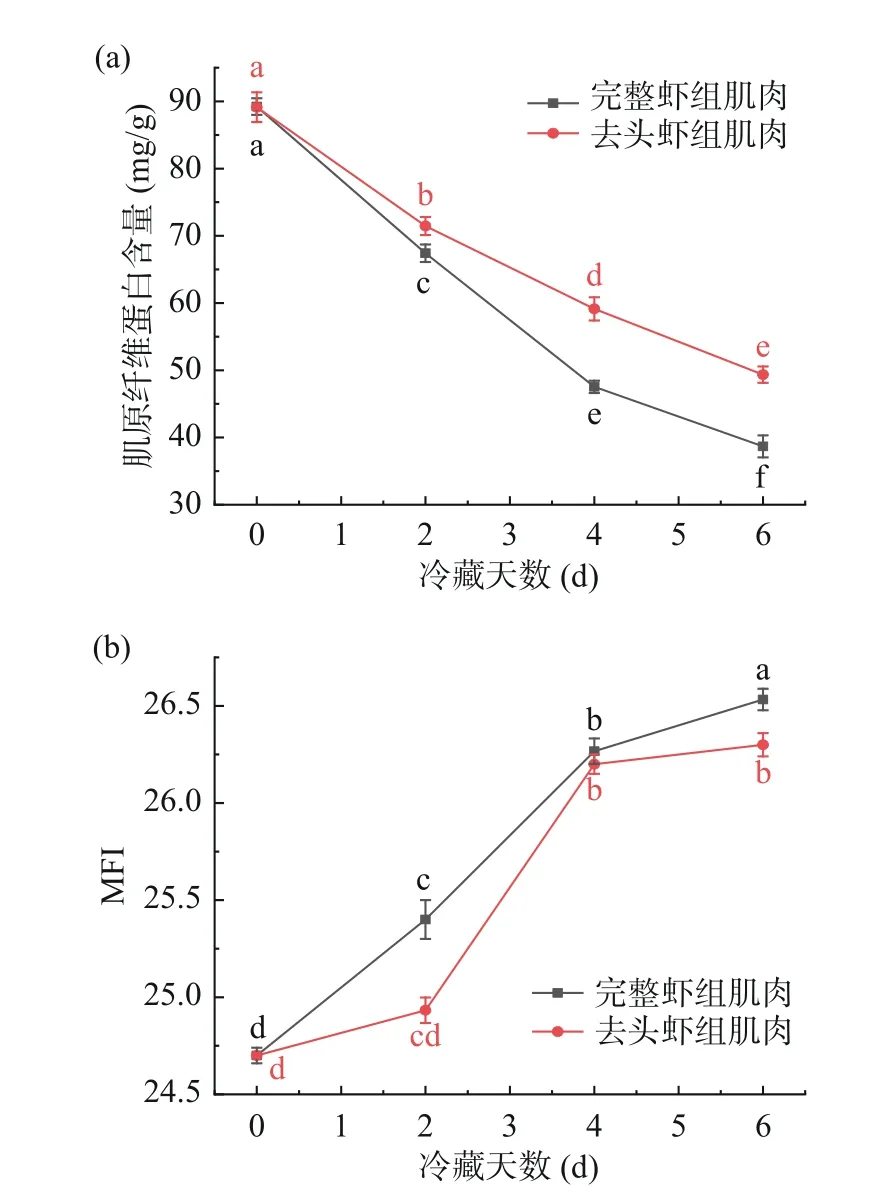
图2 哈氏仿对虾体内肌原纤维蛋白(a)及其小片化指数(b)变化情况Fig.2 Changes of myofibrillar protein (a) and its fragmentation index (b) in Parapenaeopsis hardwickii
虾在冷藏过程中肌联蛋白和伴肌动蛋白逐渐降解,这两类蛋白质均位于肌原纤维蛋白肌节 Ⅰ 带,而MFI值反映了肌节Ⅰ带附近关键细胞骨架蛋白的降解程度,MFI值越大,说明肌原纤维内部结构完整性的破坏程度就越大[20-21]。由图2(b)可知,整虾肉及去头虾肉在冷藏初期均为24.7,随着冷藏时间的延长,两组的MFI值均呈上升趋势,且在6 d的冷藏周期内,两组样品之间均存在显著性差异(P<0.05),可能是因为随着冷藏时间的增加,蛋白质逐渐氧化,同时虾头中的某些活性成分缓慢迁移到虾肉中,从而加剧了虾肉蛋白的结构破坏和降解,这与柳佳彤等[12]冻藏过程中罗氏沼虾虾头中内源酶迁移至虾肉中,进而破坏虾肉蛋白的研究结果一致。Kaale等[22]研究发现,大西洋鲑鱼在微冻保藏过程中,鱼肉肌原纤维发生碎片化。Fang等[23]在草鱼鱼片的超冷储存过程中发现,剪切力与MFI的数据呈比较清晰的负相关,可以反映肌原纤维结构蛋白的降解程度。
2.4 冷藏过程中哈氏仿对虾胰蛋白酶活性变化
哈氏仿对虾消化系统内含有各种消化酶,具有很强的自溶能力[24],其中胰蛋白酶是虾头中主要的消化酶,在虾头中可能存在较高的活性会对虾肌肉中的胰蛋白酶活性值产生一定影响。由图3可见,哈氏仿对虾头部的胰蛋白酶活性最高,新鲜虾头的胰蛋白酶活性高达68.83 U/mg,整虾肉和去头虾肉中胰蛋白酶活性分别为15.89和15.41 U/mg,虾头中的胰蛋白酶活性超过虾肉的4倍。随着冷藏时间的增加,虾头中胰蛋白酶活性呈现出较显著的下降趋势(P<0.05),到达6 d,虾头胰蛋白酶活性降至50.23 U/mg,下降了27.03%,但仍高于虾肉;整虾肉中的胰蛋白酶活性在6 d后上升至31.83 U/mg,这种现象被认为是由于虾头中所含的一些胰蛋白酶在储存过程中逐渐移动到虾肉中所致,这一观点与陈诗妍[4]发现虾头胰蛋白酶在贮藏期间能向肌肉扩散和迁移,并参与肌原纤维蛋白的降解,导致组织软化的研究结果一致。去头虾肉中的胰蛋白酶活性在冷藏期间处于下降趋势,在6 d后降至13.07 U/mg,下降幅度较小,可能是贮藏期间蛋白质发生降解而引起的胰蛋白酶减少,这与TCA-可溶性肽的变化趋势一致,同时也印证了肌原纤维蛋白含量的下降。
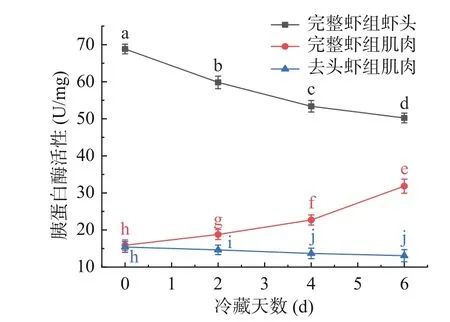
图3 哈氏仿对虾体内胰蛋白酶活性变化情况Fig.3 Changes of trypsin activity in Parapenaeopsis hardwickii
2.5 冷藏过程中哈氏仿对虾钙蛋白酶活性变化
虾肌肉细胞含有许多蛋白酶系统,钙蛋白酶被认为是诱导死后虾蛋白水解的主要途径之一[25]。图4展示了0℃冷藏条件下,完整虾肉及去头虾肉中钙蛋白酶活性的变化。随着冷藏时间的增加,两组虾肉中的钙蛋白酶活性呈现出下降趋势,分别从6.06、5.84 U/L下降至3.70、3.87 U/L,下降率分别为38.9%、33.7%,且存在显著性差异(P<0.05)。完整虾肉中钙蛋白酶活性变化程度大于去头虾组,可能是由于虾头中的内源酶迁移而导致虾肉中更多的钙蛋白酶被激活而发生自溶。师希雄等[26]报道钙蛋白酶活性的降低是由于其在被钙离子激活的同时发生了自溶,最终导致活力的损失,也是其水解肌原纤维蛋白的结果。虾死后随着ATP的消耗和pH下降,细胞膜的完整性被破坏,释放肌质网肌小泡内积蓄的钙离子,钙激活蛋白酶被活化发生自溶[25]。
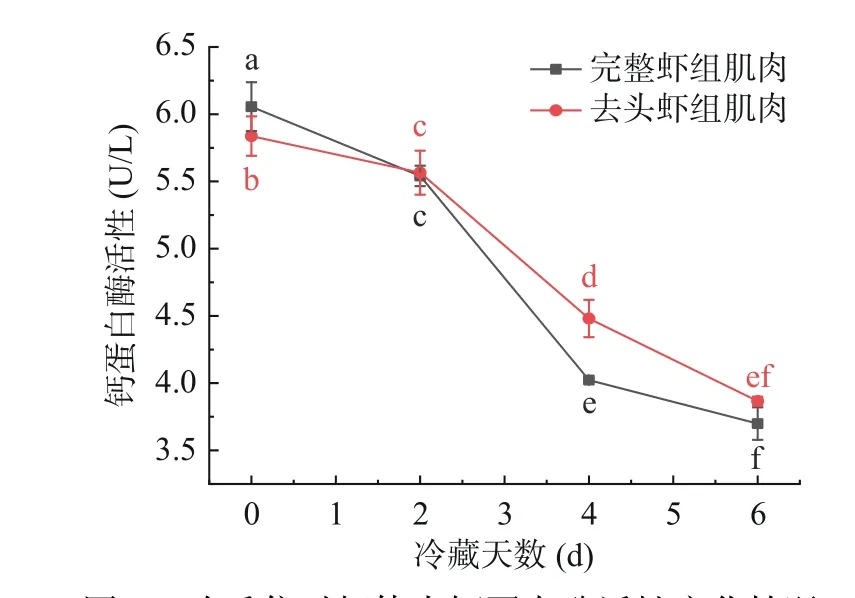
图4 哈氏仿对虾体内钙蛋白酶活性变化情况Fig.4 Changes of calpain activity in Parapenaeopsis hardwickii
2.6 冷藏过程中哈氏仿对虾组织蛋白酶B、D、H和L活性变化
组织蛋白酶B、D、H及L是引起虾死后肌肉降解的主要酶类[27]。从图5可看出,组织蛋白酶B、D、H、L的活性均随冷藏时间的延长而下降。从图5(a)可得,在0~4 d冷藏期间整虾肉的组织蛋白酶B高于去头虾肉,但在6 d后整虾肉中组织蛋白酶B的活性低于去头虾肉。可能是因为冷藏前期整虾肉组织蛋白酶B在内源酶的共同作用下,产生较为激烈的分解作用,使得组织蛋白酶B的活性高于去头虾肉。在6 d后,在蛋白分解的过程中,组织蛋白酶作为一种蛋白质,也逐渐被分解,其活性则逐渐降低。如图5(b)所示,组织蛋白酶D在虾肉中存在比较明显的变化,整虾肉与去头虾肉分别下降了32.05%、30.07%;在整个冷藏过程中,图5(c)整虾肉中组织蛋白酶H的活性始终高于去头虾肉,整虾肉下降了43.23%,而去头虾肉下降了76.87%;图5(d)表明组织蛋白酶L在整虾肉及去头虾肉中的活性分别从9.94 U/L下降到4.16 U/L,从9.63 U/L下降到4.57 U/L。根据Bechet等[28]的报道,可能是在冷藏前期,随着虾肉pH值的下降,虾肉中的酶原被激活,与运输至溶酶体的组织蛋白酶反应,从而使组织蛋白酶的活性升高,与Aoki等[29]和李来好等[30]报道的组织蛋白酶可能直接参与哈氏仿对虾死后冷藏期间肌肉软化的研究结果一致。
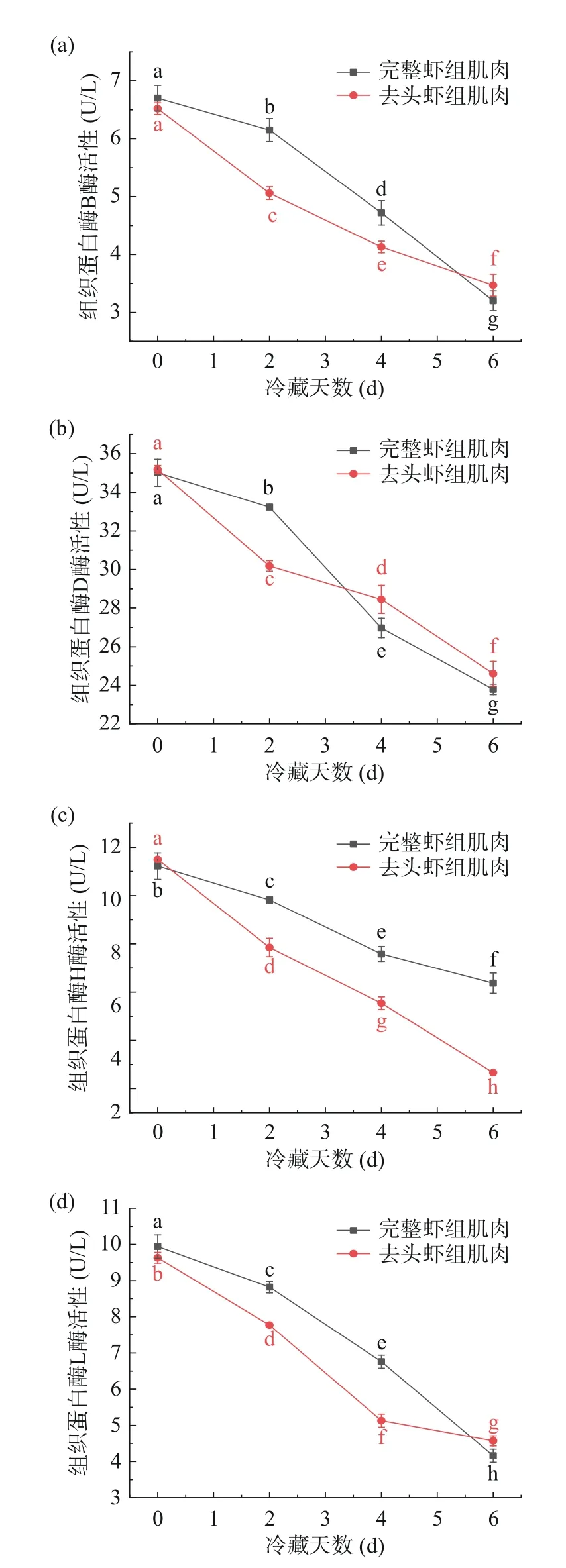
图5 哈氏仿对虾体内组织蛋白酶的活性变化情况Fig.5 Changes of cathepsin activities in Parapenaeopsis hardwickii
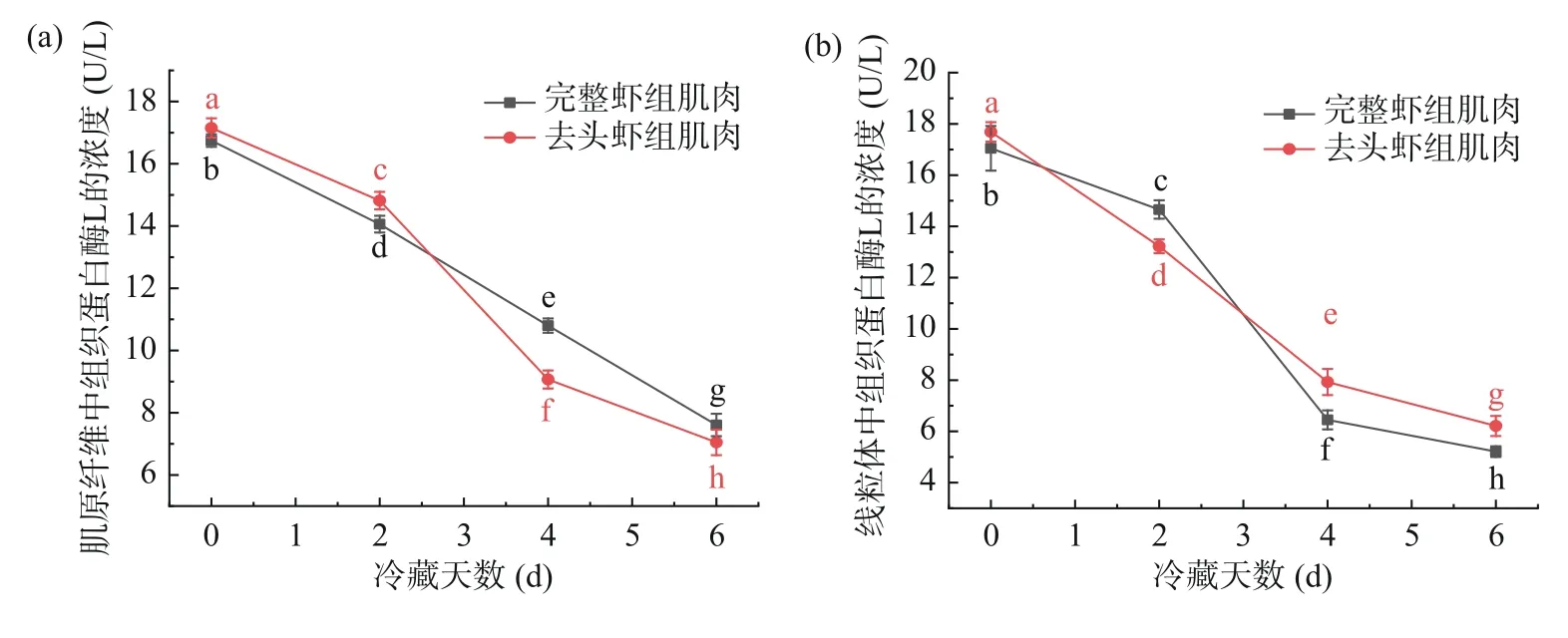
2.7 亚细胞各部分中组织蛋白酶B、D、H及L活性变化
肌原纤维、线粒体、溶酶体及肌浆中的组织蛋白酶活性的变化趋势是相似的,在整个贮藏过程中均不断下降,这与邱恒恒[31]在低温贮藏白斑狗鱼过程中的研究结果一致。在冷藏6 d,溶酶体中的组织蛋白酶活性均显著下降(P<0.05),其中下降最明显的是溶酶体中的组织蛋白酶L的活性,完整虾组与去头虾组分别从下降了61.20%和57.14%,而活性最高的是组织蛋白酶D,完整虾组与去头虾组分别从65.59、61.75 U/L下降至34.63、33.40 U/L,推测是由于组织蛋白酶从破裂的溶酶体中释放出去,转移到了其他的亚细胞结构。同理,冷藏后的线粒体及肌原纤维中的组织蛋白酶活性要显著低于新鲜的哈氏仿对虾(P<0.05),这可能是由低温抑制酶活所引起的。如图6~图9所示,在冷藏过程中,完整虾组与去头虾组肌浆中组织蛋白酶活性呈不断下降趋势,且在贮藏后期,去头虾组肌浆中组织蛋白酶活性显著低于完整虾组,在冷藏6 d后,完整虾组和去头虾组肌浆中活性最高的组织蛋白酶D分别下降了50.26%和65.94%。组织蛋白酶D是在生物界中广泛存在的一种重要的胞内天冬氨酸蛋白酶,从活性高低来看,组织蛋白酶D的活性远高于另外三种组织蛋白酶,这表明在哈氏仿对虾死后组织蛋白酶D起着重要的作用[32]。

图6 哈氏仿对虾虾肉各亚细胞组分中组织蛋白酶B的活性变化情况Fig.6 Changes of cathepsin B activity in each subcellular component of Parapenaeopsis hardwickii
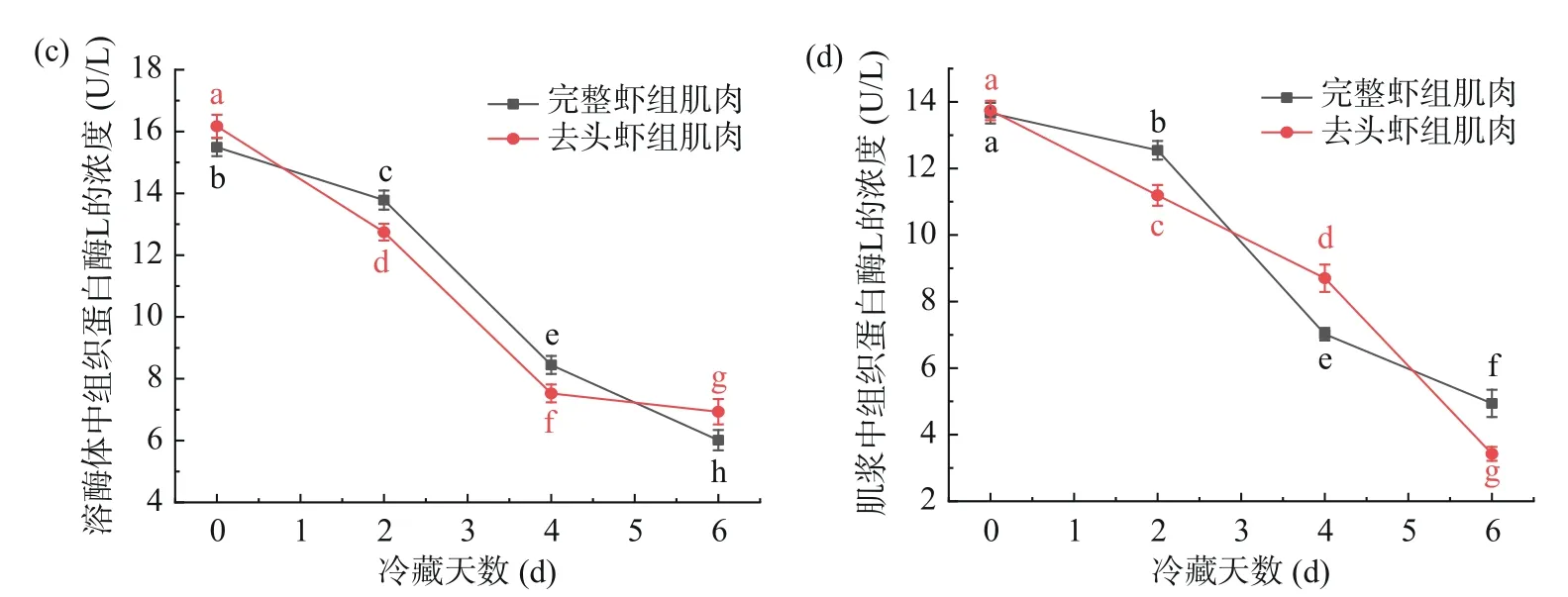
图9 哈氏仿对虾虾肉各亚细胞组分中组织蛋白酶L的活性变化情况Fig.9 Changes of cathepsin L activity in each subcellular component of Parapenaeopsis hardwickii
3 结论
通过对哈氏仿对虾在冷藏过程中品质特性和多种内源酶活性变化研究,发现随着贮藏时间的延长,哈氏仿对虾肌肉的硬度、弹性、内聚性、胶黏性、肌原纤维蛋白含量、钙蛋白酶和组织蛋白酶活性均下降,其粘附性、TCA-可溶性肽、肌原纤维小片化指数不断升高;其中虾头及去头虾肉中的胰蛋白酶活性随着冷藏时间的推移下降,而整虾肉中的活性则是处于上升状态;虾头胰蛋白酶在贮藏期间能向肌肉扩散和迁移,并参与肌原纤维蛋白的降解,使其酶的活性下降;去头虾肉中胰蛋白酶作为一种蛋白质在贮藏的过程中逐渐被分解,使得胰蛋白酶的活性下降。在亚细胞各部分中,完整虾组的酶活性均高于去头虾组。由此可得,冷藏条件下去头的方式更适合哈氏仿对虾的贮藏。

图8 哈氏仿对虾虾肉各亚细胞组分中组织蛋白酶H的活性变化情况Fig.8 Changes of cathepsin H activity in each subcellular component of Parapenaeopsis hardwickii