猪伪狂犬病病毒变异株(RP02 株)3 种佐剂灭活疫苗制备及其安全性评价
2022-12-10车艳杰康亚男吕茂杰李建丽
车艳杰,康亚男,吕茂杰,李建丽
天津瑞普生物技术股份有限公司,天津 300308
猪伪狂犬病是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的一种以发热、奇痒(猪除外)、脑脊髓炎为主的急性传染病[1]。不同日龄猪均可感染发病,常引起妊娠母猪流产、死胎;15 日龄内仔猪死亡率高达100%,表现出体温突然升高、呕吐、腹泻、精神高度沉郁;成年猪感染率较低,不表现临床症状或仅有轻微体温升高[2-3]。据报道,2011 年开始,我国出现了猪伪狂犬病病毒变异株,造成现有的商品化疫苗保护效力下降,并呈现一定范围的流行和发病,引起严重的母猪繁殖障碍和初生乳猪死亡,给我国养猪业造成了较大的经济损失[4]。天津瑞普生物技术股份有限公司研究院(以下简称瑞普生物研究院)从临床发病猪只中分离到多株PRV 变异株,并筛选了1 株免疫原性优良的疫苗候选株(RP02 株)。本研究根据临床需求和瑞普生物研究院前期基础性研究,制备了3 种佐剂的变异株疫苗,并采用本动物和非本动物相结合的双重安全评价法,评价3 种佐剂疫苗的安全性,以期为后续PRV 变异株灭活疫苗的研制提供数据支撑和技术指导。
1 材料与方法
1.1 试验材料
1)毒种与细胞。猪伪狂犬病毒变异株(RP02株)和ST 细胞,均由天津瑞普生物技术股份有限公司研究院鉴定和保存。
2)佐剂。佐剂1 属于水溶性载体类,佐剂2 属于研究院自主研制的水溶型,均由天津瑞普生物技术股份有限公司制备和保存;佐剂3 属于油乳剂W/O/W 型,购于赛彼科公司。
3)试验动物。4~5 周龄SPF 级BALB/c 小鼠,购自北京维通利华实验动物技术有限公司。3~4 周龄仔猪(PRV 抗原、抗体双阴性),购自天津某养殖场。
4)其他材料。新生牛血清,购自内蒙古金源康生物工程股份有限公司;胰酶和DMEM 购自Gibco公司。
1.2 试验方法
1)疫苗制备。将培养48 h 的ST 细胞,按培养体积1%比例接种猪伪狂犬病毒RP02 株,待细胞病变达到90%以上时收获病毒液。反复冻融2 次后,经膜包浓缩和分子筛纯化后得到纯化病毒液,再经4%二乙烯亚胺(BEI)灭活,将灭活检验合格病毒液分别按佐剂使用说明配制3 种佐剂疫苗,备用。配苗时,灭活前抗原含量不低于108.5TCID50/mL。
2)病毒含量测定。将病毒液样品用含2%新生牛血清的DMEM 培养液做10 倍系列稀释,取10-6、10-7、10-8、10-94 个稀释度,每个稀释度分别接种生长良好单层ST 细胞的96 孔细胞板,每个稀释度6孔,100 μL/孔,同时设正常细胞对照6 孔,置37 ℃含5% CO2培养箱中吸附1 h,而后每孔补加含2.0%新生牛血清的DMEM 维持液100 μL,置37 ℃含5% CO2培养箱中继续培养4~5 d,每天观察并记录细胞病变(CPE)孔数,根据每个稀释度的病变细胞孔数,按Reed-Muench 方法计算TCID50。
3)灭活检验。采用细胞法进行灭活检验。取灭活后的病毒液,10 倍稀释后接种生长良好单层BHK-21 细胞的6 孔细胞板,平行接种2 孔,每孔1.0 mL,置37 ℃含5% CO2培养箱吸附1 h,弃去液体,加入含2%新生牛血清的DMEM 培养液2.0 mL,同时设病毒对照和正常细胞对照,37 ℃培养含5%CO2培养箱中继续培养4~5 d,观察细胞病变情况,判定病毒是否完全灭活。
4)疫苗检验。制备疫苗按照《中华人民共和国兽药典》三部附录进行相关检验,应符合规定。
5)安全性评价。①小鼠安全性评价。选取4~5周龄BALB/c 小鼠40 只,随机分成4 组,每组10只。第1~3 组分别接种3 种佐剂疫苗,背部皮下注射,接种2 次,间隔14 d,0.5 mL/次,第4 组为空白对照组。于首免后14 d 和二免后14 d,各组分别随机抽取5 只小鼠剖检,观察注射部位及疫苗吸收情况。②仔猪安全性评价。选取3~4 周龄PRV 双阴性猪只20 头,随机分成4 组,第1~3 组分别接种3 种佐剂疫苗,颈部肌肉注射,4.0 mL/头,第4 组为空白对照组。连续观察14 d,记录试验猪只的精神状态、采食、行为活动;同时,从注射当日连续测温7 d,观察试验猪只的体温变化;14 d 后试验猪进行剖检,观察注射部位及疫苗吸收情况。
2 结果与分析
2.1 抗原含量测定
将ST 细胞培养获得30 L 病毒液(RP02 株),按Reed-Muench 方法测定和计算其TCID50,结果表明,培养毒液的病毒含量为109TCID50/mL,符合配苗标准要求。
2.2 灭活检验结果
采用细胞法验证灭检效果,结果显示,灭活病毒液检验孔和正常细胞对照孔均无细胞病变,病毒阳性对照孔出现融合、拉网、崩解等典型的细胞病变(图1),结果表明,病毒液(RP02 株)已灭活完全,灭活工艺符合标准。

图1 PRV(RP02 株)病毒灭活前后细胞病变观察
2.3 疫苗成品检验
按照《中华人民共和国兽药典》三部附录进行3种佐剂疫苗相关检验。结果表明,制备的3 种佐剂PRV 变异株疫苗均符合规定(表1)。

表1 疫苗检验结果
2.4 安全性评价
1)小鼠安全性评价。从试验小鼠的精神状态、注射局部炎症和吸收程度3 个方面评价3 种佐剂疫苗对小鼠的安全性。3 组疫苗免疫2 次后,在观察期内,3 组免疫小鼠均行动敏捷、精神状态良好,未见被毛蓬乱、精神沉郁等眼观不良现象(图2);首免后14 d 和二免后14 d,每组随机取5 只小鼠观察注射部位,3 组疫苗的注射部位均未见肿胀、起疱、结块等不良现象;注射部位剖检显示,佐剂1 疫苗组和佐剂2 疫苗组均吸收良好,而佐剂3 疫苗组仍有少量肉眼可见的未吸收疫苗(图3)。以上结果综合表明,在安全性上,佐剂1 和佐剂2 无差异,均优于佐剂3。

图2 小鼠注射疫苗后精神状态的眼观结果
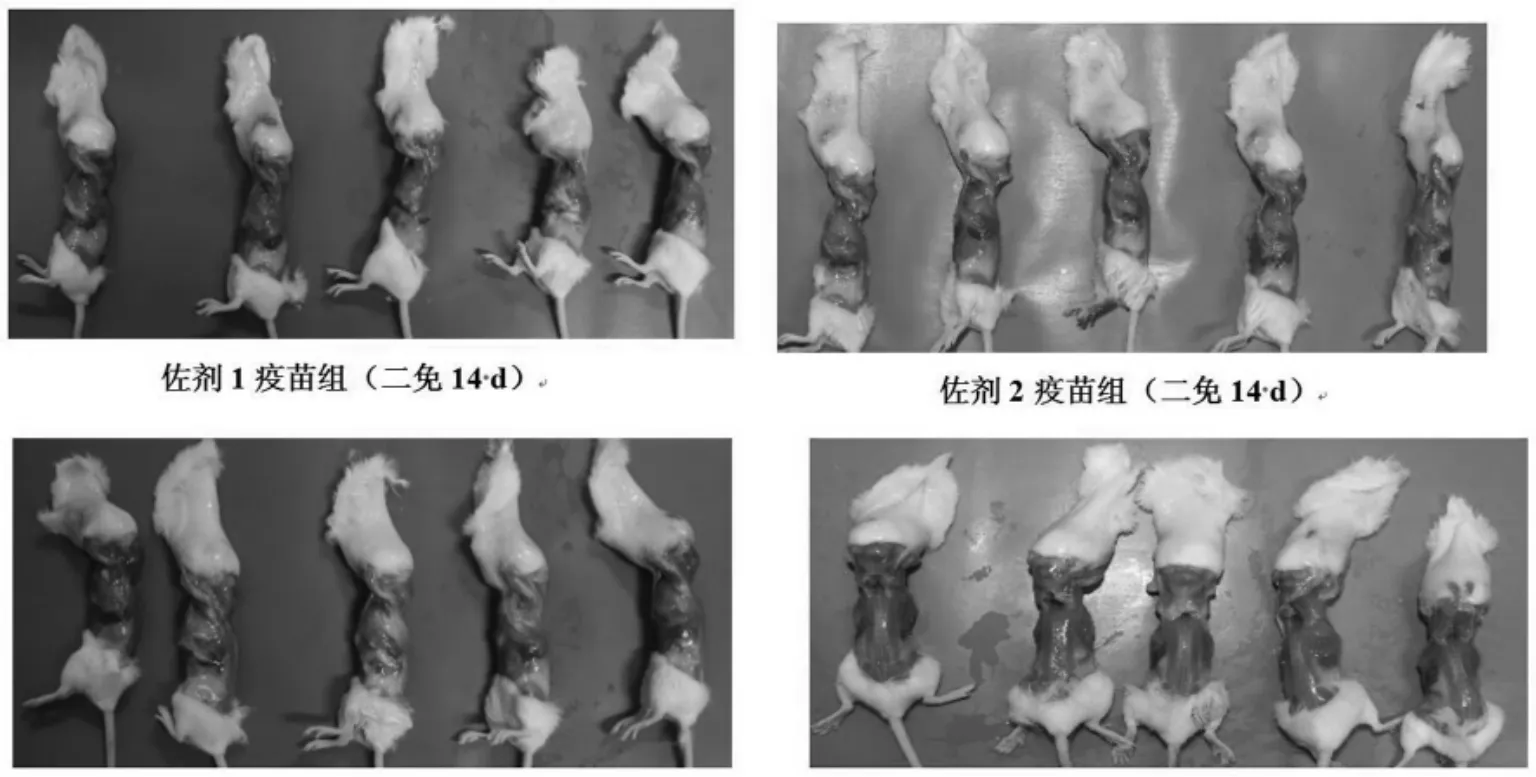
图3 小鼠注射部位疫苗吸收情况观察
2)仔猪安全性评价。从临床整体观察、注射局部炎症反应、吸收效果和体温变化4 个方面评价疫苗对仔猪的安全性。疫苗免疫后在观察期内,3 组佐剂疫苗的试验猪只采食饮水均正常,精神状态良好,均未见精神沉郁、免疫不良反应等现象(表2);注射部位也未见肿胀、硬结等局部不良炎症反应;疫苗吸收均良好,未见眼观可见的吸收不良现象;在体温方面,佐剂1 疫苗组和佐剂2 疫苗组均无明显的体温变化,但佐剂3 疫苗组,在免疫后1 d 出现一过性体温升高现象,见图4。以上结果综合提示,在安全性上,佐剂1 和佐剂2 无差异,均优于佐剂3。

表2 仔猪安全性评价结果
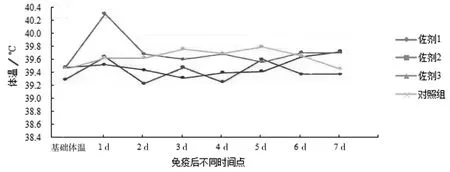
图4 注射后体温监测结果
3 讨 论
疫苗免疫仍是防控PRV 流行和危害的有效措施之一。随着近些年PRV 变异株的出现,PRV 变异株灭活疫苗得到了临床应用,获得了一定的临床效果。开发一种安全、高效的PRV 变异株灭活疫苗是当务之急。
关于PRV 变异株灭活疫苗的研究与开发,涉及PRV 变异毒株分离、鉴定、培养、免疫原性、灭活、佐剂等众多方面,其中免疫佐剂在PRV 变异株灭活疫苗的安全性和有效性方面起关键性作用。目前,最常用的动物用免疫佐剂可分为油乳剂类和水溶性类等,油乳剂类又分为水包油型(W/O)、油包水型(O/W)、水包油包水型(W/O/W);水溶性类佐剂包括铝盐、聚合物、载体蛋白等载体类。本研究在天津瑞普研究院前期PRV 变异毒株的分离、鉴定、培养等研究的基础上,选择具有代表性的油乳剂类水包油包水型(W/O/W)、水溶性载体类卡波姆佐剂以及自主开发的水溶性佐剂,分别制备PRV 变异株灭活疫苗,并通过本动物和非动物开展双重安全性试验验证佐剂的安全性,旨在为开发新型、安全、高效PRV变异株灭活疫苗提供数据支撑。
水性佐剂疫苗因免疫副反应低、吸收速度快等特点逐渐受到临床使用者的认可。本试验结果表明,在本动物和非本动物的安全性方面,水溶性佐剂无论是载体类卡波姆佐剂还是自主研发的佐剂,均优于油乳剂类水包油包水型(W/O/W)。研究表明,卡波姆分子链相互共价交联,构成高分子聚合物,具有一定的缓释作用[5]。其既能明显刺激动物机体细胞免疫应答,又能有效地激活体液免疫应答,已在猪圆环病毒、猪支原体肺炎、猪塞内卡病毒和禽流感疫苗研究中得到验证[6-9]。本研究结果可为后续基于卡波姆佐剂的疫苗研发提供技术参考。
