不同来源抗冻蛋白在毕赤酵母中的异源表达
2021-11-15吴港城齐希光
刘 玫,马 豪,张 晖,梁 赢,吴港城,齐希光
1.河南工业大学 粮油食品学院,河南 郑州 450001
2.江南大学 食品学院,江苏 无锡 214122
3.河南工业大学 生物工程学院,河南 郑州 450001
抗冻蛋白(antifreeze proteins,AFPs)是一类具有热滞活性、修饰冰晶形态和抑制冰晶重结晶能力的蛋白质[1-3],在冷冻食品领域具有广阔的应用前景。不同生物来源的AFPs由于越冬机制不同而具有不同的活性,如来源于避冻昆虫和鱼类的AFPs热滞活性较高,来源于耐冻植物的AFPs抑制重结晶能力较强[4]。因此,可以根据冷冻食品的不同劣变机制选择不同特性的AFPs加以保护。
虽然目前已从植物、鱼类及昆虫等生物体内分离得到AFPs,但是提取AFPs存在产量低、成本高等不足,导致无法实现规模化生产,限制了其工业化应用[5-7]。化学方法可以合成某些AFPs,但是成本太高,难以广泛应用。目前已实现AFPs在原核生物大肠杆菌中的克隆表达,但是AFPs在原核生物体内常常不能被正确地加工而无抗冻活性,且用大肠杆菌表达的蛋白常以包涵体形式存在,后续分析工作十分困难[8]。毕赤酵母表达系统既有原核生物分子基因操作与生长的特征,又具备真核生物翻译后蛋白修饰的亚细胞机制,是目前应用最广泛的真核表达系统[9]。毕赤酵母表达系统主要具有以下优点:(1) 外源基因通过表达载体整合到酵母基因组上,基因工程菌的遗传稳定性良好[10];(2) 所得目的蛋白易于分离纯化[11];(3) 不存在内毒素残留问题[12];(4) 所得目的蛋白具有天然的高级结构和生物活性[13];(5) 具有酿酒酵母系统的优点,可进行高密度发酵,易于进行工业化放大生产,从而提高重组蛋白的产量[9]。基于上述诸多优势,毕赤酵母表达系统在rAFPs的工业化生产方面具有广阔的应用前景[14-18]。
对于天然AFPs来说,胡萝卜AFP富含亮氨酸,相对分子质量为36 800,热滞活性较低,具有较强的抑制冰晶重结晶能力,在冷冻面团的储存方面具有较大应用潜力[5,19-21];鱼类AFPs是一类发现最早且编码基因序列确定最多的AFPs[22],鱼的种类不同,AFPs结构和活性的差异很大;黄粉虫AFP的热滞活性最高,可达5.5 ℃[18]。目前已经有较多AFPs(美绒杜父鱼和鲱鱼的鱼类AFPs以及来自小胸鳖甲和云杉卷叶蛾的昆虫类AFPs)利用毕赤酵母异源表达[14,18,23-28],而关于胡萝卜AFP在毕赤酵母中异源表达的研究还鲜有报道,黄粉虫AFP在毕赤酵母中表达虽也有报道[29-30],但是研究不够深入。另外,即使来源相同的AFPs,由于编码rAFPs的基因序列不同,AFPs异源表达的效果也会有很大差异。
本研究基于NCBI数据库中胡萝卜AFP (登录号:AAC62932.1)、点带石斑鱼AFP (登录号:AGM15882.1)和黄粉虫AFP (登录号:ABB03885.1)的氨基酸序列,根据毕赤酵母密码子偏好性,分别合成rCaAFP、rFiAFP和rTmAFP的基因序列,通过构建酵母表达载体、G418和24孔板多重筛选,获得3株分别产rCaAFP、rFiAFP和rTmAFP的重组毕赤酵母菌株;对重组毕赤酵母菌株产rAFPs的发酵过程进行初步优化,并将发酵得到的rAFPs进行一系列纯化,得到3种抗冻活性较好的rAFPs。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
毕赤酵母GS115、大肠杆菌DH5α、表达质粒pPIC9K:美国Invitrogen公司。
限制性内切酶EcoRI、NotI、Solution I连接液、T4连接酶、2×Super pfu PCR MasterMix、2×Taq PCR MasterMix等:中国大连Takara公司。
1.1.2 工具酶及试剂
SanPrep柱式质粒DNA小量抽屉试剂盒、SanPrep柱式PCR产物纯化试剂盒等:上海生物工程有限公司。LB培养基、YPD培养基、BMGY培养基、BMMY培养基等:分析纯,国药集团化学试剂有限公司。
1.2 方法
1.2.1 rCaAFP、rFiAFP和rTmAFP的基因合成
基于NCBI数据库中胡萝卜AFP (登录号:AAC62932.1)、点带石斑鱼AFP (登录号:AGM15882.1)和黄粉虫AFP (登录号:ABB03885.1)的氨基酸序列,按照毕赤酵母的密码子偏好性,结合避免稀有密码子、平衡G+C含量和提高mRNA稳定性等原则,分别合成了rCaAFP、rFiAFP和rTmAFP的基因序列,结合表达载体pPIC9K内切酶酶切位点的分布情况,在基因序列两端均分别加上EcoRI (5′端)和NotI (3′端)酶切位点。
1.2.2 重组表达载体的构建
利用限制性内切酶EcoRI和NotI对含目的基因的质粒pMD18-T/rCaAFP和质粒pPIC9K分别进行双酶切,胶回收后将得到的双酶切目的基因和质粒pPIC9K进行连接获得重组表达载体pPIC9K/rCaAFP。pPIC9K/rFiAFP和pPIC9K/rTmAFP的构建方法同pPIC9K/rCaAFP。
大肠杆菌感受态的制备及转化:参考生工生物工程(上海)股份有限公司的细菌超级感受态细胞制备试剂盒的说明,制备大肠杆菌感受态细胞。利用热击转化的方法[31],将连接液转入大肠杆菌DH5α感受态中。
1.2.3 毕赤酵母的电击转化和转化子的筛选
重组表达质粒的线性化:为提高重组真核表达质粒在酵母染色体上的整合效率,方便后续筛选转化子,转化前利用限制性内切酶SalI对构建好的重组表达质粒进行单酶切,达到质粒线性化的效果。
毕赤酵母感受态的制备:参照文献[31]。
毕赤酵母的电击转化:将线性化后的重组质粒pPIC9K/rCaAFP、pPIC9K/rFiAFP、pPIC9K/rTmAFP和线性化后的空pPIC9K质粒,分别通过电击转化的方式转入毕赤酵母感受态细胞[31]。
1.2.4 产高热滞活性rAFPs重组毕赤酵母的筛选
将1.2.3中获得的转化子依次接种于G418质量浓度为0.2、0.4、0.6、0.8 g/L的YPD-G418固体培养基,在30 ℃条件下培养直至单菌落产生,筛选高拷贝数的3株重组毕赤酵母菌株;然后用24孔板进行发酵筛选,取20 mL发酵上清液冻干后复溶于2 mL磷酸盐(PBS)缓冲液(50 mmol/L,pH 7.4),将发酵上清液浓缩至原体积的1/10,测定热滞活性,筛选出浓缩发酵上清液热滞活性最高的3株重组毕赤酵母菌株(GS115-pPIC9K/rCaAFP、GS115-pPIC9K/rFiAFP和GS115-pPIC9K/rTmAFP)用于后续研究。
1.2.5 重组毕赤酵母产rAFPs的诱导表达
将3株重组毕赤酵母菌株(GS115-pPIC9K/rCaAFP、GS115-pPIC9K/rFiAFP和GS115-pPIC9K/rTmAFP)分别接种至含50 mL BMGY液体培养基的250 mL三角瓶中,200 r/min、30 ℃恒温振荡培养至对数生长期,即OD600为5~6,振荡培养时间20~24 h。以转化了pPIC9K空载体的毕赤酵母菌株作为试验对照。
室温条件下,3 000g离心5 min后回收酵母细胞。弃上清液,用100 mL BMMY培养基重新悬浮细胞于500 mL三角瓶。
将500 mL三角瓶用透气滤膜封口后,200 r/min、30 ℃继续培养并用甲醇诱导表达,发酵120 h后将发酵液在8 010g、4 ℃条件下离心5 min,测定上清液的总蛋白含量和热滞活性。总蛋白含量利用Bradford法[32]测定,牛血清白蛋白(BSA)作为标准蛋白。
1.2.6 重组毕赤酵母产rAFPs的高密度发酵
重组毕赤酵母在YPD培养基上培养24 h (30 ℃和200 r/min),然后将400 mL种子培养液接种至7 L发酵罐(含有4 L BMGY和10 mL/L PTM1溶液)中,高密度发酵过程包含3个阶段:初始分批发酵阶段、甘油流加阶段和甲醇诱导阶段。(1) 初始分批发酵阶段:pH值和温度分别控制在6.0和30 ℃,溶氧水平大于20%;溶氧水平突然上升表明甘油耗尽,即甘油流加阶段开始。(2) 甘油流加阶段:500 g/L甘油(含有12 mL/L PTM1溶液)以40.0 mL/h的速度加入培养基中;pH值、温度和溶氧水平设置同初始分批发酵阶段;流加8 h后停止补加甘油,随后,溶氧水平增加直至100%,然后维持100%溶氧水平1 h以完全耗尽培养基中的甘油。(3) 甲醇诱导阶段:甲醇(含有12 mL/L PTM1溶液)先以11.6 mL/h的速度补加,当溶氧水平恒定时,补加速度改为23.2 mL/h直至发酵过程结束;pH值以摇瓶水平的最适pH为准,温度30 ℃,溶氧水平大于20%。
菌体生物量用稀释倍数乘以OD600表示。总分泌蛋白质含量利用Bradford法(BSA作为标准蛋白)进行测定[32]。rAFPs含量(mg/L)等于总分泌蛋白质含量乘以rAFPs所占比例,rAFPs所占比例利用软件Image J通过灰度分析法分析SDS-PAGE电泳图谱得到。
1.2.7 rAFPs的纯化
发酵结束后,发酵液在8 000g和4 ℃的条件下离心10 min,收集上清液,然后用超滤离心管浓缩上清液,截留液依次用硫酸铵沉淀、冰特异性亲和法和高效液相色谱(HPLC)法进行纯化[33],最后利用SDS-PAGE鉴定rAFPs的纯度和相对分子质量[34]。
1.2.7.1 超滤浓缩
分别选用截留相对分子质量为10 000、3 000和3 000的超滤离心管处理发酵液,超滤的终点是原发酵液体积的1/10,并收集截留液。
1.2.7.2 硫酸铵沉淀法
将超滤浓缩后收集的截留液平均分成3份,缓慢加入研磨的硫酸铵粉末至其最终质量分数分别为20%、40%和60%,离心收集上清液和沉淀,上清液中继续添加硫酸铵粉末,使质量分数分别从原来的20%升至40%、40%升至60%、60%升至80%,离心收集沉淀。收集的沉淀分别复溶于PBS缓冲液(50 mmol/L,pH 7.4),用截留相对分子质量为3 500的透析袋过夜透析,最后通过测定截留液的热滞活性确定纯化每种rAFPs所需的最佳硫酸铵质量分数。
1.2.7.3 冰特异性亲和法
将硫酸铵沉淀后得到的rAFPs粗提液,采用冰特异性亲和法[35]进行纯化,然后将收集的冰晶组分复溶于PBS缓冲液(50 mmol/L,pH 7.4),利用该方法重复吸附。测定每次吸附后rAFPs粗提液的热滞活性,以确定吸附每种rAFPs所需的最佳吸附次数。
1.2.7.4 HPLC法
将冰特异性亲和吸附后的rAFPs粗提液冻干后,利用HPLC进一步纯化。
液相条件:洗脱柱C18柱(10 mm×250 mm,Waters);流动相:溶液A是水(含0.1%三氟乙酸),溶液B是乙腈(含0.1%三氟乙酸);进样量100 μL;检测波长218 nm。纯化rCaAFP:流速4 mL/min,线性洗脱,乙腈50 min由5%升至85%,5 min由85%升至100%。纯化rFiAFP:流速3 mL/min;线性洗脱,乙腈50 min由5%升至85%,5 min由85%升至100%。纯化rTmAFP:流速3 mL/min,线性洗脱,乙腈50 min由5%升至85%,5 min由85%升至100%。最后收集具有热滞活性的洗脱峰,并用SDS-PAGE鉴定rAFPs的纯度和相对分子质量。
1.2.8 SDS-PAGE分析
参照Laemmli[34]建立的不连续系统进行SDS-PAGE,其中浓缩胶为15%。样品的相对分子质量根据标准蛋白质Marker的相对迁移率计算得到。
1.3 数据统计与分析
所有试验均重复至少3次,数据以平均值±标准偏差的形式表示。利用SPSS 20.0软件处理数据,并通过单因素方差分析(ANOVA)和Duncan法分析显著性差异(P<0.05)。
2 结果与讨论
2.1 rCaAFP、rFiAFP和rTmAFP的基因合成
基于NCBI数据库中胡萝卜AFP (登录号:AAC62932.1)、点带石斑鱼AFP (登录号:AGM15882.1)和黄粉虫AFP (登录号:ABB03885.1)的氨基酸序列,根据毕赤酵母密码子的偏好性,合成长度分别为966、519、360 bp的rCaAFP、rFiAFP和rTmAFP基因,结果分别如图1—图3所示。

图1 rCaAFP的基因序列
2.2 重组表达载体的构建
为鉴定重组表达载体的构建结果,对阳性克隆子摇瓶培养并提取质粒后,利用EcoRI和NotI对其进行双酶切,结果如图4所示。由图4可知,双酶切得到的基因片段大小与质粒pPIC9K及相应rAFPs基因的大小一致。测序结果表明,PCR获得的基因序列与编码rAFPs的基因序列完全一致(因测序结果与图1—图3的基因序列一致,故略去)。综合分析可知,3种包含相应编码rAFPs基因的表达载体均已构建成功。

图2 rFiAFP的基因序列

图3 rTmAFP的基因序列

注:M为Marker;1为双酶切产物。
2.3 产高热滞活性rAFPs重组毕赤酵母的筛选
重组表达质粒pPIC9K/rCaAFP、pPIC9K/rFiAFP和pPIC9K/rTmAFP分别经SalI线性化后,电击转化至毕赤酵母感受态细胞中,然后经过不含组氨酸MD平板的筛选。以生长最快的重组转化子的基因组为模板,利用目的基因的上下游引物进行PCR扩增,电泳结果如图5所示,扩增获得的基因片段与目的基因大小一致。说明rCaAFP、rFiAFP和rTmAFP的基因已经成功整合到毕赤酵母基因组上。
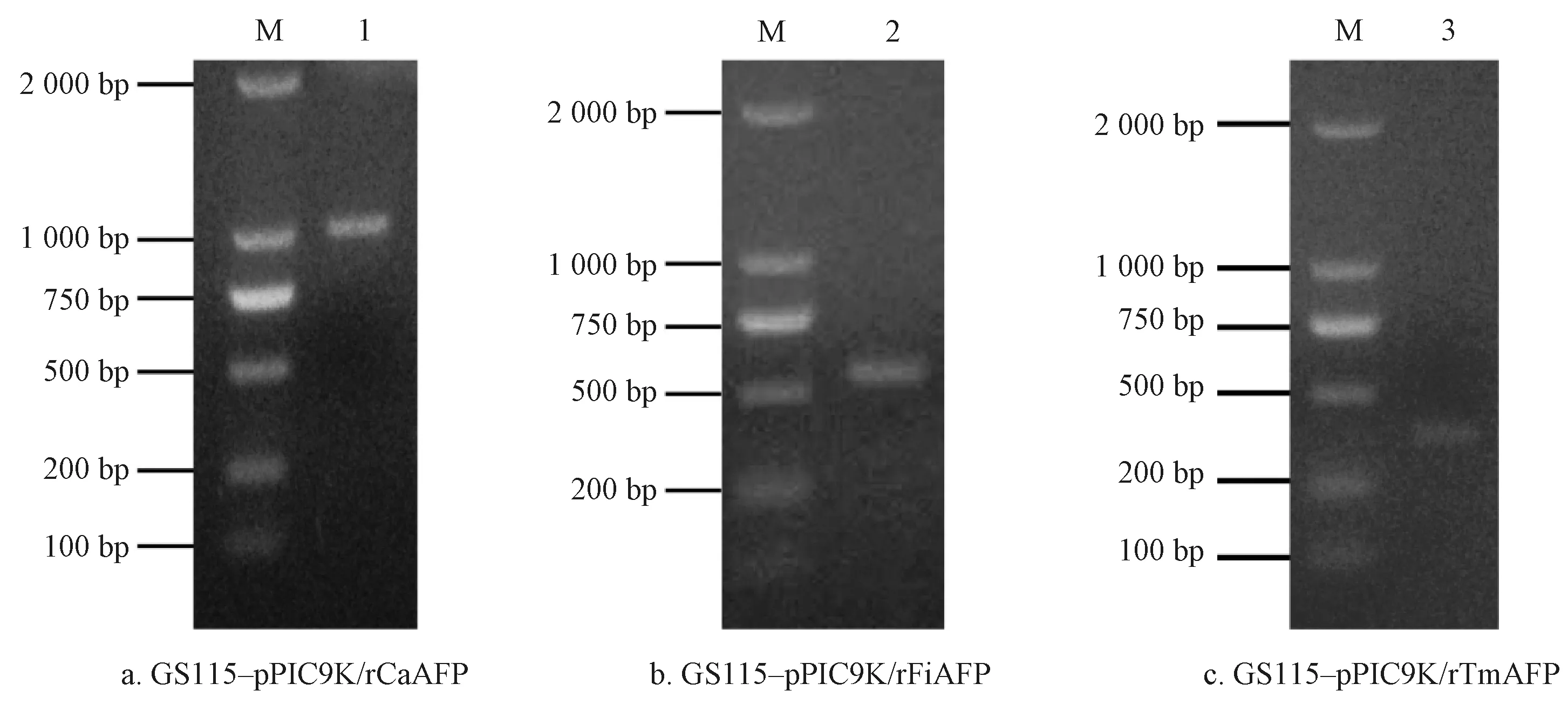
注:M为Marker; 1、2、3为PCR样品。
然后依次利用G418质量浓度为0.2、0.4、0.6、0.8 g/L的YPD-G418培养基筛选上述阳性转化子,分别获得了17个GS115-pPIC9K/rCaAFP转化子、22个GS115-pPIC9K/rFiAFP转化子和19个GS115-pPIC9K/rTmAFP转化子。
将上述获得的转化子单菌落分别接种到YPD平板培养基上,37 ℃培养2 d,然后利用24孔板进行筛选。结果显示,所有的浓缩发酵上清液均有热滞活性,说明构建的重组毕赤酵母表达系统可以胞外分泌具有热滞活性的rCaAFP、rFiAFP和rTmAFP。
选择产rCaAFP、rFiAFP和rTmAFP热滞活性最高的5个转化子,分别在摇瓶发酵72 h和96 h,测定发酵上清液(浓缩至原体积的1/10)的热滞活性,结果见图6。由图6可知,发酵96 h,rCaAFP重组菌株C-2、rFiAFP重组菌株F-4和rTmAFP重组菌株T-5浓缩发酵上清液的热滞活性分别为0.95、1.64、3.21 ℃,均显著高于产同一rAFPs的其他重组菌株。因此,选择编号为C-2、F-4和T-5的重组毕赤酵母菌株用于后续研究。

注:不同小写字母表示差异显著(P<0.05)。图7—图9同。
2.4 重组毕赤酵母产rAFPs的诱导表达
2.4.1 诱导起始时间对重组毕赤酵母产rAFPs的影响
重组毕赤酵母发酵产rAFPs的过程可分为菌体积累期和诱导产rAFPs期[36]。诱导起始时间是影响rAFPs诱导表达的重要因素。因此,考察诱导起始时间对3株重组毕赤酵母菌株产rAFPs的影响,结果如图7所示。
由图7可知,不同的诱导起始时间对重组毕赤酵母菌株产rAFPs的能力均有显著影响。诱导起始时间在12~24 h,随着诱导起始时间的推迟,3株重组毕赤酵母菌株发酵上清液的总蛋白含量和热滞活性均呈现先增大后减小的趋势。这可能是:当诱导起始时间较早时,菌体处于对数生长的前期,生长状态不稳定,且菌体数量较少,总蛋白含量和热滞活性较低;当诱导起始时间较晚时,菌体细胞活力较低,更易受到甲醇毒害,rAFPs的诱导效率降低。3株重组毕赤酵母菌株发酵上清液的热滞活性达到最大值时的诱导起始时间分别为16、18、18 h,与总蛋白含量达到最大值时的诱导起始时间一致。因此,在摇瓶水平上,重组毕赤酵母菌株GS115-pPIC9K/rCaAFP、GS115-pPIC9K/rFiAFP和GS115-pPIC9K/rTmAFP的诱导起始时间分别为16、18、18 h时,3株菌株进行甲醇诱导时均具有最好的rAFPs表达能力。

图7 诱导起始时间对发酵上清液的总蛋白含量和热滞活性的影响
2.4.2 甲醇质量分数对重组毕赤酵母产rAFPs的影响
毕赤酵母诱导发酵时,甲醇可以作为唯一碳源,同时也是外源蛋白表达的诱导剂。诱导时的甲醇质量分数是调控诱导发酵产外源蛋白的重要参数[37]。因此,以诱导96 h后发酵上清液的总蛋白含量和热滞活性为评价指标,考察不同质量分数的甲醇(0.5%、1.0%、1.5%、2.0%、2.5%和3.0%)对重组毕赤酵母产rAFPs的影响,结果如图8所示。
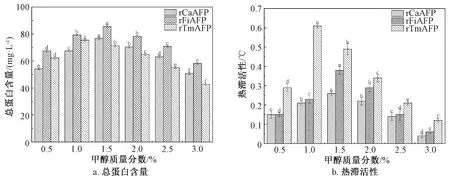
图8 甲醇质量分数对发酵上清液的总蛋白含量和热滞活性的影响
由图8可知,不同质量分数的甲醇对3株重组毕赤酵母菌株产rAFPs的能力均有显著影响。随着甲醇质量分数的增加,3株重组毕赤酵母菌株发酵上清液的总蛋白含量和热滞活性均呈现先增大后减小的趋势,当甲醇质量分数分别为1.5%、1.5%和1.0%时,重组毕赤酵母菌株GS115-pPIC9K/rCaAFP、GS115-pPIC9K/rFiAFP和GS115-pPIC9K/rTmAFP发酵上清液中的总蛋白含量和热滞活性均达到最大值。当甲醇质量分数较低时,诱导力不足,导致外源蛋白的产量较低;当甲醇质量分数过高时,会产生过多的甲醛等中间产物,导致细胞生长状态不佳,也会降低外源蛋白的表达能力[37]。因此,在摇瓶水平上,重组毕赤酵母菌株GS115-pPIC9K/rCaAFP、GS115-pPIC9K/rFiAFP和GS115-pPIC9K/rTmAFP分别补加质量分数为1.5%、1.5%和1.0%的甲醇进行诱导发酵时,具有最佳的rAFPs表达能力。
2.4.3 诱导阶段pH值对重组毕赤酵母产rAFPs的影响
培养基pH值既可以影响微生物的生长速度和代谢产物的生成速率,也会影响营养物质的解离状态和相应成分的利用速率[38]。通过考察诱导阶段不同pH值对发酵上清液总蛋白含量和热滞活性的影响,以确定重组毕赤酵母产rAFPs的最适诱导pH值,结果见图9。
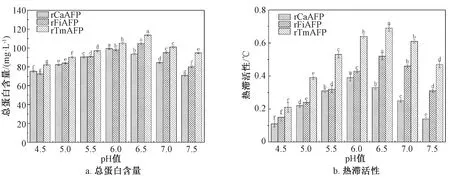
图9 pH值对发酵上清液的总蛋白含量和热滞活性的影响
由图9可知,3株重组毕赤酵母菌株产rAFPs的能力随着诱导阶段pH值的升高呈先增大后减小的趋势。当诱导阶段pH值分别为6.0、6.5和6.5时,3株重组毕赤酵母菌株发酵上清液的总蛋白含量和热滞活性均达到最大值。当诱导pH值低时,细胞死亡速率加快,会产生更多的杂蛋白;当诱导pH值高时,蛋白酶活性增加,会引起蛋白酶对rAFPs的降解效率增大。因此,在摇瓶水平上,3株重组毕赤酵母菌株合成rAFPs的最适诱导pH值分别为6.0、6.5和6.5,此时,发酵上清液的总蛋白含量分别为99.47、104.89、113.79 mg/L,热滞活性分别为0.39、0.52、0.69 ℃。在后续发酵研究中,3株重组毕赤酵母菌株产rAFPs的诱导阶段pH值分别控制为6.0、6.5和6.5。
2.5 重组毕赤酵母产rAFPs的高密度发酵
为进一步提高重组毕赤酵母菌株GS115-pPIC9K/rCaAFP、GS115-pPIC9K/rFiAFP和GS115-pPIC9K/rTmAFP产rAFPs的水平,在7 L发酵罐水平上进行高密度发酵,结果如图10所示。

图10 重组毕赤酵母菌株的高密度发酵
由图10可知,经过初始分批发酵阶段和甘油流加阶段后,重组毕赤酵母菌株GS115-pPIC9K/rCaAFP、GS115-pPIC9K/rFiAFP和GS115-pPIC9K/rTmAFP的生物量分别为74.87、125.79和104.83。进入甲醇诱导阶段后,3株重组毕赤酵母菌株的生物量基本保持不变。3株重组毕赤酵母菌株分别诱导64、80、80 h后,发酵上清液的总蛋白含量和目的蛋白均达到最大值,总蛋白含量分别为1 936.39、2 582.75、1 889.36 mg/L,rCaAFP、rFiAFP和rTmAFP含量分别为214.29、418.18、57.95 mg/L,3种目的蛋白的生产强度(产量/有效时间)分别为1.91、3.27、0.45 mg·L-1·h-1。
2.6 3种rAFPs的纯化及鉴定分析
根据重组毕赤酵母发酵液可能的组分和rAFPs的性质,对发酵上清液中的rAFPs进行纯化,结果见表1,并将纯化后的样品进行SDS-PAGE分析,结果如图11所示。
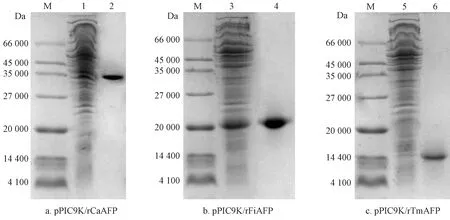
注:M为Marker;1、3、5为发酵上清液;2、4、6为纯化后的rAFP。

表1 3种rAFPs的纯化情况
硫酸铵沉淀试验结果表明:纯化rCaAFP、rFiAFP和rTmAFP对应的最佳硫酸铵质量分数梯度分别是40%~60%、60%~80%和40%~60%,3种rAFPs热滞活性分别为0.74、1.62、2.48 ℃,回收率分别为68.39%、63.74%、67.39%。冰特异性亲和吸附结果表明:rCaAFP、rFiAFP和rTmAFP最佳吸附次数分别为4、4、3次,吸附后3种rAFPs的热滞活性分别为1.49、3.29、5.93 ℃。HPLC法梯度洗脱后将具有热滞活性的组分收集并进行SDS-PAGE分析,结果表明:rCaAFP、rFiAFP和rTmAFP在SDS-PAGE图中均显示相对集中的单一条带。说明经过一系列纯化步骤后得到电泳纯的3种rAFPs,并且3种rAFPs的纯度均大于90%,可以用于后续研究。另外,rCaAFP的相对分子质量约为35 000,与已报道的胡萝卜AFP的相对分子质量(36 800)相近[19];rFiAFP和rTmAFP的相对分子质量分别约为20 000和14 400。
3 结论
本研究成功构建了分别产rCaAFP、rFiAFP和rTmAFP的重组毕赤酵母菌株GS115/pPIC9K-rCaAFP、GS115/pPIC9K-rFiAFP和GS115/pPIC9K-rTmAFP。摇瓶发酵结果表明,当诱导起始时间分别为16、18、18 h,诱导甲醇质量分数分别为1.5%、1.5%和1.0%,诱导pH值分别为6.0、6.5、6.5时,重组毕赤酵母菌株GS115/pPIC9K-rCaAFP、GS115/pPIC9K-rFiAFP和GS115/pPIC9K-rTmAFP发酵上清液的热滞活性最高,分别为0.39、0.52、0.69 ℃;7 L发酵罐高密度发酵结果表明,3株重组毕赤酵母菌株发酵上清液中rCaAFP、rFiAFP和rTmAFP含量分别为214.29、418.18、57.95 mg/L,生产强度分别为1.91、3.27、 0.45 mg·L-1·h-1。将上清液依次经过截留相对分子质量分别为10 000、3 000和3 000的超滤离心管浓缩、质量分数梯度分别是40%~60%、60%~80%和40%~60%的硫酸铵沉淀、吸附次数分别为4、4、3次的冰特异性亲和吸附,以及通过HPLC收集具有热滞活性洗脱峰的纯化步骤后,获得了电泳纯的rCaAFP、rFiAFP和rTmAFP,这3种rAFPs的热滞活性分别为1.62、4.23、7.57 ℃ (10 mg/mL)。利用毕赤酵母异源表达生产rCaAFP、rTmAFP和rFiAFP,产量高、易纯化、抗冻活性好,对于抗冻蛋白的研究及应用具有重要价值。
