碳青霉烯类耐药肺炎克雷伯菌的耐药性及毒力特征的分子生物学研究
2022-12-08师志云尹晓丽王良方侯晓慧张玉英李莎莎
师志云, 马 苗, 尹晓丽, 王良方, 侯晓慧, 张玉英, 李 刚, 王 文, 陶 佳,李莎莎, 贾 伟
肺炎克雷伯菌是一种重要的革兰阴性机会致病菌,可引起多种感染性疾病,包括尿路感染、菌血症、肺炎和肝脓肿等[1-2]。随着耐多药(MDR)和高毒力肺炎克雷伯菌(hvKP)菌株的出现,这些临床菌株在地理上的快速传播令人担忧,对公众健康构成了紧急威胁[3-5]。最近,碳青霉烯类耐药高毒力肺炎克雷伯菌(CR-hvKP)感染的报道越来越多,在临床环境中很容易传播,导致致命的暴发,抑或成为一种新的“超级细菌”[6-7]。本研究收集临床分离的CRKP菌株并从中筛选hvKP菌株,应用PCR等分子生物学技术检测导致CRKP的耐药基因及菌株的荚膜血清型、毒力基因,采用多位点序列分型(MLST)和脉冲场凝胶电泳(PFGE)等技术分析其分子流行病学特点,现报道如下。
1 材料与方法
1.1 菌株来源
收集宁夏医科大学总医院2015年1月—2019年12月分离鉴定的临床标本CRKP菌株103株(剔除同一患者同一部位的重复菌株)。根据CRE判定标准[8]确定CRKP,即亚胺培南或美罗培南最低抑菌浓度(MIC)≥4 mg/L和/或厄他培南MIC≥2 mg/L或产碳青霉烯酶。本研究质控菌株有大肠埃希菌ATCC 25922、肺炎克雷伯菌ATCC BAA-1705和1706,均购自上海汉尼生物技术有限公司。
1.2 仪器与试剂
VITEK-2 Compact全自动微生物鉴定和药敏系统购自法国生物梅里埃公司,药敏纸片购自英国OXOID公司;Xba I限制性内切酶、Premix Taq购自日本TaKaRa公司,PFGE DNA Marker由宁夏疾病与预防控制中心提供;Mycycler PCR仪、CHEF-DR Ⅲ 型脉冲场电泳系统、核酸电泳仪、紫外凝胶成像及分析系统仪均为美国Bio-Rad公司;所有引物均由上海生工生物工程公司合成。
1.3 细菌鉴定及药敏试验
利用基质辅助激光解吸电离飞行时间质谱仪(MALDI-TOF MS)进行菌种鉴定,VITEK-2全自动微生物鉴定仪及配套药敏卡(AST-GN09)进行药敏试验,药敏结果严格参照2018年版美国临床和实验室标准化协会(CLSI)标准[9]判读。抗菌药物MIC值采用微量肉汤稀释法复核。WHONET 5.6软件统计分析耐药率。
1.4 碳青霉烯酶表型检测
根据CLSI M100-S28推荐方法[9],改良碳青酶烯酶灭活试验(mCIM)联合EDTA-改良碳青酶烯酶灭活试验(eCIM)检测CRKP菌株产碳青霉烯酶表型。
1.5 毒力表型检测
拉丝试验:待测菌株接种于血琼脂平板,35℃培养过夜,用接种环轻轻挑起单个菌落,重复3次拉丝长度均≥5 mm,则为结果阳性,判断菌株为高黏性菌株[10],即为CR-hvKP菌株[11]。
1.6 耐药基因、荚膜血清型、毒力基因检测
PCR技术检测103株CRKP菌株耐药基因β内酰胺酶基因(blaSHV、blaTEM)、碳青霉烯酶基因(blaKPC、blaNDM、blaVIM、blaIMP、blaOXA-48);6种常见的荚膜血清型(K1、K2、K5、K20、K54、K57),10种毒力基因(rmpA、Kfu、Aerobactin、
mrkD、iroN、fim-H、ent-B、alls、magA、ybtS)。引物序列、扩增条件及产物长度见表1[12-16]。阳性扩增产物送至上海生工生物工程公司测序,测序结果登录NCBI网站进行BLAST比对。

表1 主要引物序列Table 1 Primers used in this study for amplifying relevant genes
1.7 CRKP的MLST分析
对103株CRKP菌株进行MLST,肺炎克雷伯菌的7个管家基因(rpoB、gapA、mdh、pgi、phoE、infB和tonB)引物序列 参 照MLST数据库(https://bigsdb.pasteur.fr/klebsiella/primers_used.
html)合成,退火温度设置为50℃。阳性扩增产物送上海生工生物工程公司测序,测序结果登录MLST数据库进行在线比对,将比对的等位基因编码组合与数据库已提交的肺炎克雷伯菌等位基因编码组合进行对比,确定其序列型(ST)。
1.8 CRKP的同源性(PFGE)分析
对拉丝试验阳性的菌株(CR-hvKP)进行PFGE图谱分析同源性[17],采用Bionumerics 7.6软件对PFGE条带进行聚类分析。
2 结果
2.1 CRKP菌株对抗菌药物的耐药性
103株CRKP菌株对临床常见抗菌药物表现为不同程度的耐药,对亚胺培南、美罗培南等耐药率为100%,对环丙沙星等耐药率为50.5%~87.4%,对多黏菌素B耐药率为1.0%,敏感性最好,见表2。

表2 103株CRKP菌株对抗菌药物的耐药率Table 2 Susceptibility of 103 strains of carbapenem-resistant Klebsiella pneumoniae to antimicrobial agents
2.2 碳青霉烯酶的表型及耐药基因的分子生物学检测
2.2.1mCIM试 验 联 合eCIM试 验 检 测 103株CRKP菌株中,94株CRKP菌株产碳青霉烯酶,其中63株(67.0%,63/94)产金属酶,31株(33.0%,31/94)产丝氨酸碳青霉烯酶。
2.2.2PCR分子生物学检测 103株CRKP菌株中β内酰胺酶基因以blaTEM检出率最高,为82株(79.6%),blaSHV基因62株(60.2%);87株碳青霉烯酶基因阳性,其中NDM、KPC、OXA-48、IMP检 出 率 分 别 为50.5%(52/103)、33.0%(34/103)、22.3%(23/103)及10.7%(11/103)。未检出VIM基因。测序结果显示,82株TEM基因阳性菌株全部为TEM-1型,62株SHV基因阳性为SHV-1(45.2%,28/62)、SHV-12型(33.9%,21/62)和SHV-11型(21.0%,13/62),52株NDM基因存在NDM-5亚型(80.8%,42/52)和NDM-1亚型(19.2%,10/52),42株KPC基因均为KPC-2型。103株CRKP菌株中,以NDM+TEM+SHV阳性株数最多为18.4%(19/103),携带KPC+TEM基因、KPC+SHV+TEM的菌株数量分别为13.6%(14/103)、12.6%(13/103)。
2.3 CRKP的MLST分析结果
103株CRKP菌 株 中 有18个ST型 别,1株因未得到完整的等位基因编号而无ST型别。ST分 型 中ST11型36株(35.3%),其 中30株 携带KPC-2基因,集中出现在神经外科(22.2%,8/36)、PICU(19.4%,7/36)、急 诊 科(19.4%,7/36)、肝 胆 外 科(11.1%,4/36)等;ST76型23株(22.5%),有21株携带NDM基因(20株NDM-5,1株NDM-1),主要分布在NICU(78.3%,18/23)。
2.4 毒力表型、荚膜血清型及毒力基因检测结果
103株CRKP菌株中有10株(9.7%,10/103)拉丝试验阳性,为高黏液表型,即CR-hvKP菌株。荚膜血清型分型结果显示,10株CR-hvKP菌株中,K1血清型4株(40.0%,4/10),未检出K2、K5、K20、K54、K57血清型;有4株菌携带全部10种毒力基因,fim-H和entB基因阳性10株(100%),ybts基因阳性8株(80.0%);5株NDM-5基因阳性,2株KPC-2基因,8株SHV基因,6株TEM基因,见表3。
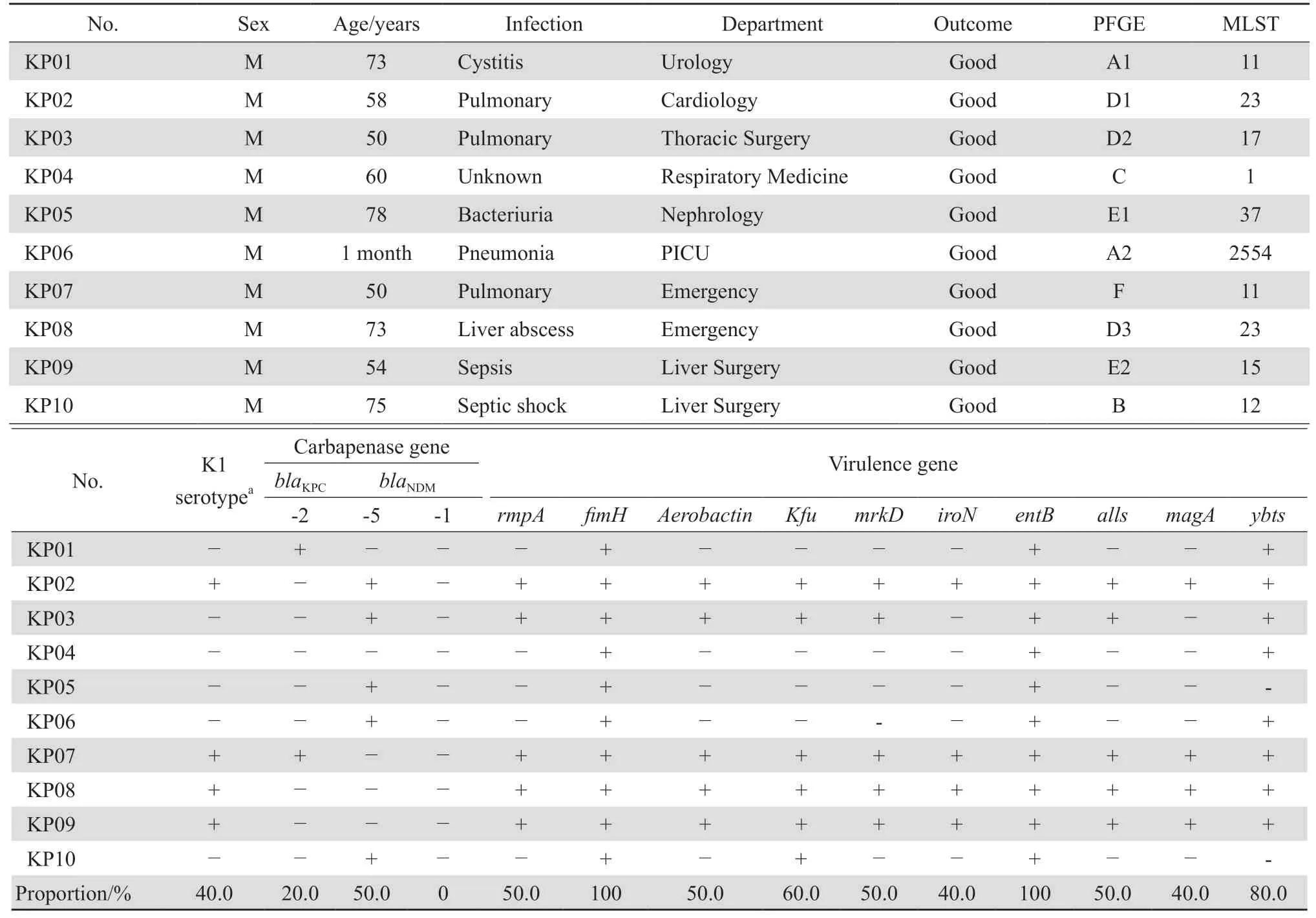
表3 10株拉丝试验阳性的CR-hvKP菌株PFGE、MLST荚膜血清型、碳青霉烯类耐药基因及毒力基因等检测结果Table 3 Prevalence of PFGE types, MLST types, K1 capsular serotype, carbapenem resistance genes, and virulence genes in 10 strains of carbapenem-resistant hypervirulent K. pneumoniae which were positive in string test
2.5 CR-hvKP的PFGE分析结果
10株CR-hvKP分为A~F 6种不同的克隆型,其中D型的3株(菌株编号2、3、8号)具有相似的图谱,亲缘性较高,该3株菌在检出科室、检出时间、标本类型方面均较为分散,未发现其暴发流行。其余7株分别为5种不同的克隆型(A、B、C、E、F型),见表3。
3 讨论
产碳青霉烯酶是CRKP菌株对β内酰胺类包括碳青霉烯类药物耐药的主要原因[18],这是对抗感染治疗的严重挑战。目前,临床上检测CRE耐药机制的常用方法是CLSI于2017年和2018年相继推出的mCIM和eCIM联合试验作为检测肠杆菌目细菌产碳青霉烯酶的确证试验[9]。本组资料显示,mCIM和eCIM联合对103株CRKP菌株的碳青霉烯酶检出率为91.3%(94/103),其中67.0%(63/94)产金属酶,33.0%(31/94)产丝氨酸碳青霉烯酶,提示我院的CRKP菌株大多产碳青霉烯酶,以金属酶为主;与同时进行的PCR检测法结果显示金属酶blaNDM碳青霉烯酶基因中检出率50.5%(52/103)为最高一致;blaKPC次之(33.0%,34/103)。测序比对结果显示,我院NDM基因存在两个亚型,NDM-5亚型为主(80.8%),NDM-1亚型次之(19.2%);KPC基因均为KPC-2型。即我院主要的碳青霉烯酶基因为NDM-5型,这与国内大部分地区报道的CRKP菌株中主要以产碳青霉烯酶基因型为KPC-2型不同[19-20],但与徐旋等[21]报道的银川地区碳青霉烯酶耐药基因以NDM为主相符。另有研究报道称,NDM-1型在印度[22]、新加坡[23]等国家是主要的碳青霉烯酶流行型,提示碳青霉烯酶基因具有明显的地区差异性。本研究中KPC基因的检出率仅次于NDM基因,表明KPC型酶也已经在我院流行传播。
本研究对103株CRKP菌株进行了MLST,共检出18种ST型别。结果显示我院优势型别为ST11型,主要以产KPC酶为主,这与我国产KPC酶的肺炎克雷伯菌主要流行型为ST11型相符[24]。结合病历资料发现,ST11型在神经外科、PICU、急诊科检出较多,但总体呈分散流行,ST76型主要检出时间集中于2019年4月至9月,主要集中于NICU,期间可能发生过一次暴发流行,医院可能采用了相关防治措施,9月之后未再有菌株暴发流行。这提示我们应当及时建立一种医院感染暴发预警系统,并有严格的手卫生和感染隔离措施,有研究表明通过严格的感染控制措施和医护人员教育能够成功控制菌株暴发感染[25]。
从103株CRKP菌株中筛选出10株高黏液表型菌株,检出率为9.7%,与俞凤[16]研究结果一致,但相较我国学者Guo等[26]报道肺炎克雷伯菌导致的侵袭性感染中有22.8%的hvKP以及韩国学者Jung等[27]报道的从菌血症患者中分离出的肺炎克雷伯菌有42.2%为hvKP来说明显较低,有待后续加大样本量进一步研究。
本研究显示103株CRKP中仅10株细菌为CR-hvKP菌株,具有拉丝试验阳性;碳青霉烯类耐药基因的携带以NDM-5为主,产NDM-5型酶;此结果与康海全[14]的研究结果,即CR-hvKP菌株的耐碳青霉烯类抗菌药物耐药的主要机制是产KPC-2型酶不同。目前荚膜血清型已报道了80多种的分型[28],常见的有K1、K2、K5、K20、K54和K57等,其中最常引起KLA的是K1和K2型。本研究结果显示,K1血清型检出4株,检出率为40.0%(4/10),与国内报道的23.8%的K1型和42.9%的K2型有所不同[26],需继续监测更多的样本来明确荚膜血清分型。
本研究显示10株CR-hvKP中分别被检出100%和60%的 菌 株 含fim-H基 因 和Kfu基 因,50%菌株还含有mrkD的基因。文献报道上述基因均与肺炎克雷伯菌入侵机体后细菌黏附机体的Ⅰ型和Ⅲ型菌毛有关,此被认为是细菌主要的黏附结构,如Ⅰ型菌毛(fim-H和Kfu基因)与泌尿道感染密切相关,Ⅲ型菌毛(mrkD)与细菌生物膜亲和性最好[29]。本研究中,fim-H基因和Kfu基因检出率较高,能够与机体内的含甘露糖的蛋白相结合,有助于在泌尿道形成生物膜并定植[15],这与Ⅰ型菌毛在肺炎克雷伯菌中普遍存在相一致。同时检测还发现肺炎克雷伯菌在宿主体内获取铁的方式即通过细菌自身的铁载体分泌相关基因ent-B和ybtS基因等有关;对10株CR-hvKP中ent-B和ybtS基因的检测,分别达100%和80%,如此高的检出率,与其他文献报道亦较一致[30]。
综上所述,本院临床分离的CRKP菌株对常见抗生素的耐药率均较高且多为MDR菌,其对碳青霉烯类的主要耐药机制是产NDM-5型金属酶,ST11型肺炎克雷伯菌为我院主要的流行克隆。9.7%的CR-hvKP菌株的检出率,提示我院已出现高毒力的碳青霉烯类耐药流行菌株,当引起临床和院感相关部门的重视,后续应扩大样本进一步探查传播来源及途径,防止暴发流行。
