黄芪活性成分抗肿瘤作用机制的研究进展
2022-12-08徐世一刘秀波陆佳欣张占平阎雪莹
徐世一,刘秀波,陆佳欣,张占平,阎雪莹*,马 伟*
黄芪活性成分抗肿瘤作用机制的研究进展
徐世一1, 3,刘秀波2,陆佳欣1,张占平1,阎雪莹1*,马 伟1, 3*
1. 黑龙江中医药大学药学院,黑龙江 哈尔滨 150040 2. 黑龙江中医药大学佳木斯学院,黑龙江 佳木斯 154007 3. 黑龙江中医药大学实验实训中心,黑龙江 哈尔滨 150040
恶性肿瘤的有效治疗一直是现代医学面临的难点问题。中医药在恶性肿瘤治疗方面的研究已经积累了较为丰厚的经验,不同中药的抗肿瘤机制也不尽相同。中医认为肿瘤即为“邪”,中医药抗肿瘤的主要思路就是“补气扶正”,黄芪被称为“补气诸药之最”,是肿瘤方剂中的常用药材。现代研究也证实了黄芪具有较强的抗肿瘤作用,其抗肿瘤有效成分主要有多糖、黄酮及皂苷类等成分。除此之外,黄芪与化疗药物联合应用可以起到增效减毒、增敏和逆转多药耐药等作用。黄芪通过调节免疫功能、影响细胞周期、促进细胞凋亡与新血管生成、抑制炎症反应和逆转多药耐药性等多种途径发挥抗肿瘤作用。黄芪多糖、芒柄花素、毛蕊异黄酮和黄芪甲苷IV等主要成分有着极大的研究与开发价值。总结近年来黄芪在抗肿瘤方面的相关研究成果,综述了黄芪活性成分的抗肿瘤作用和分子机制,为促进黄芪资源及其活性成分的开发利用提供依据,并为抗肿瘤新药研发提供参考。
黄芪;抗肿瘤;分子机制;黄芪多糖、芒柄花素、毛蕊异黄酮;黄芪甲苷IV
恶性肿瘤一直是困扰人类生命健康的重大疾病,肿瘤在发展过程中会充分利用肿瘤微环境和机体的细胞组织条件实现进一步的转移和扩散,恶性肿瘤的发生和发展常伴随着复杂的病机,如炎症和氧化应激、微环境和细胞扰动、肥胖和环境因素等都是导致恶性肿瘤的风险因素[1]。放化疗[2]和手术治疗虽然可以一定程度上遏制恶性肿瘤,但是也具有诱发多药耐药性(multidrug resistance,MDR)、骨髓抑制[3]、心脏损伤[4]及心理障碍的风险,同时也具有较高的复发风险,因此,针对恶性肿瘤的新治疗方案和新药物的研发显得尤为重要。
中医药疗法在肿瘤治疗中积累了丰富的经验,随着我国中医药研究的不断发展,针对具有抗肿瘤作用的中药、组方及其活性成分的研究已经获得了大量的成果。中医以扶正祛邪、攻补兼施为治则,注重兼顾标本[5],补气收涩类中药及组方常用于肿瘤的治疗[6-7],其中黄芪为益气固表的代表药物,李时珍在《本草纲目》中称其为“补药之长”。经现代医学研究表明黄芪中富含的黄芪多糖、黄酮类化合物和皂苷类化合物等活性成分可以有效抗肿瘤并抑制肿瘤的转移和扩散,其中黄芪多糖、芒柄花素、毛蕊异黄酮、黄芪甲苷、黄芪皂苷Ⅱ和Ⅲ是近年来报道较多且具有较强抗肿瘤活性的成分。另外,黄芪与其他药物联合使用可以提高抗肿瘤效果或降低毒性反应,如黄芪-贝伐单抗、黄芪-阿帕替尼、黄芪-多柔比星、黄芪-莪术、黄芪- 莪术-5-氟尿嘧啶、黄芪-莪术-蚤休角、黄芪-莪术-温郁金等。
本文通过查询整理国内外研究文献,对黄芪活性成分、黄芪与其他药物联合抗肿瘤及其分子机制进行总结,探讨黄芪在抗肿瘤方面的应用规律和思路,为黄芪资源的开发利用以及抗肿瘤临床疗法的研究提供理论参考。
1 黄芪活性成分抗肿瘤作用及分子机制
1.1 黄芪多糖
黄芪多糖是黄芪干燥根提取物中的主要活性成分,经研究表明黄芪多糖具有调节炎症级联反应[8]、治疗糖尿病及其并发症[9]、调节免疫[10]、抗肿瘤、保肝利胆[11]等多种作用。近年来大量实验成果证实,黄芪多糖可以通过多种机制抑制肿瘤细胞的增殖和转移。
1.1.1 调控细胞周期、促进肿瘤细胞的早期凋亡 该机制是抗肿瘤药物起效的重要机制。阎力君等[12]研究了黄芪多糖对结肠癌SW620细胞的作用,发现黄芪多糖可以有效促进细胞周期停滞在G2/M期,上调细胞色素C、半胱氨酸天冬氨酸蛋白酶-3(cysteine aspartase-3,Caspase-3)、Caspase-9和B淋巴细胞瘤-2相关X蛋白(B-cell lymphoma-2 associated X protein,Bax)的表达,下调pro-Caspase-9和、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)的表达,说明黄芪多糖可以通过调节细胞周期和控制线粒体途径诱导SW620细胞趋向早期凋亡。核因子-κB(nuclear factor-κB,NF-κB)是影响肿瘤周期和凋亡的重要转录因子,是一个进化高度保守且结构相关的转录因子家族的集体名称,在肿瘤的分化、生长、凋亡和转移等过程中发挥关键作用,Wu等[13]研究证实,黄芪多糖可以通过下调NF-κB通路抑制非小细胞肺癌A549和NCI-H358细胞的增殖,给予2个细胞株NF-κB激动剂可以减弱黄芪多糖对肿瘤细胞的抑制作用,相反给予NF-κB抑制剂可以增强黄芪多糖对肿瘤的抑制作用,充分证实了黄芪多糖与NF-κB相互作用的关联性。
1.1.2 提高免疫功能、抑制免疫反应 炎症及肿瘤微环境的抑制性免疫反应常伴随和诱导肿瘤细胞的增殖和转移,黄芪多糖可以通过提高免疫功能、抑制免疫反应[14-15]、刺激自然杀伤细胞和巨噬细胞发挥免疫作用、诱导肿瘤细胞自噬、降低局部炎症、调节肿瘤微环境等途径从而控制肿瘤的进一步发展。在直肠癌的增殖过程中炎性因子白细胞介素-17(interleukin-17,IL-17)及转化生长因子β1(transforming growth factor-β1,TGF-β1)可以通过促进局部炎症和肿瘤周围血管的生成建立一个适宜肿瘤细胞增殖的微环境,因此抑制IL-17和TGF-β1的水平可以有效控制肿瘤微环境的炎症以及新生血管的生成,从而改变肿瘤周围环境调节性T细胞(regulatory T cell,Treg)的功能,抑制肿瘤增殖、浸润和转移。赵媛媛等[16]从IL-17和TGF-β1入手,通过ELISA法检测直肠癌HCT-116移植瘤模型鼠ip黄芪多糖21 d后血清中IL-17和TGF-β1水平,结果证实黄芪多糖可以显著降低血清IL-17和TGF-β1的水平,以达到调节肿瘤动物模型免疫微环境的作用。Elham等[17]通过宫颈癌HeLa细胞共培养人外周血单个核细胞PBMCs探究黄芪多糖对肿瘤微环境的免疫调节作用,结果发现黄芪多糖可以促进与HeLa细胞共培养的PBMCs细胞的增殖,从而显著性降低IL-10和TGF-β的水平以调节免疫应答,达到抑制肿瘤细胞增殖的作用。Li等[18]为了证实黄芪多糖对人肝癌细胞微环境的Treg细胞功能的影响,在给予黄芪多糖后,研究组织样本中Treg细胞的典型标记物CD4、CD25和CD127的表达,分析了翅膀状螺旋转录因子(forkhead box P3,)mRNA的表达,检测细胞上清液中IL-4、IL-10、γ干扰素(interferon-γ,IFN-γ)和气孔细胞衍生因子- 1(stomal cell-derived factor-1,SDF-1)的含量,结果证实,黄芪多糖可以有效抑制CD4+CD25+Treg细胞,且这种抑制是通过降低肿瘤微环境中的表达来实现的,除此之外,黄芪多糖可能通过阻断SDF-1或其受体,通过趋化因子(C-X-C基元)受体4 [chemokine (C-X-C motif) receptor 4,CXCR4]/趋化因子(C-X-C基元)配体12 [chemokine (C-X-C motif) ligand 12,CXCL12]途径对Treg细胞迁移产生抑制作用,这说明黄芪多糖可以抑制Treg细胞的免疫抑制作用,从而抑制肿瘤的发展,提高肝癌的生存率。综上,黄芪多糖可以通过激活抗肿瘤相关的免疫细胞,促进肿瘤微环境的厌氧代谢,恢复肿瘤微环境中细胞因子平衡从而调节免疫功能、抑制肿瘤细胞增殖[19-20]。
1.1.3 逆转或逃逸多药耐药(multiple drug resistance,MDR) 在接受化疗的癌症患者中,大部分治疗失败和死亡病例都是由于MDR[21],因此现代医药学研究更多地聚焦于能够逆转或逃逸MDR的药物,实验证实黄芪多糖不仅可以提高肿瘤对化疗药物的响应达到逆转MDR的作用,同时也可以降低化疗药物引发的毒性反应[22-23]。黄芪多糖可以通过抑制TGF-β1过表达介导的上皮-间质转化,从而抑制过表达的耐顺铂A549细胞移植瘤的增殖[24]。Song等[25]通过体外实验证实,黄芪多糖不仅可以独立诱导胃癌GC细胞凋亡,还可以增强阿霉素对GC细胞的促凋亡作用,这说明黄芪多糖可以一定程度起到化疗增敏的作用。除此之外,对于耐药性较高的HL-60/A细胞株,黄芪多糖可以诱导HL-60/A细胞凋亡和Caspase级联激活,显著性降低多药耐药相关蛋白(multi-drug resistant associate protein,MRP)的表达,增加胞内药物浓度[26]。黄芪多糖还可以提高肿瘤细胞对阿帕替尼等化疗药物的敏感型,从而逃逸MDR、提高抗肿瘤作用[27-28]。
黄芪多糖抗肿瘤作用机制见表1。
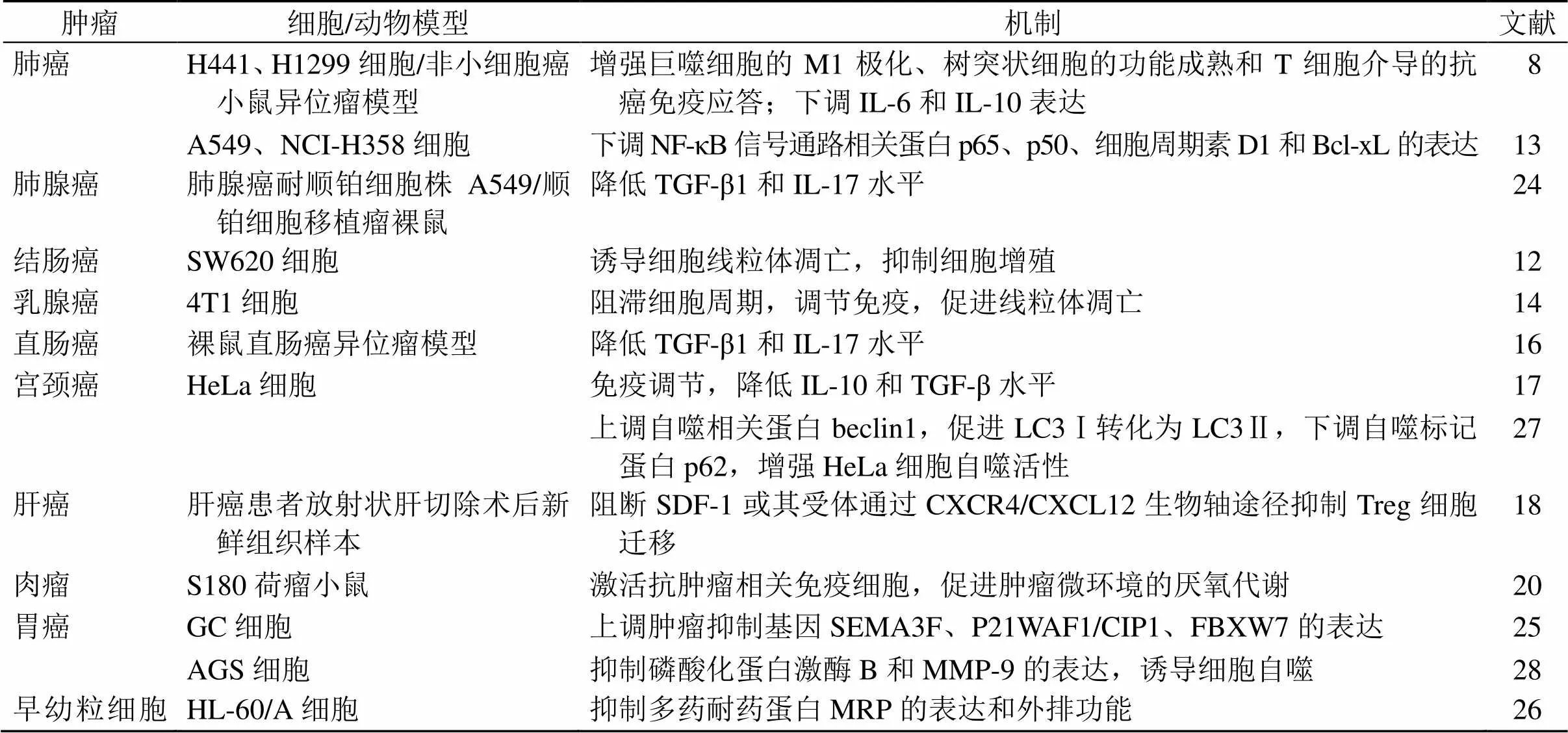
表1 黄芪多糖抗肿瘤作用及机制
Bcl-xL-B淋巴细胞瘤-xL SEMA3F-臂板蛋白3F抗体 CIP1-周期蛋白依赖性激酶相互作用蛋白1 WAF1-宽型53激活因子1 FBXW7-重组F-Box和WD重复结构域蛋白7 MMP-9-基质金属蛋白酶-9
Bcl-xL-B cell lymphoma-xL SEMA3F-semaphorin 3F CIP1-cyclin-dependent kinase interacting protein 1 WAF1- Wide-type 53-activated factor 1 FBXW7-recombinant F-Box and WD repeat domain containing protein 7 MMP-9-matrix metallopeptidase-9
1.2 黄酮类成分
近年来研究证实黄芪总黄酮单独给药或与顺铂联合应用可以有效抑制肺癌细胞、肝癌细胞、红白血病细胞和喉鳞癌细胞等肿瘤细胞的增殖和转移[29-31],且黄芪黄酮类成分芒柄花素(formononetin)、毛蕊异黄酮(calycosin)、毛蕊异黄酮-7β吡喃葡萄糖苷、芒柄花素-7β吡喃葡萄糖苷、华良姜素等都具有一定的抗肿瘤活性,其中芒柄花素和毛蕊异黄酮是近年来报道较多的、具有显著抗肿瘤活性且分子机制研究较为深入的成分。
1.2.1 芒柄花素 近年来,芒柄花素的抗肿瘤活性已经得到大量研究成果证实,Jiang等[32]综合分析了芒柄花素针对的肿瘤类型及相关通路,除此之外,最近的研究发现了更多芒柄花素抑制肿瘤的相关分子机制,本文对其进行了分类整理,如图1所示。
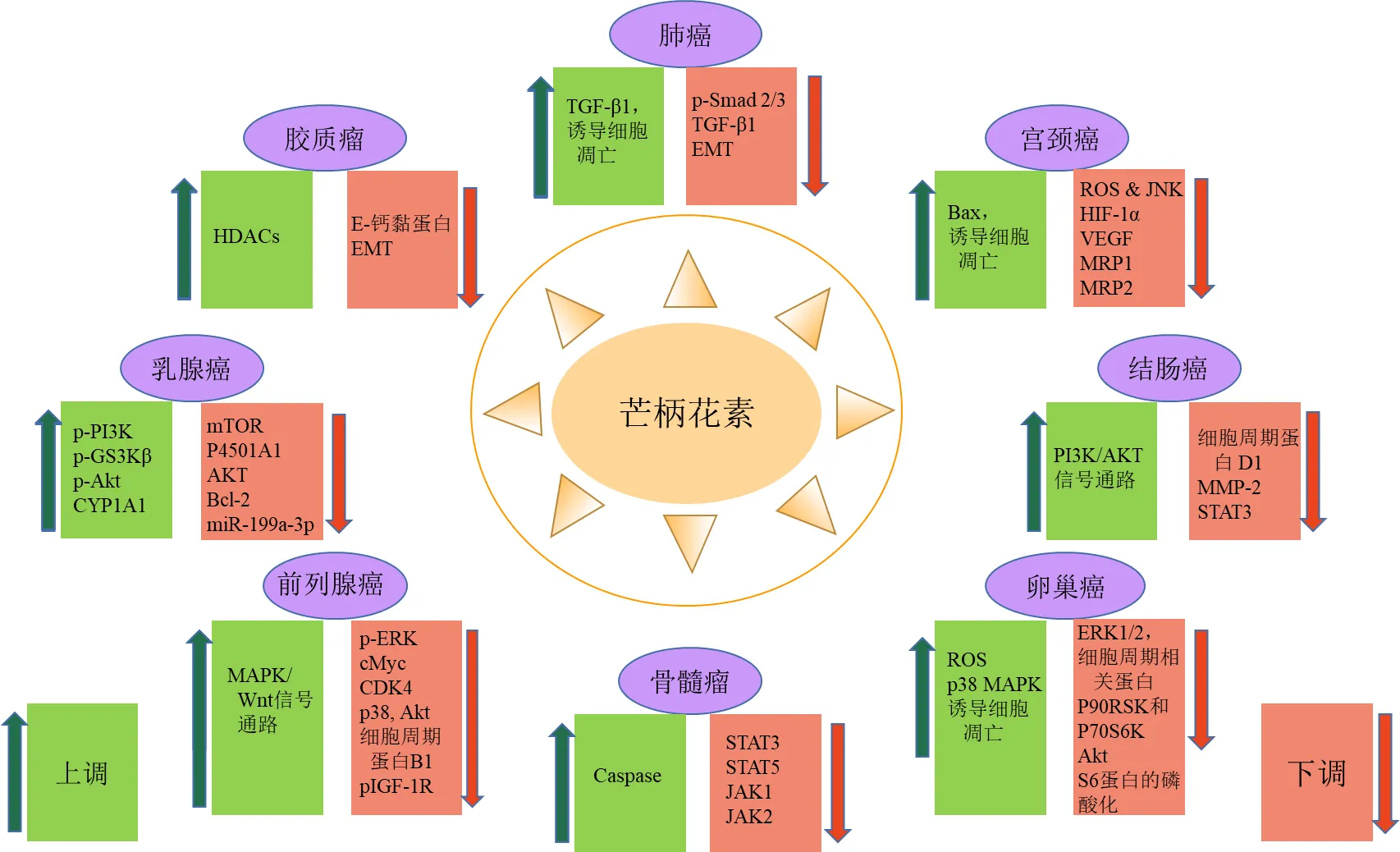
HDACs-组蛋白去乙酰化酶 ROS & JNK-活性氧介导的c-Jun N端激酶通路 HIF-1α-缺氧诱导因子1α VEGF-血管内皮生长因子 PI3K-磷脂酰肌醇3-激酶 Akt-蛋白激酶B STAT-信号传导与转录激活因子 ERK1/2-细胞外调节蛋白激酶1/2 MAPK-丝裂原活化蛋白激酶 JAK-两面神激酶 p-ERK-磷酸化激活的细胞外调节蛋白激酶 CDK4-细胞周期蛋白依赖性激酶4 p-GS3Kβ-磷酸化葡萄糖合成激酶3β抗体 CYP1A1-细胞色素P4501A1 P70S6K-磷酸化70S6激酶 P90RSK-磷酸化90RS激酶
芒柄花素可以通过多种途径影响细胞周期和促进肿瘤细胞凋亡。Park等[33]研究了芒柄花素针对卵巢癌ES2和OV90细胞的毒理作用和机制,研究结果表明芒柄花素可以通过阻滞细胞周期在G0/G1期促进卵巢癌细胞的凋亡,涉及的相关机制包括ERK1/2、P90RSK、Akt、P70S6K蛋白和核糖体蛋白S6的磷酸化降低,以及ES2和OV90细胞中p38蛋白的磷酸化增加,该研究成果还证实了芒柄花素可作用于卵巢癌细胞线粒体,使其膜电位丧失从而抑制活性氧的产生,同时芒柄花素联合药理抑制剂(LY294002或U0126)可以协同抑制2种乳腺癌细胞的增殖,使抗肿瘤作用增强。Huang等[34]探究了芒柄花素对雄激素非依赖性前列腺癌的促凋亡作用是否与胰岛素样生长因子-1(insulin-like growth factor,IGF-1)/ IGF-1受体(IGF-1R)信号通路相关,结果证实,当芒柄花素的浓度大于12.5 μmol/L时对PC-3细胞具有显著性的抑制作用,并且其对Bax的上调作用和对pIGF-1R蛋白的下调作用呈剂量相关性,这说明芒柄花素可以通过抑制IGF-1与IGF-1R的结合最终导致对肿瘤细胞的增殖抑制。Li等[35]从细胞周期阻滞机制方向入手探究芒柄花素抑制前列腺癌PC-3细胞的机制,结果表明芒柄花素可以导致PC-3细胞周期显著性停滞于G1期,并使其Akt磷酸化的水平降低,芒柄花素以剂量相关性的方式显著性下调细胞周期蛋白D1和CDK4的表达水平,最终抑制PC-3细胞的增殖。
芒柄花素可以调节肿瘤微环境,抑制肿瘤新生血管和转移。Zhang等[36]通过宫颈癌裸鼠模型研究芒柄花素的体内抑瘤效果以及对肿瘤组织中HIF-1α和VEGF蛋白质和mRNA表达的影响,在体内实验过程中发现顺铂组抑瘤率为56.24%,芒柄花素组抑瘤率为50.17%,但是顺铂组鼠出现了明显的食欲下降和情绪低落不良反应,而芒柄花素组鼠生存状态良好,并且芒柄花素组与阳性对照组相比肿瘤组织中HIF-1α和VEGF的蛋白质和mRNA表达水平显著降低(<0.05),这项结果证实芒柄花素可能通过抑制HIF-1α和VEGF的表达,降低缺氧的肿瘤微环境中细胞氧的稳定性和耐缺氧能力,并且抑制肿瘤血管新生,从而达到抑制宫颈癌的作用,抑制效果虽较弱于顺铂,但是模型鼠不良反应小。
芒柄花素可以通过调控肿瘤标志基因,从而抑制肿瘤发展和转移。Wang等[37]通过体内实验证明芒柄花素可以有效抑制胃癌SGC-7901和MGC-803细胞系的生长和转移,显著上调标志性癌基因的表达,同时Wu等[38]发现芒柄花素可以通过调节介导的人第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homologue deleted on chromosome ten,PTEN)/Akt通路抑制人膀胱癌细胞的增殖和转移,类似针对和这类肿瘤标志基因的研究近年来逐渐增多,这类分子机制研究的开展对促进抗肿瘤药物的发现、药效学监控以及抗肿瘤机制的研究具有重要的意义。
芒柄花素也是一种优良的MDR逆转剂。Li等[39]研究表明,芒柄花素可以通过抑制使其下游靶点哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)恢复至亲代水平,从而抑制紫杉醇耐药的MDAMB-231细胞自噬,达到逆转MDR抑制乳腺癌增殖的作用,因此芒柄花素与紫杉醇联合抗乳腺癌可以减少耐药导致的化疗失败,且该项实验证实联合治疗组抗肿瘤作用更为显著。除了与紫杉醇联用外,芒柄花素还可以与表柔比星联用提高对宫颈癌HeLa细胞的抑制作用,其机制是通过增加活性氧的水平,降低MDR相关基因和的表达水平实现的,同时芒柄花素激活了线粒体和死亡受体凋亡途径,增强了表柔比星对HeLa细胞的抑制作用[40]。
1.2.2 毛蕊异黄酮 毛蕊异黄酮对乳腺癌、直肠癌、宫颈癌、甲状腺癌以及肝癌等多种恶性肿瘤均有较强的抑制作用,如图2所示。本文对毛蕊异黄酮针对的肿瘤及相关通路进行了整理,结果发现毛蕊异黄酮发挥抗肿瘤作用通路涉及细胞凋亡、细胞周期、自噬、免疫以及炎症等多个方面。
毛蕊异黄酮针对众多女性高发肿瘤均表现出了显著的抑制效果,如毛蕊异黄酮可以通过促进转录因子TFEB核转位细胞自噬途径抑制甲状腺癌TPC-1细胞增殖,且这种抑制作用呈现明显的剂量相关性[41]。Tian等[42]通过研究发现毛蕊异黄酮可通过miR-375-ERα反馈环失活介导雌激素受体阳性ER+(MCF-7和T47D)乳腺癌细胞增殖受到抑制;lncRNAs微阵列结果证实毛蕊异黄酮可以通过上调长链非编码RNA(lncRNA)WDR7-7的表达抑制雌激素受体阴性ER−(MDA-MB-468和SKBR3)和ER+(MCF-7和T47D)乳腺癌细胞增殖,除此之外,毛蕊异黄酮还上调了TTC21B-AS1和CTA-384D8这2种lncRNA的表达,但是WDR7-7的平均增长率最高,WDR7-7是G蛋白偶联雌激素受体30(G protein conjugated estrogen receptor 30,GPR30)的靶点,GPR30可以被雌激素激活在雌激素相关肿瘤如乳腺癌、宫颈癌和卵巢癌等恶性肿瘤的发生发展中发挥重要作用,在ER−和ER+乳腺癌中WDR7-7和GPR30均呈现负相关,因此WDR7-7和GPR30可能与传统的雌激素受体共同发挥作用参与毛蕊异黄酮抑制乳腺癌肿瘤的过程。Zhang等[43]发现毛蕊异黄酮可以显著性上调宫颈癌细胞的肿瘤抑制因子并增加乳酸脱氢酶(lactate dehydrogenase,LDH)的释放,敲除基因可以显著逆转毛蕊异黄酮对宫颈癌细胞的抑制作用,因此基因有可能成为毛蕊异黄酮治疗宫颈癌疗效判断的重要标志物。
在众多关于毛蕊异黄酮抗肿瘤作用的探讨中,Zhang等[44]提出了毛蕊异黄酮在胰腺癌的发生发展中存在双重作用的理论,实验结果表明一方面毛蕊异黄酮可以通过调节p21宽型53激活因子1(wide- type 53-activated factor 1,Waf1)/周期蛋白依赖性激酶相互作用蛋白1(cyclin-dependent kinase interacting protein 1,Cip1)通路促进细胞周期停滞,以及诱导Caspase依赖性凋亡达到抑制MIA PaCa-2细胞增殖的效果,另一方面毛蕊异黄酮可导致Ras效应蛋白(Ras effector protein,Raf)/丝裂原活化蛋白(mitogen-activated protein,MEK)/细胞外调节蛋白激酶(extracellular signal- regulated kinase,ERK)通路的激活并促进肿瘤微环境中M2肿瘤相关巨噬细胞的极化,这反而会使其具备促进肿瘤细胞转移和侵袭的潜能,这种双重作用与毛蕊异黄酮上调TGF-β1的表达有关,因为在胰腺癌的发展过程中TGF-β1可以作为肿瘤抑制因子和肿瘤启动子发挥双重作用。
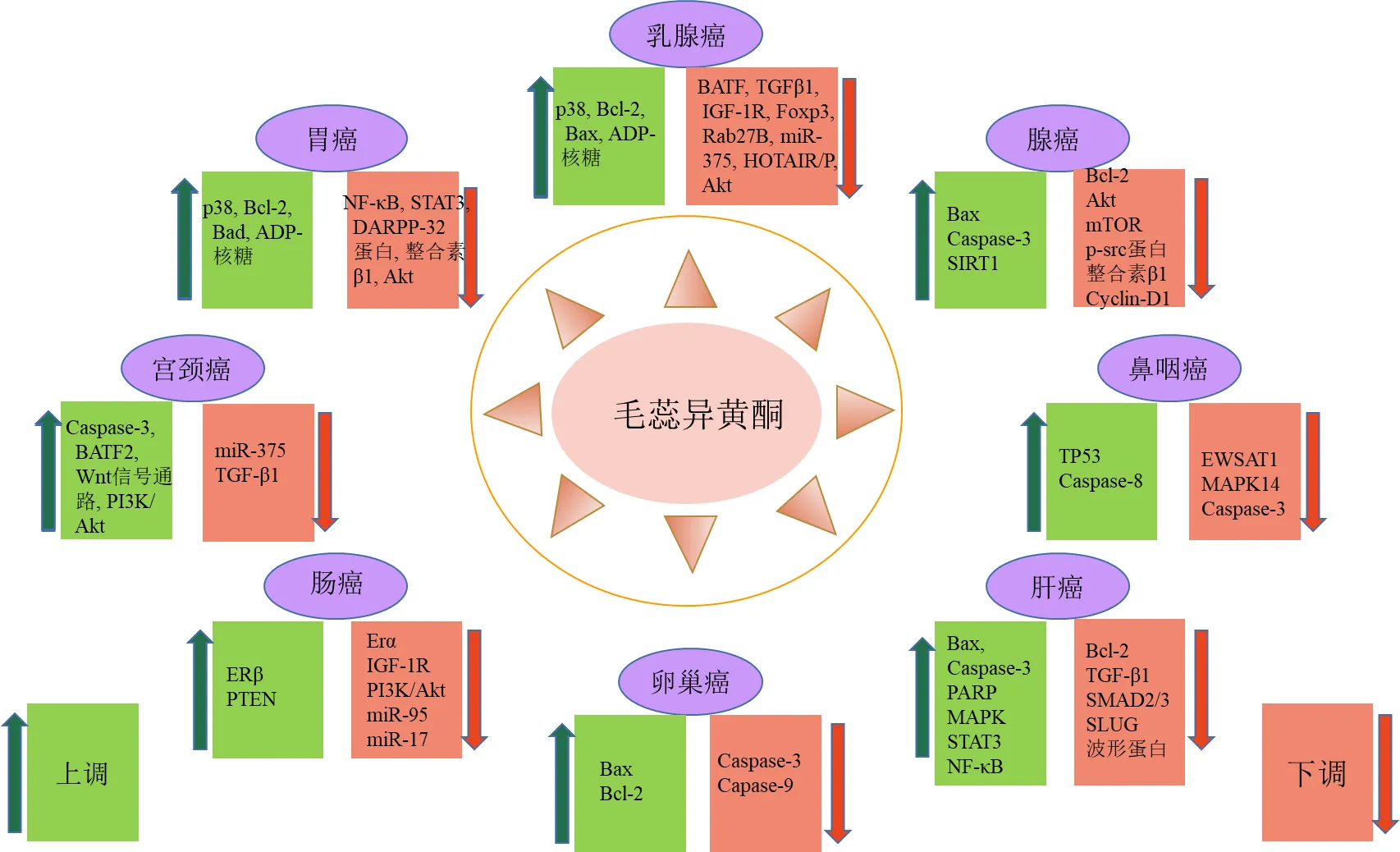
FOXP3-叉头框蛋白P3 PARP-聚ADP核糖聚合酶 BATF2-碱性亮氨酸拉链转录因子ATF样2 SMAD2/3-重组人SMAD家族成员2和3 SLUG-上皮细胞-间质转化过程中的调控因子 EWSAT1-Ewing肉瘤相关转录物1的lncRNA Erβ-雌激素β受体 DARPP-32-多巴胺和cAMP调节的磷蛋白 HOTAIR/P-HOX转录反义RNA Rab27B-RAS癌基因家族成员 SIRT1-NAD-依赖性去乙酰化酶 Bad-Bcl-2细胞死亡相关启动子
毛蕊异黄酮还可通过调节肿瘤相关基因的表达,发挥抑制细胞活力、促进凋亡并降低转移能力的作用。Tan等[45]通过人骨肉瘤样本及动物实验研究,发现毛蕊异黄酮可以通过上调Caspase-3和肿瘤蛋白53(tumor Protein p53,TP53)的表达,下调X连锁凋亡抑制蛋白(X-linked inhibtor of apoptosis protein,XIAP)的表达从而抑制骨肉瘤的发展和转移,Caspase-3是经典的细胞死亡蛋白酶,一旦受到抑制会导致细胞增殖、转移和侵袭能力增强,TP53参与了细胞生长、存活、DNA稳定性和细胞保护的相关调节过程,而XIAP的表达缺陷是导致多种恶性肿瘤的原因之一,因此毛蕊异黄酮可以通过控制多个肿瘤相关蛋白的表达抑制骨肉瘤的增殖和转移。
1.3 黄芪皂苷类成分
黄芪甲苷IV[46-47]、黄芪皂苷Ⅱ和III是黄芪皂苷类成分中已被证实的抗肿瘤有效成分。黄芪皂苷类成分发挥抗肿瘤作用的路径包括诱导凋亡、调控细胞周期、逆转MDR和调控免疫等。
在调控细胞周期、逆转和逃逸MDR方面,Zheng等[48]研究了黄芪甲苷IV提高乳腺癌对紫杉醇敏感性方面的作用效果和分子机制,实验结果表明黄芪甲苷IV可以提高MCF-7和MDA-MB-231细胞以及非肿瘤乳腺上皮细胞系MCF-10A对紫杉醇的敏感性,使其促细胞凋亡和阻滞G2/M细胞期作用增强,同时黄芪甲苷IV可以通过抑制小窝蛋白-1(caveolin-1,CAV-1)触发内皮型一氧化氮合酶(recombinant endothelial NOS,eNOS)/NO/过氧亚硝基阴离子(ONOO−)途径,导致肿瘤细胞发生严重的氧化损伤,同时其还可以提高细胞对紫杉醇的敏感性。G2/M期是细胞周期一个关键的过渡点,该细胞周期的阻滞提示肿瘤细胞DNA可能受损无法进入下一个周期,而CAV-1是一种应激相关的肿瘤靶点,已经证实其与化疗耐药性密切相关,因此,黄芪甲苷IV可以通过阻滞细胞周期和逃逸耐药达到抑制肿瘤的作用,CAV-1也可以作为黄芪甲苷IV相关抗肿瘤制剂设计的参考靶点之一。王晓玲等[46]研究了黄芪甲苷IV对小鼠淋巴细胞白血病顺铂耐药细胞株L1210/DDP的作用效果和分子机制,细胞抑制实验结果证实联合黄芪甲苷IV可以显著提高肿瘤增殖抑制率,由8.83%升高至16.74%,且活性氧水平呈下降趋势,还可以阻滞细胞在S期和G2/M期,机制研究结果证实黄芪甲苷IV是通过调节p62-核因子红细胞样2相关因子2(NF-E2-related factor 2,Nrf2)通路相关基因,降低了L1210/DDP细胞的氧自由基水平,从而提高其对顺铂的敏感性。岳贵娟等[49]通过转录组学技术证实了黄芪甲苷可以通过调控Wnt和MAPK信号通路逆转阿霉素耐药。
在调节免疫方面,黄芪皂苷类成分已被证实可以有效调节免疫应答、抑制免疫逃避及诱导巨噬细胞极化,吲哚胺2,3-双加氧酶(recombinant indoleamine-2,3-dioxygenase,IDO)诱导的非小细胞肺癌免疫耐受可被黄芪甲苷IV逆转,黄芪甲苷IV可以通过抑制IDO从而抑制Tregs细胞的表达活性,提高细胞毒性T淋巴细胞活性,调节受损的T淋巴细胞功能,影响非小细胞肺癌的免疫逃逸[50]。研究证实[51]黄芪甲苷也具有增强免疫应答、抑制肺癌细胞增殖和转移的功能,其途径是通过抑制免疫球蛋白样转录子4(immunoglobulin like transcript,ILT4)-PI3K/Akt-B7-H3通路的表达,同时黄芪甲苷可以通过诱导M1型巨噬细胞极化启动免疫应答从而抑制肿瘤细胞增殖[52]。王敏等[53]建立了H22荷瘤小鼠模型用以评价黄芪皂苷II对脾淋巴细胞Th1细胞相关因子的转录水平以及对Th1和Tregs细胞增殖的影响,实验结果表明黄芪皂苷II可以促进Th1细胞因子释放,激活核转录因子,增强抗肿瘤的免疫反应,从而抑制模型小鼠体内肝癌H22细胞的增殖。Chen等[54]研究证实,黄芪皂苷III可以通过刺激系统免疫调节自然杀伤细胞来抑制结肠癌的发展。黄芪皂苷类成分针对不同肿瘤的作用机制通路,具有深入研究的价值,且明确机制将有利于促进黄芪皂苷类成分的临床应用,为抗肿瘤治疗提供新思路。
黄芪皂苷类成分抗肿瘤作用机制见表2。
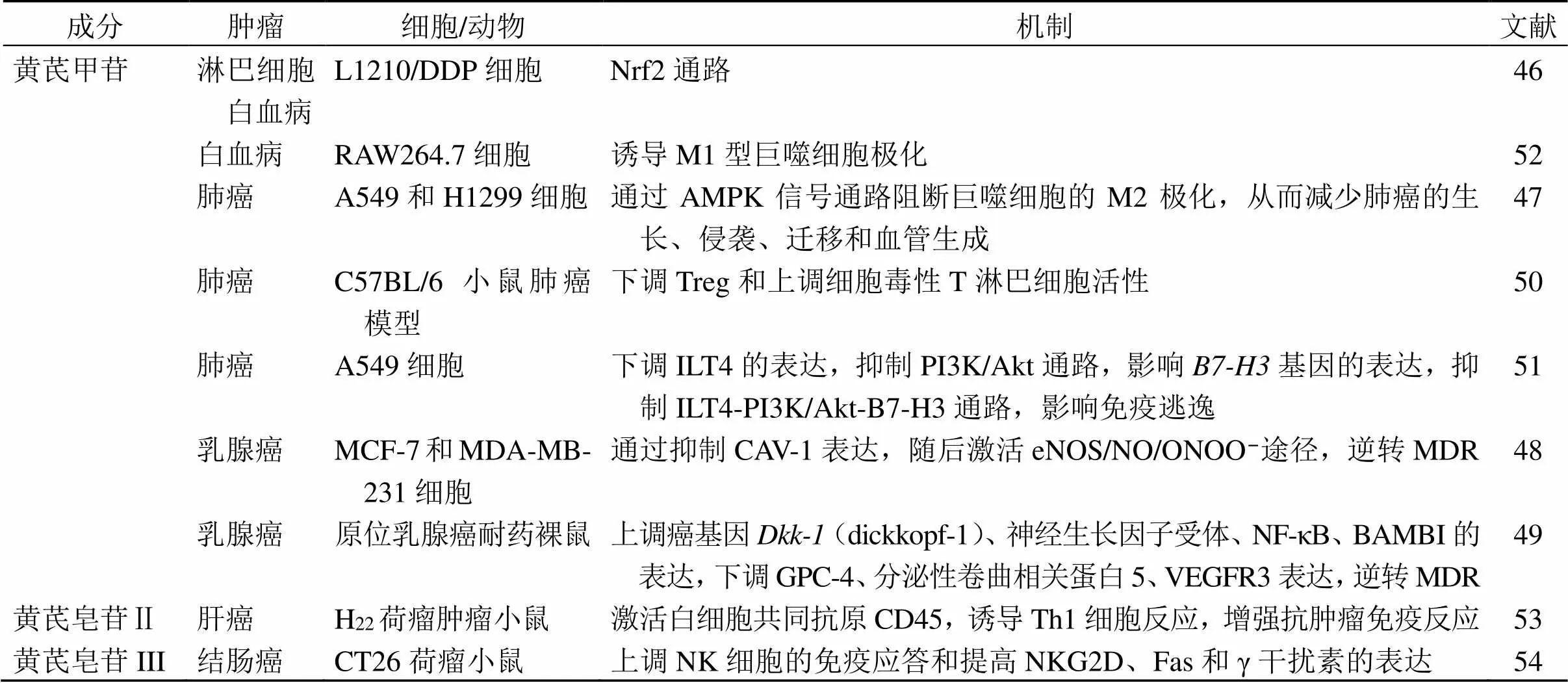
表2 黄芪皂苷类成分抗肿瘤作用及机制
BAMB-骨形态发生蛋白及激活素胞膜绑定抑制因子 GPC-4-磷脂酰肌醇蛋白聚糖-4 VEGFR3-血管内皮生长因子受体3 NKG2D-NK细胞的活化型受体 Fas-TNF受体超族成员6 AMPK-腺苷酸活化蛋白激酶 B7-H3-免疫调节蛋白基因
BAMBI-bone morphogenetic protein and activin membrane-bound inhibitor GPC-4-recombinant mouse glypican-4 VEGFR3-vascular endothelial growth factor receptor 3 NKG2D-natural killer group 2 member D Fas-TNF receptor superfamily member 6 AMPK-adenosine monophosphate activated protein kinase B7-H3-B7 homolog 3
2 黄芪与其他药物联合应用抗肿瘤
2.1 黄芪联合化疗方案抗肿瘤
多项研究表明黄芪或其有效成分与化疗药物联合应用在抗肿瘤治疗过程中可以发挥增效减毒的作用。紫杉醇在抗肿瘤治疗过程中有效剂量较高、毒性较大,为了提高其抗肿瘤作用,降低不良反应,研究人员将黄芪甲苷IV与紫杉醇联用,研究表明二者通过调节STAT3-NF-κB途径提高了对胃癌细胞的抑制作用,抑制该通路还可以降低肿瘤细胞对顺铂的耐药性[55]。Qu等[56]研究证实了黄芪甲苷IV可以提高HepG2细胞和H22荷瘤小鼠对顺铂的敏感性,抑制MDR相关蛋白MRP2的表达,除此之外,黄芪甲苷IV与顺铂联用还可以降低顺铂造成的肝肾损伤[57]。张之蕙等[58]为了证实黄芪可以缓解贝伐单抗、奥沙利铂和卡培他滨联合方案在转移性结肠癌治疗过程中产生的不良反应,以2017—2021年收治的70例转移性结肠癌患者为研究对象,探究黄芪与贝伐单抗联合疗法对老年转移性结肠癌的临床治疗效果及对肿瘤标志物的影响,70例患者随机数字法分为对照组(贝伐单抗联合疗法)和治疗组(黄芪颗粒+贝伐单抗联合疗法),结果表明黄芪颗粒可改善贝伐单抗联合疗法产生的胃肠道不适和免疫功能受损,且治疗组下调血清基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase-1,TIMP-1)、MMP-7和p53抗体的表达较对照组显著增强。为了证实黄芪多糖可以减轻紫杉醇导致的免疫损伤,Bao等[59]分别进行了体内外研究,在接种乳腺癌细胞(4T1)的BALB/c小鼠模型和共培养细胞模型中验证该假设,体外实验证实黄芪多糖可以抑制紫杉醇对小鼠单核巨噬细胞RAW 264.7的毒性和细胞周期抑制作用,黄芪多糖可以逆转紫杉醇诱导的磷酸化组蛋白(phospho-histone H2A,P-H2A)、PARP、细胞周期检测点激酶1(checkpoint kinase 1,Chk1)、p53和p21的蛋白水平上调,以及Bcl-xL和髓样细胞白血病-1(myeloid cell leukemin-1,Mcl-1)蛋白水平下调,但是不影响紫杉醇对4T1细胞的抑制作用,这说明黄芪多糖可以选择性影响紫杉醇对免疫细胞的作用,同时体内研究结果发现黄芪多糖联合紫杉醇可以有效延长模型鼠的生存时间。黄芪多糖还可与阿帕替尼配伍通过抑制MMP-9及p-Akt蛋白表达增强抗肿瘤作用[60],黄芪、黄芪甲苷、黄芪多糖与多柔比星配伍可缓解心脏毒性[61]、逆转MDR[62]、提高抗肿瘤效果。上述实验结果说明,黄芪及其抗肿瘤成分与化疗药物联合疗法在基础研究和临床观察中都表现出了一定的优势,但是其增效减毒的机制还需继续挖掘。
2.2 黄芪与其他中药配伍抗肿瘤
总结近年来黄芪抗肿瘤的配伍规律,笔者发现其主要思路是通过活血化瘀、补中益气。除此之外,中药配伍疗法还兼顾调节免疫、抗炎性反应等多个方面,其中报道较多的黄芪与莪术配伍可有效抑制结肠癌转移和增殖,黄芪-莪术配伍可补气破瘀、扶正祛邪、利水消积,黄芪-莪术、黄芪-莪术-重楼[63]配伍均可以抑制结肠癌组织的生长,主要机制是通过降低血管内皮通透性抑制结肠癌转移、调节SDF-1/CXCR4/NF-κB信号通路相关蛋白表达等途径,但是抑制效果较5-氟尿嘧啶弱[64-65]。为提高抗肿瘤效果,研究人员将中药组方与5-氟尿嘧啶组合,探究其抗肿瘤效果和机制,梁立等[66]建立了CT26.WT原位移植瘤小鼠模型,证实黄芪-莪术与5-氟尿嘧啶联合可能通过下调CXCL10/CXCR3轴、趋化因子配体L3(chemokine ligand 3,CCL3)/趋化因子C-C-基元受体5(recombinant chemokine C-C-motif receptor 5,CCR5)轴的表达增强抗结肠癌的功效,但是药物最佳配比仍需进一步探究。郭文晖等[67]研究发现黄芪-莪术联合5-氟尿嘧啶在异位移植瘤小鼠模型体内表现出了较单独使用化疗药物更加优良的抗肿瘤效果,而且5-氟尿嘧啶联合高剂量黄芪-莪术组的平均瘤质量下降最明显,机制研究结果表明联合疗法可以促进细胞凋亡、调节肿瘤微环境免疫抑制、抑制上皮间质转化和炎症因子,使模型小鼠脾组织中CD4+IL-17+细胞比例下降,CD4+Foxp3+细胞比例升高,维持体内Th17/Treg的动态平衡。除此之外,黄芪-莪术-蚤休角[68]组方配伍对结肠癌的抑制作用也在动物模型中证实。但是基于实验结果不难发现,在结肠癌的治疗过程中,中药的效果较弱于化疗药物,因此,中药与化疗药物联合疗法是值得深入研究的。
黄芪-当归在中药组方中较为常见且具有较高的抗肿瘤应用价值,Wu等[69]研究了黄芪-当归配伍对肺癌的抑制作用,通过雄性转基因C57BL/6小鼠和CAnN.Cg-Foxn1nu裸鼠的Lewis肺癌模型,考察口服不同剂量组合的黄芪和当归水提物对肺癌的抑制作用,并研究其可能的分子机制,发现黄芪、当归在单独作用于肺癌LLC细胞时即使质量浓度高于100 mg/mL其细胞抑制率依然低于50%,但是黄芪+当归可以有效提高LPS诱导的RAW264.7细胞的吞噬作用,作用效果在黄芪-当归比例为5∶1时达到平台水平。在体内实验中发现黄芪+当归对C57/BL6小鼠模型具有更强的抗氧化和抗炎作用,可以通过调节T细胞免疫达到抑制肿瘤相关的炎症和氧化反应,中药联合应用还可下调肿瘤微环境中NF-κΒ、STAT3、HIF-1α和VEGF的表达,且这些结果并未在CAnN.Cg-Foxn1nu裸鼠模型中体现,这说明虽然黄芪+当归抗肿瘤效果并不理想,但是可以其抗炎和调节免疫微环境的作用在抗肿瘤辅助治疗中发挥关键作用。除以上配伍组方外,黄芪-白术[70]和黄芪-白花蛇舌草[71]也被证实具有一定的抗肿瘤效果。
以上研究说明黄芪与其他中药的配伍以及联合化疗药物可以更大程度发挥抗肿瘤作用,但是组方的剂量、配伍的中药选择、起效的机制和对各种类型肿瘤的作用特点等相关研究工作还需继续开展。
3 结语和展望
总结大量研究结果发现,黄芪作为补中益气的常用药材,其主要活性成分黄芪多糖、皂苷类和黄酮类化合物可以有效抑制胃癌、肝癌、结肠癌、肺癌等多种恶性肿瘤。黄芪及其联合疗法的抗肿瘤机制主要包括:①诱导肿瘤细胞早期凋亡;②阻滞细胞周期;③调节机体及肿瘤微环境的免疫系统;④抑制肿瘤细胞转移及血管新生;⑤逆转MDR、提高肿瘤组织对化疗药物的敏感型;⑥诱导肿瘤细胞自噬等。随着黄芪抗肿瘤的分子机制不断被揭示,中药的多靶点、多环节和多层次的起效机制特点也逐渐显现。但是在黄芪及其成分抗肿瘤研究中,除了分子机制研究外,针对其基因标志物的相关研究仍然需要深入开展,这对疗效监测以及靶向制剂的研发工作具有重要的意义。
同时,笔者也认为黄芪及其活性成分作为化疗增敏剂与化疗药物联合应用是黄芪抗肿瘤研究的关键切入点,药物联合治疗方案可以从多个通路发挥增效减毒、逆转MDR以及调节免疫微环境的作用,但是要想发挥更佳的效果,联合疗法中黄芪与其他药物的配比需要深入探索,联合配比可能会因为肿瘤类别的不同而有所差别,那么在给药方案的差异化设计上则需要丰富的随机临床试验结果作为支撑。总体来说,黄芪在抗肿瘤领域发挥的作用需大量的科研结论作为理论依据和指导,因此继续深入开展黄芪及其成分抗肿瘤活性的相关研究对促进黄芪资源的开发利用、抗肿瘤新药的研发以及临床用药具有重要的指导意义。
利益冲突 所有作者均声明不存在利益冲突
[1] Avgerinos K I, Spyrou N, Mantzoros C S,. Obesity and cancer risk: Emerging biological mechanisms and perspectives [J]., 2019, 92: 121-135.
[2] Rallis K S, Lai Yau T H, Sideris M. Chemoradiotherapy in cancer treatment: Rationale and clinical applications [J]., 2021, 41(1): 1-7.
[3] Kogo M, Watahiki M, Sunaga T,. Analysis of the risk factors for myelosuppression after chemoradiotherapy involving 5-fluorouracil and platinum for patients with esophageal cancer [J]., 2011, 58(107/108): 802-808.
[4] Mei S B, Hong L, Cai X Y,. Oxidative stress injury in doxorubicin-induced cardiotoxicity [J]., 2019, 307: 41-48.
[5] 谢丹枫, 王能, 陈紫莹, 等. 基于数据挖掘的国家名老中医抗肿瘤用药规律及核心复方解析 [J]. 世界中医药, 2020, 15(18): 2726-2734.
[6] Gong J E, Kim J E, Lee S J,. Anti-cancer effects of α-cubebenoate derived fromin CT26 colon cancer cells [J]., 2022, 27(3): 737.
[7] 向璐, 张巧艳, 赵琦明, 等. 黄芪-当归化学成分、药理作用及临床应用的研究进展 [J]. 中草药, 2022, 53(7): 2196-2213.
[8] Bamodu O A, Kuo K T, Wang C H,.polysaccharides (PG2) enhances the M1 polarization of macrophages, functional maturation of dendritic cells, and T cell-mediated anticancer immune responses in patients with lung cancer [J]., 2019, 11(10): 2264.
[9] Zhang Z X, Zhang L, Xu H S. Effect ofpolysaccharide in treatment of diabetes mellitus: A narrative review [J]., 2019, 39(1): 133-138.
[10] Feng S B, Ding H Y, Liu L H,.polysaccharide enhances the immune function of RAW264.7 macrophages via the NF-κB p65/MAPK signaling pathway [J]., 2021, 21(1): 20.
[11] Zhuang Q, Ye X, Shen S,.polysaccharides ameliorate diet-induced gallstone formation by modulating synthesis of bile acids and the gut microbiota [J]., 2021, 12: 701003.
[12] 阎力君, 洪涛, 雒江菡, 等. 黄芪多糖对结肠癌SW620细胞增殖及凋亡作用的影响 [J]. 中国实验方剂学杂志, 2017, 23(22): 97-101.
[13] Wu C Y, Ke Y, Zeng Y F,. Anticancer activity ofpolysaccharide in human non-small cell lung cancer cells [J]., 2017, 17: 115.
[14] Li W F, Hu X Y, Wang S P,. Characterization and anti-tumor bioactivity ofpolysaccharides by immunomodulation [J]., 2020, 145: 985-997.
[15] Sha X R, Xu X, Liao S Y,. Evidence of immunogenic cancer cell death induced by honey-processedpolysaccharidesand[J]., 2022, 410(1): 112948.
[16] 赵媛媛, 张楠, 孙维义, 等. 黄芪多糖对裸鼠结直肠癌移植瘤的抑制作用 [J]. 郑州大学学报: 医学版, 2021, 56(3): 375-379.
[17] Elham S, Mohammad-Reza S, Kobra E,. Immunomodulatory effects ofpolysaccharide on human peripheral blood mononuclear cells co-cultured with cervical cancer cell line [J]., 2021, 41(5): 684-694.
[18] Li Q, Bao J M, Li X L,. Inhibiting effect ofpolysaccharides on the functions of CD4+CD25 highTreg cells in the tumor microenvironment of human hepatocellular carcinoma [J].(), 2012, 125(5): 786-793.
[19] Dong N, Li X R, Xue C Y,.polysaccharides alleviates LPS-induced inflammation via the NF-κB/MAPK signaling pathway [J]., 2020, 235(7/8): 5525-5540.
[20] Yu J, Dong X D, Jiao J S,. Antitumor and immunoregulatory activities of a novel polysaccharide fromon S180 tumor-bearing mice [J]., 2021, 189: 930-938.
[21] Bukowski K, Kciuk M, Kontek R. Mechanisms of multidrug resistance in cancer chemotherapy [J]., 2020, 21(9): 3233.
[22] Cao Y, Ruan Y, Shen T,.polysaccharide suppresses doxorubicin-induced cardiotoxicity by regulating the PI3K/Akt and p38MAPK pathways [J]., 2014, 2014: 674219.
[23] Cao Y, Ruan Y, Shen T,.polysaccharide suppresses doxorubicin-induced cardiotoxicity by regulating the PI3K/Akt and p38MAPK pathways [J]., 2014, 2014: 674219.
[24] 张颖, 王淳, 于丹, 等. 黄芪多糖抑制肺腺癌A549/DDP细胞移植瘤裸鼠EMT改善顺铂耐药的机制 [J]. 中国实验方剂学杂志, 2022, 28(6): 79-85.
[25] Song J, Chen Y M, He D H,.polysaccharide promotes adriamycin-induced apoptosis in gastric cancer cells [J]., 2020, 12: 2405-2414.
[26] 彭洪薇, 张晓洁, 李菲. 黄芪多糖联合多柔比星抗白血病细胞HL-60/A耐药的机制研究 [J]. 中国实验血液学杂志, 2017, 25(3): 743-748.
[27] 翟秋丽, 胡向丹, 肖静, 等. 黄芪多糖可能通过调控细胞自噬提高宫颈癌HeLa细胞对顺铂的敏感性 [J]. 中国中药杂志, 2018, 43(4): 805-812.
[28] Wu J, Yu J X, Wang J,.polysaccharide enhanced antitumor effects of Apatinib in gastric cancer AGS cells by inhibiting AKT signalling pathway [J]., 2018, 100: 176-183.
[29] 杨东丽. 黄芪总黄酮联合顺铂对喉鳞癌抗癌作用的研究 [D]. 太原: 山西医科大学, 2020.
[30] 齐彦爽, 李肖, 秦雪梅, 等. 黄芪总黄酮联合顺铂对Lewis荷瘤小鼠抗癌作用的研究 [J]. 药学学报, 2020, 55(5): 930-940.
[31] 张冬青, 汪德清, 李卉, 等. 黄芪总黄酮对K562细胞凋亡及细胞周期的影响 [J]. 中国药理学通报, 2010, 26(1): 136-137.
[32] Jiang D J, Rasul A, Batool R,. Potential anticancer properties and mechanisms of action of formononetin [J]., 2019, 2019: 5854315.
[33] Park S, Bazer F W, Lim W,. The O-methylated isoflavone, formononetin, inhibits human ovarian cancer cell proliferation by sub G0/G1 cell phase arrest through PI3K/AKT and ERK1/2 inactivation [J]., 2018, 119(9): 7377-7387.
[34] Huang W J, Bi L Y, Li Z Z,. Formononetin induces the mitochondrial apoptosis pathway in prostate cancer cells via downregulation of the IGF-1/IGF-1R signaling pathway [J]., 2013: 2013Dec20.
[35] Li T Y, Zhao X G, Mo Z N,. Formononetin promotes cell cycle arrest via downregulation of Akt/Cyclin D1/CDK4 in human prostate cancer cells [J]., 2014, 34(4): 1351-1358.
[36] Zhang Y, Chen C, Zhang J. Effects and significance of formononetin on expression levels of HIF-1α and VEGF in mouse cervical cancer tissue [J]., 2019, 18(3): 2248-2253.
[37] Wang W S, Zhao C S. Formononetin exhibits anticancer activity in gastric carcinoma cell and regulating miR-542-5p [J]., 2021, 37(3): 215-225.
[38] Wu Y Y, Zhang X, Li Z Z,. Formononetin inhibits human bladder cancer cell proliferation and invasiveness via regulation of miR-21 and PTEN [J]., 2017, 8(3): 1061-1066.
[39] Li T, Zhang S Y, Chen F S,. Formononetin ameliorates the drug resistance of Taxol resistant triple negative breast cancer by inhibiting autophagy [J]., 2021, 13(2): 497-514.
[40] Lo Y L, Wang W. Formononetin potentiates epirubicin-induced apoptosis via ROS production in HeLa cells[J]., 2013, 205(3): 188-197.
[41] 封海岗, 程飚, 王佑权, 等. 毛蕊异黄酮抑制甲状腺癌TPC-1细胞增殖的机制 [J]. 中华肿瘤防治杂志, 2021, 28(9): 644-649.
[42] Tian J, Wang Y, Zhang X,. Calycosin inhibits theandgrowth of breast cancer cells through WDR7-7-GPR30 Signaling [J]., 2017, 36(1): 153.
[43] Zhang D L, Sun G X, Peng L Y,. Calycosin inhibits viability, induces apoptosis, and suppresses invasion of cervical cancer cells by upregulating tumor suppressor miR-375 [J]., 2020, 691: 108478.
[44] Zhang Z, Auyeung K K W, Sze S C W,. The dual roles of calycosin in growth inhibition and metastatic progression during pancreatic cancer development: A “TGF-β paradox” [J]., 2020, 68: 153177.
[45] Tan J C, Qin X, Liu B,. Integrative findings indicate anti-tumor biotargets and molecular mechanisms of calycosin against osteosarcoma [J]., 2020, 126: 110096.
[46] 王晓玲, 杨小娟, 郑倩倩, 等. 黄芪甲苷调控p62-Nrf2通路对抗小鼠淋巴细胞白血病耐药株的机制研究 [J]. 天津中医药, 2021, 38(12): 1609-1613.
[47] Xu F, Cui W Q, Wei Y,. Astragaloside IV inhibits lung cancer progression and metastasis by modulating macrophage polarization through AMPK signaling [J]., 2018, 37(1): 207.
[48] Zheng Y F, Dai Y, Liu W P,. Astragaloside IV enhances taxol chemosensitivity of breast cancer via caveolin-1-targeting oxidant damage [J]., 2019, 234(4): 4277-4290.
[49] 岳贵娟, 王成祥, 秦楠坤, 等. 基于转录组学探讨黄芪甲苷逆转乳腺癌阿霉素耐药的作用机制 [J]. 中华中医药杂志, 2021, 36(6): 3545-3548.
[50] Zhang A L, Zheng Y H, Que Z J,. Astragaloside IV inhibits progression of lung cancer by mediating immune function of Tregs and CTLs by interfering with IDO [J]., 2014, 140(11): 1883-1890.
[51] 刘玉霞, 郑心, 梁冉冉, 等. 黄芪甲苷基于ILT4-PI3K/Akt-B7-H3通路对NSCLC免疫逃逸机制影响的实验研究 [J]. 中药材, 2021, 44(11): 2677-2682.
[52] 王莉新, 吴文斌, 胥孜杭, 等. 黄芪甲苷通过诱导M1型巨噬细胞极化发挥抗肿瘤作用的机制 [J]. 中国实验方剂学杂志, 2019, 25(14): 19-24.
[53] 王敏, 郑喜, 普晓佳, 等. 黄芪皂苷Ⅱ调控CD45 PTPase诱导抗肿瘤免疫效应的研究 [J]. 云南中医学院学报, 2021, 44(2): 1-6.
[54] Chen X M, Chen X, Gao J X,. Astragaloside III enhances anti-tumor response of NK cells by elevating NKG2D and IFN-Γ [J]., 2019, 10: 898.
[55] 李全志, 郑林静, 刘志强. 黄芪甲苷IV联合紫杉醇通过STAT3-NF-κB途径对胃癌细胞的作用研究 [J]. 实用药物与临床, 2022, 25(1): 21-26.
[56] Qu X Y, Gao H, Zhai J H,. Astragaloside IV enhances cisplatin chemosensitivity in hepatocellular carcinoma by suppressing MRP2 [J]., 2020, 148: 105325.
[57] Qu X Y, Gao H, Tao L N,. Astragaloside IV protects against cisplatin-induced liver and kidney injury via autophagy-mediated inhibition of NLRP3 in rats [J]., 2019, 44(3): 167-175.
[58] 张之蕙, 费梅, 孙美娟. 黄芪颗粒联合贝伐单抗对老年转移性结直肠癌患者血清TIMP-1、MMP-7和P53水平的影响 [J]. 中国老年学杂志, 2021, 41(21): 4654-4657.
[59] Bao W R, Li Z P, Zhang Q W,.polysaccharide RAP selectively attenuates paclitaxel-induced cytotoxicity toward RAW 264.7 cells by reversing cell cycle arrest and apoptosis [J]., 2019, 9: 1580.
[60] 吴军, 张俊玲, 王婧, 等. 黄芪多糖通过抑制磷酸化蛋白激酶B表达增强阿帕替尼抗胃癌细胞作用的研究 [J]. 中国医院用药评价与分析, 2017, 17(6): 731-734.
[61] 梁丽英, 刘欢, 张永琴, 等. 黄芪甲苷对盐酸多柔比星损伤心肌细胞的保护作用及其机制研究 [J]. 中国临床药理学杂志, 2019, 35(17): 1868-1871.
[62] 彭洪薇, 张晓洁, 李菲. 黄芪多糖联合多柔比星抗白血病细胞HL-60/A耐药的机制研究 [J]. 中国实验血液学杂志, 2017, 25(3): 743-748.
[63] 刘甜甜, 卞勇, 关汉卿, 等. 黄芪-莪术-重楼配伍降低血管内皮通透性抑制结肠癌转移作用的研究 [J]. 南京中医药大学学报, 2022, 38(2): 115-121.
[64] 顾俊菲, 孙若岚, 刘夫艳, 等. 黄芪-莪术配伍对结肠癌原位移植瘤模型小鼠SDF-1/CXCR4/NF-κB信号通路的影响 [J]. 中国实验方剂学杂志, 2021, 27(21): 63-72.
[65] 关汉卿, 刘甜甜, 梁研, 等. 黄芪—莪术—重楼配伍对结肠癌原位移植瘤模型裸鼠肿瘤及癌旁组织中侵袭性伪足相关蛋白表达的影响 [J]. 中医杂志, 2021, 62(16): 1427-1433.
[66] 梁立, 齐卓操, 杨心玥, 等. 黄芪莪术联合5-氟尿嘧啶对CT26.WT原位移植瘤小鼠CXCL10/CXCR3轴和CCL3/CCR5轴表达的影响 [J]. 北京中医药大学学报, 2022, 45(1): 62-72.
[67] 郭文晖, 齐卓操, 关汉卿, 等. 黄芪-莪术配伍联合5-氟尿嘧啶对CT26.WT结肠癌原位移植瘤模型小鼠中Th17/Treg平衡及肿瘤相关mRNA和蛋白表达的影响 [J]. 中国中药杂志, 2022, 47(1): 167-175.
[68] 梁研, 孙若岚, 刘夫艳, 等. 基于网络药理学和实验验证分析黄芪-莪术-蚤休角药配伍抗结直肠癌的作用机制 [J]. 中国中药杂志, 2022, 47(3): 776-785.
[69] Wu T H, Yeh K Y, Wang C H,. The combination ofandinhibits lung cancer andthrough its immunomodulatory function [J]., 2019, 2019: 9206951.
[70] 邓颂, 王爱萍, 陈曦, 等. 黄芪白术汤下调miR-31-5p/STAT3环路抑制结肠炎相关性结肠癌进程 [J]. 中国药理学通报, 2019, 35(9): 1308-1313.
[71] 孙海鹏, 马山, 庄贺, 等. 黄芪-白花蛇舌草抑制肺癌A549细胞增殖机制 [J]. 中国实验方剂学杂志, 2021, 27(19): 28-35.
Research progress on antitumor mechanism of active components in
XU Shi-yi1, 3, LIU Xiu-bo2, LU Jia-xin1, ZHANG Zhan-ping1, YAN Xue-ying1, MA Wei1, 3
1. School of Pharmacy, Heilongjiang University of Chinese Medicine, Harbin 150040, China 2. Jiamusi College, Heilongjiang University of Chinese Medicine, Jiamusi 154007, China 3. Experimental Training Center, Heilongjiang University of Chinese Medicine, Harbin 150040, China
The effective treatment of malignant tumor has always been a dilemma faced by modern medicine. The research of traditional Chinese medicine (TCM) has accumulated rich experience in the treatment of malignant tumors, and the antitumor mechanisms of different TCM are not the same. Chinese medicine believes that tumor is “evil”. The main idea of TCM for antitumor is “tonifyingand strengthening the body resistance”. Huangqi (), a TCM, is known as “the most important medicine for tonifying”. It is a commonly used Chinese traditional medicinal material in tumor prescriptions. Clinical experience has proved thathas strong antitumor effect, of which antitumor effective components mainly include polysaccharides, flavonoids and saponins. In addition, the combined application of astragalus and chemotherapy drugs can increase the efficacy, reduce the toxicity, increase the sensitivity and reverse the multidrug resistance.plays an antitumor role by regulating immune function, affecting cell cycle, promoting apoptosis and neovascularization, inhibiting inflammation response and reversing multi-drug resistance.polysaccharide, formononetin, calycosin, astragaloside IV and other major components have great research and development value. This paper summarizes the relevant research results ofin antitumor in recent years, including the antitumor effect and molecular mechanism of the active components in, which provides a basis for promoting the development and utilization ofresources and their active components, and provides a reference for the research and development of new antitumor drugs.
; antitumor; molecular mechanism;polysaccharides; formononetin; calycosin; astragaloside
R285
A
0253 - 2670(2022)23 - 7613- 11
10.7501/j.issn.0253-2670.2022.23.033
2022-07-23
国家自然科学基金面上项目(821713927);中央支持地方高校改革发展资金人才培养高水平项目(ZYRCB2021008);黑龙江中医药大学中药健康相关产品研发及产业化专项(2019BJP06);黑龙江省中医药经典普及化研究专项课题:黑龙江黄芪道地性研究(ZYW2022-071)
徐世一(1992—),女,在读博士,从事中药资源学与药用植物生物工程研究。E-mail: 994010246@qq.com
通信作者:阎雪莹(1971—),女,教授,博士,从事中药抗肿瘤缓控释制剂研究。E-mail: 15159267@qq.com
马 伟(1969—),女,研究员,博士,从事中药资源学与药用植物生物工程研究。E-mail: 88788891@qq.com
[责任编辑 潘明佳]
