聚单宁酸包覆的PLGA纳米粒装载β-榄香烯用于光热-化疗联合抗肿瘤的研究
2022-12-08阮明月周占荣邓佳玲韩丙辛杜守颖
阮明月,吴 凯,周占荣,邓佳玲,韩丙辛,杜守颖,韩 宁
·药剂与工艺·
聚单宁酸包覆的PLGA纳米粒装载β-榄香烯用于光热-化疗联合抗肿瘤的研究
阮明月,吴 凯,周占荣,邓佳玲,韩丙辛,杜守颖*,韩 宁*
北京中医药大学中药学院,北京 102488
为了实现光热化疗联合治疗,提高抗肿瘤效果,将具有抗肿瘤作用的β-榄香烯(β-elemene,Ele)装载于聚乳酸羟基乙酸共聚物[poly(,-lactide-co-glycolic acid),PLGA]纳米粒(Ele-PLGA NPs)中,并在载药纳米粒表面进一步包覆了聚单宁酸(poly-tannic acid,pTA),制得Ele-PLGA-pTA纳米粒(Ele-PLGA-pTA NPs)。首先利用O/W乳化法制备Ele-PLGA NPs,然后加入单宁酸与Fe3+发生络合反应,形成pTA分子层附着在Ele-PLGA NPs表面,最终形成Ele-PLGA-pTA NPs,通过马尔文激光粒度仪和透射电子显微镜对该系统的粒径、ζ电位、稳定性以及粒子形态进行考察;分别利用HPLC法和BCA试剂盒对β-榄香烯的载药量和单宁酸的包覆率进行测定;通过红外热成像仪评价PLGA-pTA NPs的光热升温效率和光热稳定性;通过MTT法考察载药纳米粒对Lewis肺癌细胞(Lewis lung cancer cell,LLC)的细胞毒性;通过建立小鼠LLC皮下肿瘤模型对Ele-PLGA-pTA NPs的体内光热-化疗联合抗肿瘤效果进行探究。经测定,Ele-PLGA-pTA NPs对β-榄香烯的载药量和单宁酸的包覆率分别为(6.6±0.1)%、(5.4±0.1)%。其形态呈球形,粒径为(202.9±2.7)nm,ζ电位为(−37.5±0.2)mV,分散性良好。体外光热性能考察结果表明,在近红外激光(NIR laser)的照射下,PLGA-pTA NPs表现出良好的光热转换能力和光热稳定性。体外细胞实验结果表明,空白载体组(PLGA-pTA NPs)基本没有细胞毒性,与单一化疗组(Ele-PLGA-pTA NPs)相比,光热-化疗联合组(Ele-PLGA-pTA NPs+Laser)具有更强的细胞毒性。体内实验结果表明,与单纯光热治疗组(PLGA-pTA NPs+Laser)和单一化疗组(Ele-PLGA-pTA NPs)对照组相比,光热-化疗联合组(Ele-PLGA-pTA NPs+Laser)对小鼠肿瘤生长的抑制效果最为显著(<0.001)。所制备的Ele-PLGA-pTA NPs能够实现光热-化疗联合治疗,显著提高抗肿瘤效果。
β-榄香烯;光热-化疗联合治疗;聚单宁酸;纳米粒;聚乳酸羟基乙酸共聚物;抗肿瘤
β-榄香烯(β-elemene,Ele)是从姜科姜黄属植物温郁金Y. H. Chen et C. Ling中提取的广谱抗肿瘤药物,不良反应小[1],临床常应用于多种恶性肿瘤的辅助治疗[2]。其主要是通过抑制肿瘤细胞增殖、诱导细胞凋亡和调节机体免疫功能等来发挥作用。但β-榄香烯由于水溶性差、对肿瘤的杀伤能力较弱及生物利用度低等缺点,导致其临床疗效不显著,而且β-榄香烯注射剂在iv时会产生静脉炎和疼痛等不良反应[3-4]。因此,需要开发能够克服以上不足的新型药物递送系统,以提高其疗效。
近年来,利用纳米粒作为药物的递送载体已成为药剂学领域的研究热点[5]。目前,文献中关于β-榄香烯的新型给药系统包括脂质体(liposome)、固体脂质纳米粒(solid lipid nanoparticles)、微乳(microemulsion)和微囊(microcapsule)等[6-7]。其中,聚合物聚乳酸羟基乙酸共聚物[poly(,-lactide-co-glycolic acid),PLGA]纳米粒(PLGA NPs),由于其良好的生物相容性和生物降解性,已被美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于临床治疗[8],因此本研究拟利用PLGA NPs作为β-榄香烯的载体进行抗肿瘤研究。
光热疗法(photothermal therapy,PTT)是利用光热材料在近红外光的照射下,将光能转换为热能,通过高温诱导肿瘤细胞凋亡或坏死的治疗方法[9]。通常肿瘤细胞对高温较为敏感,当肿瘤部位温度超过一定数值(约42 ℃)时,会导致细胞内DNA及蛋白质变性和细胞膜损伤等[10]。通过光热材料的局部给药或近红外光的局部照射,可以控制光热疗法的温度和施加部位,从而降低对周围正常组织的损伤[11]。常见的光热材料包括无机纳米粒,如金纳米粒、碳纳米粒、黑磷纳米粒和硫化铜纳米粒,但无机材料生物相容性较低,且大多存在降解困难的问题[9],而有机小分子光敏剂如吲哚箐绿(indocyanine green,ICG)等则存在光热稳定性差、易发生降解和光漂白现象等问题[12]。因此,开发光热稳定性好且生物可降解的光热剂是光热疗法的关键。
单宁酸是一种来源于植物的天然多酚类化合物,具有良好的生物相容性和生物降解性,已被FDA接受并广泛应用于食品和医药中[13]。在中性水溶液中,单宁酸能够与Fe3+快速而高效地络合形成稳定的聚单宁酸(poly-tannic acid,pTA)分子层包覆于不同纳米粒表面,前期实验发现聚单宁酸具有较强的光热转化效率,有望成为新型光热剂,用于实现光热疗法抗肿瘤。
近年来,联合疗法即将不同治疗方法结合,以发挥联合抗肿瘤效果得到了研究人员的广泛关注,与单一化疗或光热疗法相比,将光热疗法与化疗相结合具有许多优势[14]。光热疗法能够克服单一化疗作用选择性低及易产生多药耐药性这一问题,而化疗则能协助光热疗法彻底清除肿瘤细胞,防止肿瘤的复发[15]。光热疗法还可以通过改变肿瘤微环境,从而增加载药纳米粒在肿瘤部位的蓄积,增强化疗药物的细胞膜透过性以及肿瘤细胞对化疗药物的敏感性[16-17]。因此本研究拟将β-榄香烯介导的化疗与聚单宁酸介导的光热疗法相结合,以期提高抗肿瘤效果,同时降低不良反应[18]。
本研究将β-榄香烯作为化疗药物装载于PLGA NPs中,以聚单宁酸作为光热材料包覆于载药纳米粒表面,从而制得Ele-PLGA-pTA NPs,并对该纳米粒的粒径、ζ电位、稳定性和粒子形态进行了表征,测定β-榄香烯的载药量和单宁酸的包覆率,评价PLGA-pTA NPs的体外光热性能,探究Ele-PLGA-pTA NPs对小鼠Lewis肺癌细胞(Lewis lung cancer cell,LLC)的光热-化疗联合抗肿瘤作用,并对Ele-PLGA-pTA NPs的体内抗肿瘤效果进行了考察。
1 仪器与材料
1.1 仪器
BSA 224S型电子天平,北京赛多利斯科学仪器有限公司;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;Scientz-IID型超声波细胞破碎仪,宁波新芝生物技术股份有限公司;TGL-16型医用离心机,湘仪离心机仪器有限公司;S/N 601-0723型马尔文激光粒度仪,英国马尔文仪器有限公司;Clario Star型酶标仪,德国BMG Labtech公司;Agilent 1100型高效液相色谱仪,安捷伦科技有限公司;色谱柱为Diamonsil®C18柱(250 mm×4.6 mm,5 μm);JEM-2100型透射电子显微镜(SEM),日本JEOL公司;Ax5型热成像仪,美国FLIR公司;C170型二氧化碳培养箱,德国Binder公司;CKX41-A22PHP型倒置显微镜,日本Olympus公司;Captair Bio 321 Smart型超净工作台,法国Erlab公司;游标卡尺,上海赛拓五金有限公司。
1.2 试剂
β-榄香烯(批号L02253-180701,质量分数≥98%),购自上海高朗化工科技有限公司;单宁酸(批号M61018012,质量分数≥98%)、,-双(2-羟乙基)甘氨酸(bicine,批号C10056646,GR)、磷酸盐缓冲液(phosphate buffer solution,PBS,AR,批号C10287792)均购自上海麦克林有限公司;二氯甲烷(批号20201018)购自现代东方(北京)科技发展有限公司;PLGA(型号DG-75DLG035)购自济南代钢生物材料有限公司;三氯化铁(FeCl3,AR,批号20140310,质量分数>99%)、二甲基亚砜(dimethyl sulfoxide,DMSO,批号20200911)购自天津百伦斯生物技术有限公司;二棕榈酰磷脂酰胆碱(1,2-dihexadecanoyl-sn-glycero-3-phosphocholine,DPPC,批号B80581)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(1,2-distearoyl-sn-glycero-3-phosphoethanolamine-polyethylene glycol 2000,DSPE-PEG2000,批号C00486)均购自上海艾伟拓医药科技有限公司;BCA试剂盒(批号109012)、MTT(批号2018092101)、RPMI 1640(批号12019003)购自北京拜尔迪生物技术有限公司;胎牛血清(fetal bovine serum,FBS,批号A87F82H)购自美国Gemini生物科技有限公司;抗青霉素(100 U/mL)-抗链霉素(100 μg/mL),批号15140122,购自格兰岛生命科技公司;胰蛋白酶(批号25200056)购自美国Gibco公司;所有其他化学品均来自Sigma-Aldrich公司。
1.3 细胞与动物
小鼠LLC细胞株购自美国ATCC公司;SPF级C57BL/6J雌性小鼠,体质量18~20 g,购于斯贝福北京生物技术有限公司,许可证号SCXK(京)2019-0010。实验期间动物均饲养于同一环境下,保持室温(25±1)℃,空气湿度55%~65%,12 h光暗循环,自由进食饮水。本实验相关动物实验遵循北京中医药大学有关实验动物管理和使用的规定,动物实验伦理批准号为BUCM-4-2021110106-4066。
2 方法与结果
2.1 Ele-PLGA-pTA NPs的制备
采用O/W乳化法以DPPC和DSPE-PEG2000作为乳化剂,制备Ele-PLGA NPs。称取40 mg PLGA、5 mg β-榄香烯、4 mg DPPC和4 mg DSPE-PEG2000,加入1.5 mL二氯甲烷使其完全溶解,作为有机相。再加入16 mL去离子水为水相。将混合物用细胞破碎仪进行探头超声(冰水浴,超声功率200 W,2 s开2 s关,超声2 min)使其充分乳化,经旋蒸去除有机溶剂后得到白色混悬液,16 000 r/min离心(离心半径5.9 cm)15 min,洗涤2次,得到Ele-PLGA NPs。将Ele-PLGA NPs分散于bicine缓冲液(10 mmol/L,pH值7.4)中,使纳米粒质量浓度为2 mg/mL,然后加入一定体积的单宁酸溶液和FeCl3溶液(单宁酸与FeCl3的质量比为1∶2),在水浴超声(冰水浴,超声功率120 W,2 s开2 s关,超声2 min)条件下混合,经2次离心(转速16 000 r/min,离心半径5.9 cm,时间15 min),去除过量的聚单宁酸,即得Ele-PLGA-pTA NPs。
2.2 纳米粒的物理表征
将Ele-PLGA NPs和Ele-PLGA-pTA NPs分别分散于去离子水和PBS溶液(5 mmol/L,pH值7.4)中,利用马尔文激光粒度仪测定样品的平均粒径、多分散系数(PDI)及ζ电位。利用TEM观察纳米粒的实际形态。结果见表1和图1~5。
单宁酸溶液与FeCl3溶液外观为黄色透明溶液,将二者混合即形成深蓝色的聚单宁酸,证明单宁酸与Fe3+发生络合反应,形成了聚单宁酸(图1)。
所制备的Ele-PLGA NPs混悬液为白色,Ele-PLGA-pTA NPs混悬液为深紫色(图2),样品的颜色变化证明了聚单宁酸的包覆。马尔文激光粒度仪测定结果如表1和图3所示,Ele-PLGA NPs的粒径为(195.9±3.9)nm,经过聚单宁酸包覆后的Ele-PLGA-pTA NPs的粒径为(202.9±2.7)nm,粒径略有增大。PDI值均很小,显示2种纳米粒的分散性良好。Ele-PLGA NPs的ζ电位为(−15.3±0.7)mV,而Ele-PLGA-pTA NPs的ζ电位为(−37.5±0.2)mV(表1和图4),下降明显,原因是Ele-PLGA-pTA NPs表面所包覆的聚单宁酸,其结构中存在着大量的酚羟基,使得Ele-PLGA-pTA NPs带负电荷。

表1 不同样品的粒径、PDI及ζ电位测定结果

图1 单宁酸溶液(a)、FeCl3溶液(b)和聚单宁酸样品(c)形态

图2 Ele-PLGA NPs混悬液(a)和Ele-PLGA-pTA NPs混悬液(b)形态
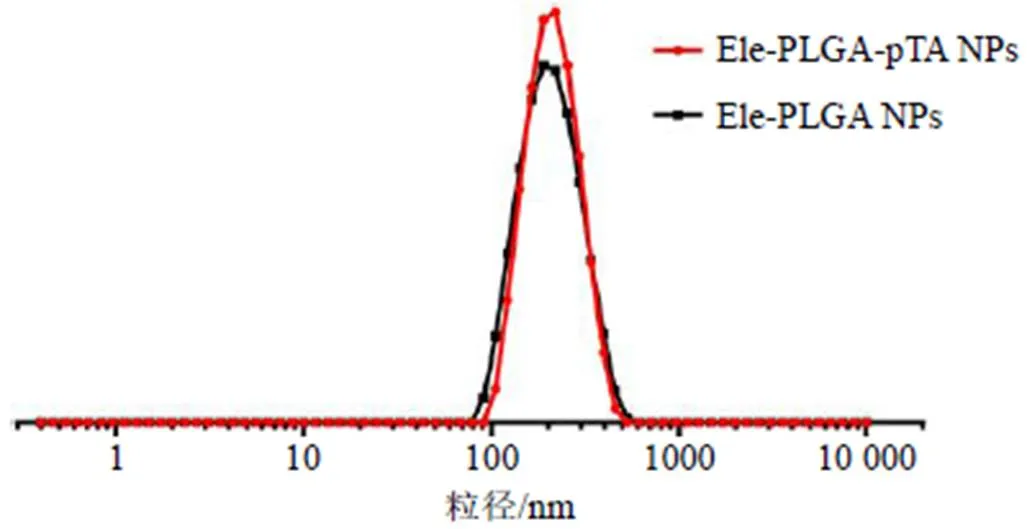
图3 Ele-PLGA NPs和Ele-PLGA-pTA NPs粒径分布
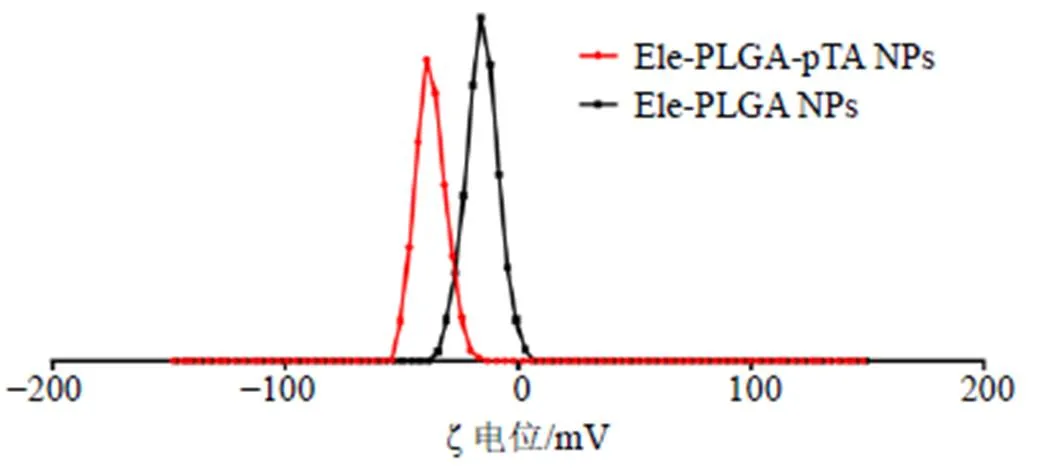
图4 Ele-PLGA NPs和Ele-PLGA-pTA NPs ζ电位分布
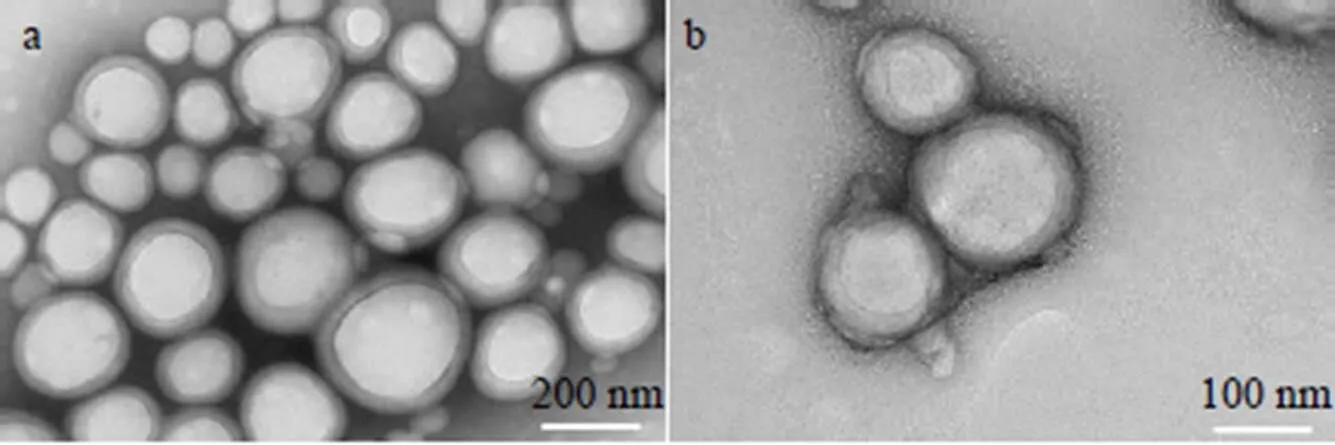
图5 Ele-PLGANPs(a)和Ele-PLGA-pTANPs(b)的TEM图
TEM结果显示,Ele-PLGA NPs、Ele-PLGA-pTA NPs均为球形,平均粒径在100~200 nm。Ele-PLGA NPs表面光滑呈亮白色,而Ele-PLGA-pTA NPs表面有褶皱状薄膜呈灰色,证明了聚单宁酸的成功包覆(图5)。
2.3 β-榄香烯载药量以及单宁酸包覆率的测定
将Ele-PLGA-pTA NPs分散于1 mL去离子水中,吸取100 μL样品,加入500 μL乙腈将载药纳米粒溶解,再加入400 μL去离子水使PLGA析出,而β-榄香烯仍溶解于混合溶剂中,离心(转速16 000 r/min,离心半径5.9 cm,时间15 min)去除PLGA沉淀,根据实验室前期建立的方法学[19],采用HPLC法测定上清液中β-榄香烯的含量。另外吸取800 μL样品离心,收集沉淀并烘干,采用称重法测定样品的质量。计算β-榄香烯的载药量。
β-榄香烯载药量=β-榄香烯的质量/Ele-PLGA-pTA NPs的质量
采用BCA试剂盒测定Ele-PLGA-pTA NPs中单宁酸的含量。将Ele-PLGA-pTA NPs分散于1 mL去离子水中,吸取60 μL样品,与600 μL BCA工作试剂混合,于室温下避光反应1 h,16 000 r/min离心(离心半径5.9 cm)15 min,取上清液。利用酶标仪测定上清液在562 nm下的吸光度()值。通过预先建立的单宁酸标准曲线[20-21],计算样品中单宁酸的质量浓度及其质量。计算单宁酸包覆率。
单宁酸包覆率=单宁酸质量/Ele-PLGA-pTA NPs质量
结果测得β-榄香烯的载药量为(6.6±0.1)% (=3),单宁酸的包覆率为(5.4±0.1)%(=3)。
2.4 体外光热性能考察
采用可见分光光度计考察PLGA-pTA NPs的全波长吸收特征,将PLGA-pTA NPs用去离子水分散(聚单宁酸质量浓度为2 μg/mL),置于石英比色皿中,在300~900 nm进行全波长扫描,测定PLGA-pTA NPs的全波长吸收光谱。
采用红外热成像仪对PLGA-pTA NPs的体外升温能力进行考察,吸取1 mL含不同聚单宁酸质量浓度(25、50、75、100 μg/mL)的PLGA-pTA NPs混悬液,置于808 nm激光(2.0 W/cm2)下照射7 min,并用红外摄像机每隔15 s记录样品的实时温度,并利用FLIR工具软件进行分析。
考察PLGA-pTA NPs和游离吲哚箐绿的升温稳定性。将含聚单宁酸质量浓度为75 μg/mL的PLGA-pTA NPs混悬液与50 μg/mL的吲哚箐绿溶液分别用808 nm激光(2.0 W/cm2)照射后,关闭激光光源,待样品自然冷却至室温后,再次打开激光进行照射,重复4次,用红外摄像机连续记录样品的温度变化情况,并用FLIR工具软件进行分析。
由图6-A所知,PLGA-pTA NPs在波长300~900 nm具有广泛的吸收,PLGA-pTA NPs在660 nm具有较高的吸收,但是一般激光波长越长,组织穿透能力越强[22],为了实现更强的组织穿透能力,实验选择808 nm作为激光照射波长。
由图6-B可知,在近红外激光的照射下,PBS组的温度基本无变化,而含有PLGA-pTA NPs的样品则升温明显,并且随着聚单宁酸的质量浓度增大,温度升高幅度越大,说明Ele-PLGA NPs的升温能力具有浓度相关性。而当聚单宁酸的质量浓度为100 μg/mL时,样品的温度能够升高近60 ℃,说明聚单宁酸具有很强的光热转化能力。
由图6-C可知,在激光的反复照射下,PLGA-pTA NPs在4次激光“开-关”循环过程中所达到的最高温度略有下降,表明聚单宁酸具有较高的光热稳定性,不会发生光漂白现象。而常见小分子光敏剂吲哚箐绿在第4次激光“开-关”过程中所达到的最高温度发生明显下降,表明游离吲哚箐绿光热稳定性差,易发生光漂白现象。
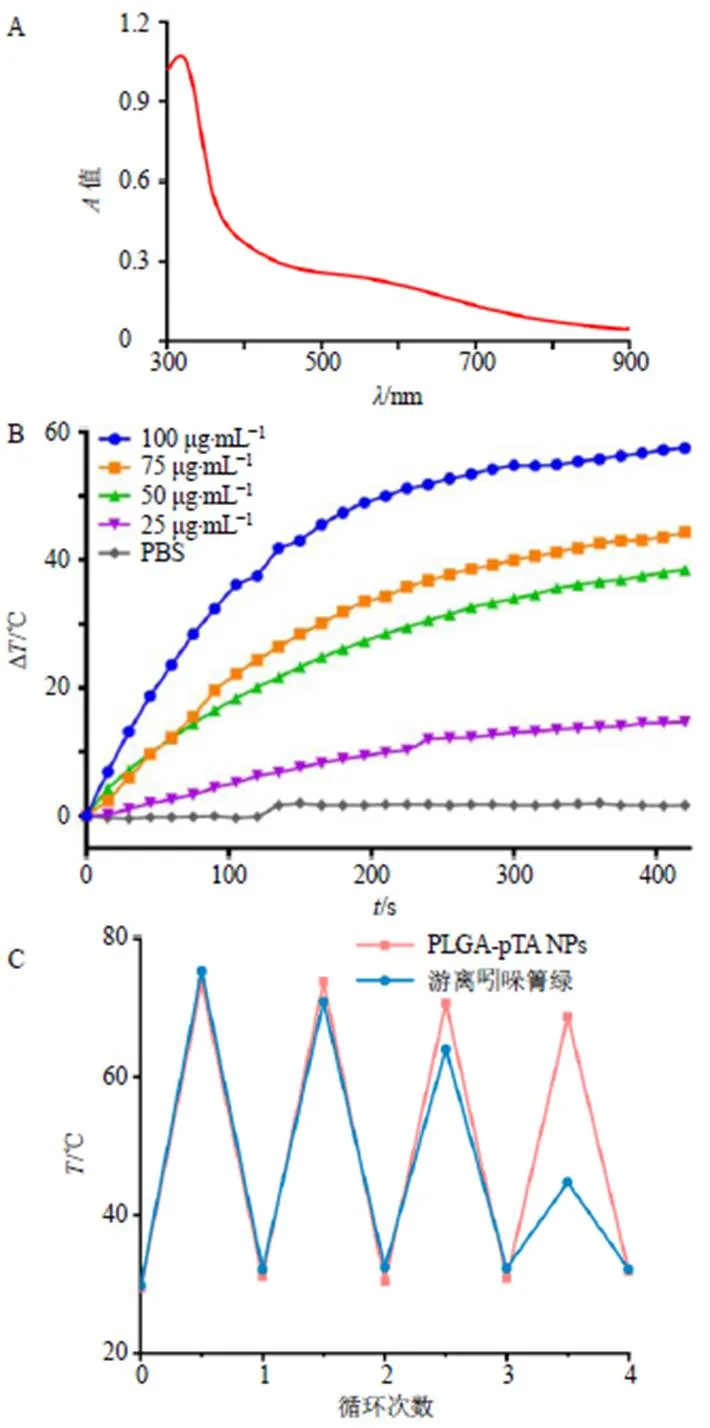
A-PLGA-pTA NPs的全波长吸收光谱(聚单宁酸质量浓度为2 μg∙mL−1) B-含不同质量浓度聚单宁酸的PLGA-pTA NPs升温曲线(808 nm,2.0 W∙cm−2) C-PLGA-pTA NPs(聚单宁酸质量浓度为75 μg∙mL−1)和游离吲哚箐绿(质量浓度为50 μg∙mL−1)的光热稳定性
2.5 体外光热细胞毒性考察
采用MTT法考察Ele-PLGA-pTA NPs对小鼠LLC细胞的光热-化疗联合抗肿瘤作用。将Ele-PLGA-pTA NPs用培养基稀释至不同β-榄香烯质量浓度(13、20、26、33、39 μg/mL),未载药的PLGA-pTA NPs也用培养基按照一定比例稀释,使PLGA-pTA NPs样品中的聚单宁酸质量浓度与Ele-PLGA-pTA NPs样品中的聚单宁酸质量浓度(5.0、7.5、10.0、12.0、15.0 μg/mL)相等。实验设置对照组(空白载体,PLGA-pTA NPs)、化疗组(Ele-PLGA-pTA NPs)和光热-化疗联合组(Ele-PLGA-pTA NPs+Laser)。将小鼠LLC细胞铺种于96孔板(1×104个/孔)中,待细胞贴壁后,于每孔中加入不同的样品。待样品与细胞共孵育4 h后,将光热-化疗联合组的每个孔置于808 nm激光(2.0 W/cm2)下照射5 min。然后弃去含药培养基,更换新鲜培养基继续孵育12 h。最后采用MTT法检测细胞存活率。未经激光照射的对照组(PLGA-pTA NPs)和化疗组(Ele-PLGA-pTA NPs)也作相同的处理。
细胞存活率=给药/对照
结果如图7所示,空白载体组的细胞存活率略微出现下降,说明空白载体在测试质量浓度内的细胞毒很低。对于单一化疗组,随着β-榄香烯质量浓度的增大,细胞存活率逐渐下降,β-榄香烯对小鼠LLC细胞的细胞毒性不断增强。在相同β-榄香烯质量浓度下,与单一化疗组相比,光热-化疗联合组则表现出更强的细胞毒性,在β-榄香烯质量浓度为33 μg/mL、聚单宁酸质量浓度为12.0 μg/mL,以及β-榄香烯质量浓度为39 μg/mL、聚单宁酸质量浓度为15.0 μg/mL的条件下,2组之间的差异最为显著 (<0.001),光热-化疗联合组的细胞存活率分别为21.6%和8.0%,明显低于单一化疗组(57.9%和45.8%)。结果表明,将β-榄香烯介导的化疗与聚单宁酸介导的光热疗法相结合,能更有效地杀死肿瘤细胞。
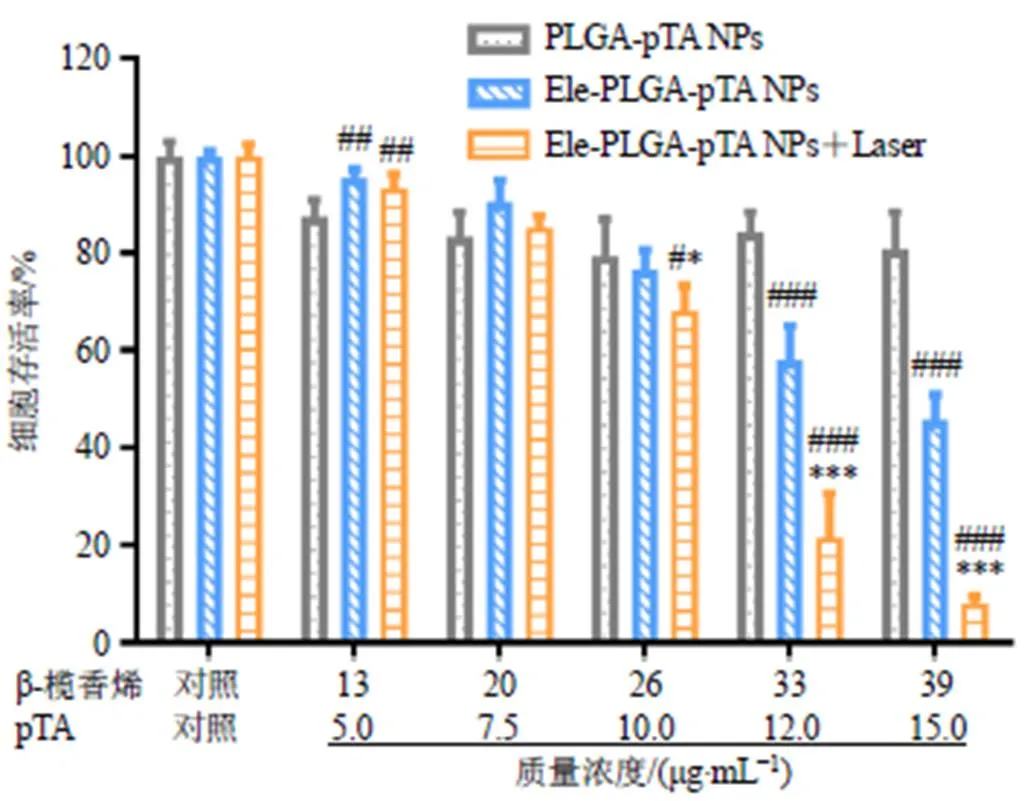
与对照组比较:#P<0.05 ##P<0.01 ###P<0.001;与化疗组比较:*P<0.05 ***P<0.001
2.6 体内药效学研究
用培养基配制5×106个/mL的LLC细胞悬液,皮下接种于小鼠身体右侧(每只0.1 mL),待肿瘤体积生长至100~200 mm3后,将荷瘤小鼠随机分为4组(=4),即对照组、化疗组(Ele-PLGA-pTA NPs)、光热组(PLGA-pTA NPs+Laser)和光热-化疗联合组(Ele-PLGA-pTA NPs+Laser)。通过瘤内注射给药,注射体积为50 μL,β-榄香烯给药剂量为40 mg/kg。给药后立刻对光热组和光热-化疗联合组的肿瘤区域用激光(808 nm、2.0 W/cm2)照射5 min。每3天给药1次,连续给药2次。隔天用天平称量小鼠体质量,并通过游标卡尺测量肿瘤的长、短径,计算瘤体积。连续记录12 d。待试验结束后,将各组小鼠脱颈处死,取出各组肿瘤组织并称定质量,计算肿瘤抑制率,同时对离体肿瘤进行拍照。
肿瘤抑制率=1-实验组平均肿瘤质量/对照组平均肿瘤质量
不同给药组小鼠的肿瘤体积变化结果如图8-A所示,与对照组相比,化疗组对肿瘤生长仅表现出轻微的抑制作用,可能的原因为虽然经瘤内注射给药,药物全部集中在肿瘤组织,但药物未能在瘤内实现均匀扩散,以及肿瘤细胞对β-榄香烯不够敏感,导致抑瘤效果欠佳。与单一化疗组类似,单一光热组对肿瘤生长的抑制作用也不够显著,可能的原因包括①纳米粒在瘤内分布不均匀;②激光的穿透能力有限,不能深入到肿瘤内部。而对于光热-化疗联合组,其抗肿瘤效果最为显著,可能的原因是聚单宁酸的光热作用不仅杀死了部分肿瘤细胞,同时还有利于β-榄香烯的释放和扩散,而β-榄香烯则可以作用于深处的肿瘤细胞,发挥其毒性作用。该结果表明Ele-PLGA-pTA NPs介导的光热-化疗联合疗法能够更有效地抑制肿瘤生长,取得更好的治疗效果。
不同给药组的小鼠在给药前后体质量情况如图8-B所示,给药前各组小鼠体质量比较,均无显著性差异。在给药后的观察期间,对照组小鼠平均体质量略有增加,可能是由于肿瘤体积增大所引起的,单独化疗组与光热组的小鼠体质量在最后2 d略有下降,这与小鼠状态不佳有关。而光热-化疗联合组小鼠的体质量则基本无变化,说明光热-化疗联合治疗较为安全,不会对小鼠产生较大的不良反应。但由于不同组小鼠的体质量存在较大标准差,使得不同组在给药后的不同天数,小鼠的平均体质量均无显著性差异。

A-肿瘤体积生长曲线 B-体质量变化曲线 C-离体肿瘤图片 与对照组比较:*P<0.05
从离体肿瘤组织图片(图8-C)可以看出,与其他组相比,光热-化疗联合组的肿瘤体积最小;肿瘤组织称定质量结果(表2)显示,对照组平均瘤质量为(1.28±0.47)g,化疗组和光热组的平均瘤质量分别为(0.91±0.31)g和(0.75±0.30)g,而光热-化疗组的肿瘤质量最轻,仅为(0.36±0.31)g (<0.01)。化疗组、光热组和光热-化疗联合组的肿瘤抑制率分别为28.9%、41.4%、71.9%。以上结果表明,将聚单宁酸介导的光热疗法和β-榄香烯介导的化疗相结合能够显著提高抗肿瘤效果。

表2 荷瘤小鼠肿瘤质量及抑瘤率(, n = 4)
与对照组比较:**<0.01
**< 0.01control group
3 讨论
本研究制备了Ele-PLGA-pTA NPs纳米递送系统,将化疗药物β-榄香烯与光热材料聚单宁酸相结合,为实现化疗和光热疗法的联合治疗提供了思路与借鉴。通过细胞毒性实验和体内光热效应研究,评价Ele-PLGA-pTA NPs纳米递送系统的光热-化疗联合抗肿瘤效果,为化疗和光热疗法的联合应用提供了实验依据。
单宁酸含有大量的酚羟基,具有一定的黏附性,可通过分子间的相互作用如氢键、疏水作用和π-π堆积作用附着于基质表面,所以在制备Ele-PLGA-pTA NPs时,首先加入单宁酸溶液,使单宁酸附着于Ele-PLGA NPs表面,再加入Fe3+,使二者迅速络合[23]。研究发现pH(4.0和7.4)对单宁酸的包覆率影响较小,但在酸性条件下金属络合物可能会发生降解[24],所以聚单宁酸的包覆选择在中性环境下进行。前期实验也显示,FeCl3与单宁酸质量比的变化对单宁酸的包覆率没有明显的影响,但是随着FeCl3与单宁酸质量比的增加,样品的升温幅度也显著增强,可能是与单宁酸络合的Fe3+含量增加导致聚单宁酸的近红外区域吸收增强有关[25]。
纳米粒经过尾iv后,通过高通透性和长滞留效应(enhanced permeability and retention effect,EPR)到达肿瘤部位的质量浓度比较少,由于聚单宁酸的质量浓度会影响光热升温效果[26],所以实验选择采用瘤内注射的方式来保证聚单宁酸的质量浓度。
Ele-PLGA-pTA NPs纳米递送系统在光热-化疗联合抗肿瘤方面具有一定的应用前景,但仍需对Ele-PLGA-pTA NPs介导的联合治疗的安全性和有效性进行更加全面的考察,并对其抗肿瘤作用的产生机制进行更深入的研究。
利益冲突 所有作者均声明不存在利益冲突
[1] Yu X M, Xu M Y, Li N,. β-elemene inhibits tumor-promoting effect of M2 macrophages in lung cancer [J]., 2017, 490(2): 514-520.
[2] Pan Y H, Wang W, Huang S,. Beta-elemene inhibits breast cancer metastasis through blocking pyruvate kinase M2 dimerization and nuclear translocation [J]., 2019, 23(10): 6846-6858.
[3] 陶喜民, 高文斌. 榄香烯乳注射液的不良反应及防治[J]. 药物不良反应杂志, 2003, 6: 390-392.
[4] 郭金苗, 孙玉姣, 付慧. β-榄香烯抗肿瘤药理作用机制及药物递送系统研究进展 [J]. 药物评价研究, 2022, 45(10): 2133-2137.
[5] Mitchell M J, Billingsley M M, Haley R M,. Engineering precision nanoparticles for drug delivery [J]., 2021, 20(2): 101-124.
[6] Zhai B T, Zhang N N, Han X M,. Molecular targets of β-elemene, a herbal extract used in traditional Chinese medicine, and its potential role in cancer therapy: A review [J]., 2019, 114: 108812.
[7] Zhai B, Zeng Y, Zeng Z,. Drug delivery systems for elemene, its main active ingredient β-elemene, and its derivatives in cancer therapy [J]., 2018, 13: 6279-6296.
[8] Xie X T, Wang H J, Williams G R,. Erythrocyte membrane cloaked curcumin-loaded nanoparticles for enhanced chemotherapy [J]., 2019, 11(9): 429.
[9] Shang T Y, Yu X Y, Han S S,. Nanomedicine-based tumor photothermal therapy synergized immunotherapy [J]., 2020, 8(19): 5241-5259.
[10] Oei A L, Vriend L E M, Crezee J,. Effects of hyperthermia on DNA repair pathways: One treatment to inhibit them all [J]., 2015, 10: 165.
[11] Hwang S, Nam J, Jung S,. Gold nanoparticle-mediated photothermal therapy: Current status and future perspective [J]., 2014, 9(13): 2003-2022.
[12] Park T, Lee S M, Amatya R,. ICG-loaded PEGylated BSA-silver nanoparticles for effective photothermal cancer therapy [J]., 2020, 15: 5459-5471.
[13] Cao J, Chen Z X, Chi J N,. Recent progress in synergistic chemotherapy and phototherapy by targeted drug delivery systems for cancer treatment [J]., 2018, 46(sup1): 817-830.
[14] Xie Z J, Fan T J, An J,. Emerging combination strategies with phototherapy in cancer nanomedicine [J]., 2020, 49(22): 8065-8087.
[15] Ge R F, Cao J, Chi J N,. NIR-guided dendritic nanoplatform for improving antitumor efficacy by combining chemo-phototherapy [J]., 2019, 14: 4931-4947.
[16] Liang C, Diao S, Wang C,. Tumor metastasis inhibition by imaging-guided photothermal therapy with single-walled carbon nanotubes [J]., 2014, 26(32): 5646-5652.
[17] Chen Q, Liang C, Wang C,. An imagable and photothermal “Abraxane-like” nanodrug for combination cancer therapy to treat subcutaneous and metastatic breast tumors [J]., 2015, 27(5): 903-910.
[18] Shukla N, Singh B, Kim H J,. Combinational chemotherapy and photothermal therapy using a gold nanorod platform for cancer treatment [J]., 2020, 37(8): 2000099.
[19] 史巧. 载β-榄香烯与光敏剂的长循环脂质体用于光疗-化疗协同抗肿瘤研究 [D]. 北京: 北京中医药大学, 2021.
[20] Cestari M D, Zuppardo L S L, Armando Jr J,. Analysis of the polyphenols content in medicinal plants based on the reduction of Cu (II)/bicinchoninic complexes [J]., 2009, 57(23): 11061-11066.
[21] 黄星月, 吴凯, 王昌海, 等. cRGD修饰的紫杉醇纳米晶体的制备及体外评价[J]. 中国新药杂志, 2022, 31(15): 1517-1523.
[22] Chen J Q, Ning C Y, Zhou Z N,. Nanomaterials as photothermal therapeutic agents [J]., 2019, 99: 1-26.
[23] 俞木萍. 单宁酸金属络合物膜的制备及应用 [D]. 芜湖: 安徽师范大学, 2018.
[24] Huang H, Li P, Liu C,. pH-Responsive nanodrug encapsulated by tannic acid complex for controlled drug delivery [J]., 2017, 7(5): 2829-2835.
[25] Huang X Y, Shi Q, Du S Y,. Poly-tannic acid coated paclitaxel nanocrystals for combinational photothermal-chemotherapy [J]., 2021, 197: 111377.
[26] 邹媛. 基于光热疗法联合瘤内注射番荔素纳米粒治疗乳腺癌的研究[D]. 北京: 北京协和医学院, 2021.
Polytannic acid coated PLGA nanoparticles loaded with β-elemene for combined chemo-photothermal therapy in cancer treatment
RUAN Ming-yue, WU Kai, ZHOU Zhan-rong, DENG Jia-ling, HAN Bing-xin, DU Shou-ying, HAN Ning
School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102488, China
To achieve combined chemo-photothermal therapy for improved anti-tumor efficacy, β-elemene (Ele) with anti-tumor effect was encapsulated into poly(,-lactide-co-glycolic acid) nanoparticles (Ele-PLGA NPs) and coated with a poly-tannic acid (pTA) layer to obtain Ele-PLGA-pTA NPs.Firstly, Ele-PLGA NPs were prepared by an O/W emulsification method, then the following added with tannic acid and Fe3+could coordinate with each other and form a steady pTA layer on the surface of Ele-PLGA NPs to obtain Ele-PLGA-pTA NPs. The prepared Ele-PLGA-pTA NPs were characterized in particle size, ζ potential, stability and morphology through DLS and TEM. The drug loading efficiency of β-elemene and the coating rate of tannic acid were quantified by HPLC and the BCA kit, respectively. In addition, the photothermal effect and photothermal stability of PLGA-pTA NPs were evaluated by an IR camera and analyzed by the FLIR software. The cytotoxicity of Ele-PLGA-pTA NPs on Lewis lung cancer cell (LLC) was investigated by MTT assay. And theanti-tumor efficacy was explored on LLC tumor bearing mice.For the prepared Ele-PLGA-pTA NPs, the drug loading efficiency of β-elemene and the coating rate of tannic acid were (6.6 ± 0.1)% and (5.4 ± 0.1)%, respectively. Ele-PLGA-pTA NPs were spherical in shape, the ζ potential was (−37.5 ± 0.2) mV and the particle size was (202.9 ± 2.7) nm with good dispersibility. PLGA-pTA NPs exhibited high photothermal conversion effficiency and photothermal stability. Compared to single chemotherapy (Ele-PLGA-pTA NPs), the combined chemo-photothermal therapy (Ele-PLGA-pTA NPs + Laser) showed significantly enhanced cytotoxicity, while blank control (PLGA-pTA NPs) almost had no cytotoxicity. Also, the tumor inhibition rate for the combined chemo-photothermal therapy (Ele-PLGA-pTA NPs + Laser) was much higherthan that for single chemotherapy (Ele-PLGA-pTA NPs) or photothermal therapy (PLGA-pTA NPs + Laser) (< 0.001).Ele-PLGA-pTA NPs prepared could achieve combined chemo-photothermal therapy and improve the overall antitumor efficacy.
β-elemene; combined chemo-photothermal therapy; poly-tannic acid;nanoparticles; poly(,-lactide-co-glycolic acid);antitumor
R283.6
A
0253 - 2670(2022)23 - 7353 - 08
10.7501/j.issn.0253-2670.2022.23.005
2022-06-01
国家自然科学基金项目(81803737)
阮明月,女,硕士研究生,主要从事纳米制剂研究。Tel: 15207224220 E-mail: rmy15207224220@163.com
通信作者:杜守颖,女,博士生导师,教授,主要从事中药制剂研究。Tel: 13911053905 E-mail: dusy@bucm.edu.cn
韩 宁,女,博士,主要从事纳米制剂研究。Tel: 18500083932 E-mail: hanning1989@163.com
[责任编辑 郑礼胜]
